
湖南省醴陵二中、醴陵四中2016-2017学年高二下学期期中联考化学试卷
03月05日
2014年上海高考化学试题赏析
C.![]() 与
与![]() 具有完全相同的化学性质 D.
具有完全相同的化学性质 D. ![]() 与
与![]() 互为同位素
互为同位素
2.下列试剂不会因为空气中的氧气而变质的是
A.过氧化钠 B.氢硫酸 C.硫酸亚铁 D.苯酚
3.结构为…-CH=CH-CH=CH-CH=CH-CH=CH-…的高分子化合物用碘蒸气处理后,其导电能力大幅度提高。上述高分子化合物的单体是
A.乙炔 B.乙烯 C..丙烯 D.1,3-丁二烯
4.在“石蜡→液体石蜡→石蜡蒸气→裂化气”的变化过程中,被破坏的作用力依次是
A.范德华力、范德华力、范德华力 B.范德华力、范德华力、共价键
C.范德华力、共价键、共价键 D.共价键、共价键、共价键
5.下列分离方法中,和物质的溶解度无关的是
A.升华 B.萃取 C.纸上层析 D.重结晶
二、选择题(本题共36分,每小题3分,每题只有一个正确选项)
6.今年是门捷列夫诞辰180周年。下列事实不能用元素周期律解释的只有
A.碱性:KOH>NaOH B.相对原子质量:Ar>K
C.酸性:HClO4>H2SO4D.元素的金属性:Mg>Al
7.下列各组中两种微粒所含电子数不相等的是
A.H3O+和OH-B.CO和N2
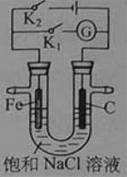
C.HNO2和 NO2-D.CH3+和NH4+
8.BeCl2熔点较低,易升华,溶于醇和醚,其化学性质与AlCl3相似。由此可推测BeCl2
A.熔融态不导电 B.水溶液呈中性
C.熔点比BeBr2高 D.不与NaOH溶液反应
9.1,3-丁二烯和2-丁炔分别与氢气反应的热化学方程式如下:
![]()
![]()
由此不能判断
A.1,3-丁二烯和2-丁炔稳定性的相对大小
B.1,3-丁二烯和2-丁炔分子储存能量的相对高低
C.1,3-丁二烯和2-丁炔相互转化的热效应
D.一个碳碳叁键的键能与两个碳碳双键的键能之和的大小
| 选项 | X | 收集气体 | Y |
| A | 碱石灰 | 氯化氢 | 水 |
| B | 碱石灰 | 氨气 | 水 |
| C | 氯化钙 | 二氧化硫 | 氢氧化钠 |
| D | 氯化钙 | 二氧化碳 | 氢氧化钠 |
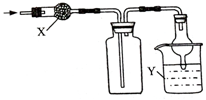
 A.C(Ca2+)、C(OH-)均增大 B.C(Ca2+)、C(OH-)均保持不变
A.C(Ca2+)、C(OH-)均增大 B.C(Ca2+)、C(OH-)均保持不变 A.a通入CO2,然后b通入NH3,c中放碱石灰
A.a通入CO2,然后b通入NH3,c中放碱石灰| 选项 | A | B | C | D |
| n(CO2)mol | 2 | 3 | 4 | 6 |
| n(沉淀) mol | 1 | 2 | 3 | 3 |
24.铜液中的氨可吸收二氧化碳,写出该反应的化学方程式:
25.简述铜液吸收CO及铜液再生的操作步骤(注明吸收和再生的条件)。
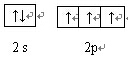
26.铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为
其中氮元素原子最外层电子排布的轨道表示式是
通过比较 可判断氮、磷两种元素的非金属性强弱。
27.已知CS2和CO2分子结构相似,CS2的电子式是
CS2熔点高于CO2,其原因是
五、(本题共12分)
硫在自然界中以游离态和多中化合态形式出现,硫的化合物大多具有氧化性或还原性,许多金属硫化物难溶于水。
完成下列填空:
28.硫化氢具有还原性,可以和许多氧化剂反应,在酸性条件下,H2S和KMnO4反应生成S、MnSO4、K2SO4和H2O,写出该反应的化学方程式:
29.石油化工的废气中有H2S,写出从废气中回收单质硫的两种方法(除空气外,不能使用其他原料),以化学方程式表示: 、 。
30.室温下0.1mol/L的硫化钠溶液和0.1mol/L的碳酸钠溶液,碱性更强的是 ,其原因是
已知:H2S:Ka1=1.3×10-7、Ka2=7.1×10-15
H2CO3 Ka1=4.3×10-7、Ka2=5.6×10-11 :
31.向ZnSO4溶液中加饱和H2S溶液,没有沉淀生成, 继续增加一定量的氨水后,生成ZnS沉淀,用电离平衡原理解释上述现象。
32.将黑色的Fe2S3固体加入足量的盐酸中,溶液中有淡黄色固体生成,产物还有 , ______ ,过滤,微热滤液,然后加入过量氢氧化钠溶液,可观察到的现象是 。
六、(本题共12分)
在精制饱和食盐水中加入碳酸氢铵可制备小苏打(NaHCO3),并提取氯化钠作为肥料或进一步提纯为工业氯化铵。
完成下列填空:
33.写出上述制备小苏打的化学方程式。
34.滤除小苏打后,母液提取氯化铵有两种方法:
①通入氨,冷却、加食盐,过滤 ②不通氨,冷却、加食盐,过滤
对两种方法的评价正确的是 ,(选填编号)
a. ①析出的氯化铵纯度更高 b. ②析出的氯化铵纯度更高
c. ①的滤液可以直接循环使用 d. ②的滤液可直接循环使用
35.提取的NH4Cl中含少量Fe2+、SO42-,将产品溶解,加入H2O2,加热至沸,再加入BaCl2溶液,过滤,蒸发结晶,得到工业氯化铵。
加热至沸的目的是 。
滤渣的主要成分是 、 。
36.称取1.840g小苏打样品(含少量NaCl),配置成250mL溶液,取出25.00mL,用0.1000
-mol·L1盐酸滴定,消耗盐酸21.50mL。
实验中所需的定量仪器出滴定管外,还有 。
选甲基橙而不选酚酞作为指示剂的原因是 。
样品中NaHCO3质量分数为 。(保留3位小数)
37.将一定量小苏打样品(含少量NaCl)溶于足量盐酸,蒸干后称量固体质量,也可测量定小苏打的含量。若蒸发过程中有少量液体溅出,则测定结果 。(选填“偏高”、“偏低”或“不受影响”)
七、(本题共12分)
氯气和氯乙烯都是非常重要的化工产品,年产量均在107t左右,氯气的实验室制备和氯乙烯的工业生产都有多种不同方法。
完成下列填空:
38.实验室制取纯净的氯气,除了二氧化锰、浓盐酸和浓硫酸,还需要 、 (填写试剂或溶液名称)
39.实验室用2.00mol/L盐酸和漂粉精【成分为Ca(ClO)2、CaCl2】反应生产氯气、氯化钙和水,若产生2.24L(标准状况)氯气,发生反应的盐酸为 mL。
40.实验室通常用向上排空气法收集氯气。设计一个简单实验,验证所收集的氯气中是否含有空气。
41.工业上用电石-乙炔生产氯乙烯的反应如下:
CaO+3CCaC2+CO↑
CaC2+2H2O![]() C2H2↑+Ca(OH)2
C2H2↑+Ca(OH)2
HC≡CH+HClCH2=CHCl
电石-乙炔法的优点是流程简单,产品纯度高,而且不依赖与石油资源。
电石-乙炔法的缺点是: 、 。
42.乙烷和氯气反应可制得ClCH2CH2Cl,ClCH2CH2Cl加热分解得到氯乙烯和氯化氢。
设计一种以乙烯和氯气为原料制取氯乙烯的方案(其他原料自选),用化学方程式表示(不必注明反应条件)。
要求:①反应产生的氯化氢必须用于氯乙烯的制备;②不再产生其他废液。
八、(本题共8分)
许多有机化合物具有酸碱性。
完成下列填空
43.苯酚、苯甲醇、苯甲酸、碳酸的酸性由强到弱的顺序为:
苯胺( )具有 。(选填“酸性”、“碱性”或“中性”)
44.常常利用物质的酸碱性分离混合物。某一混合物含苯酚、苯甲醇、苯甲酸和苯胺四种物质,其分离方案如下图。
已知:苯甲醇、苯甲酸、苯胺微溶于水。
A是 ,B是 ,C是 。
上述方案中,若首先仅仅将苯甲酸与其他三种物质分开,则应加入 。
45.欲将 转化为 ,则应加入 。
九、(本题共14分)
M是一种资料直肠癌和小细胞肿瘤药物的主要成分,其结构为
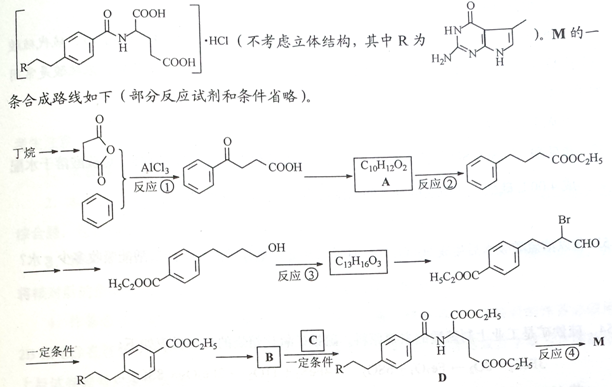
完成下列填空:
46.写出反应类型: 反应① 反应③
47.写出反应试剂和反应条件:反应② 反应④
48.写出结构简式:B C
49.写出一种满足下列条件的A的同分异构体的结构简式。
(1)能与FeCl3溶液发生显色反应; (2)能发生银镜反应;
(3)分子中有5种不同化学环境的氢原子。
50.丁烷氯化可得到2-氯丁烷,设计一条从2-氯丁烷合成1,3-丁二烯的合成路线。
(合成路线常用的表示方式为:![]() )
)
51.已知:RCONHR/与RCOOR/的化学性质相似。
从反应④可得出的结论是: 。
十、(本题共14分)
硫有多种含氧酸,亚硫酸(H2SO3)、硫酸(H2SO4)、焦硫酸、硫代硫酸(H2S2O3)等等,其中硫酸最为重要,在工业上有广泛的应用,在实验室,浓硫酸是常用的干燥剂。
完成下列计算:
52.焦硫酸(H2SO4·SO3)溶于水,其中的SO3都转化为硫酸,若将445g焦硫酸溶于水配成4.00L硫酸,该硫酸的物质的量浓度为 mol·L-1。
53.若以浓硫酸吸水后生成H2SO4·H2O计算,250g质量分数为98%的硫酸能吸收多少g水?
54.硫铁矿苏工业上制作硫酸的主要原料,硫铁矿氧化焙烧的化学反应如下:
3FeS2+8O2![]() Fe3O4+6SO2,4FeS2+11O2
Fe3O4+6SO2,4FeS2+11O2![]() 2Fe2O3+8SO2,
2Fe2O3+8SO2,
若48mol FeS2完全反应耗用氧气2934.4L(标准状况);计算反应产物中Fe3O4与Fe2O3物质的量之比。
55.用硫化氢制取硫酸,既能充分利用资源又能保护环境,是一种很有发展前途的制备硫酸
的方法。
硫化氢体积分数为0.84的混合气体H2S、H2O、N2)在空气中完全燃烧,若空气过量77%,计算产物气体中SO2体积分数(水是气体)。
已知空气组成:N2体积分数0.79、O2体积分数0.21。
参考答案
一、选择题(本题共10分,每小题2分)
1.D2.A3.A4.B5.A
二、选择题(本题共36分,每小题3分)
6.B7.D8.A9.D10.C11.B
12.B13.C14.D15.C16.C17.B
三、选择题(本题共20分,每小题4分,每小题有一个或两个正确选项。只有一个正确选项的,多选不给分:有两个正确选项的,选对一个给2分,选错一个,该小题不给分)
18.BD19.D20.C21.AD22.AC
四、(本题共12分)
23.bc
24.![]()
![]()
25.①低温加压下吸收CO;②然后将铜洗液转移至另一容器中;③高温低压下释放CO,然后将铜洗液循环利用
26.C>N>O>H;
![]() 和
和![]() 的稳定性
的稳定性
27.![]() ;
;![]() 和
和![]() 都是分子晶体,
都是分子晶体,![]() 相对分子质量大,分子间作用力大。
相对分子质量大,分子间作用力大。
五、(本题共12分)
28.![]()
29.![]() ,
,![]() ;
;
![]()
30.硫化钠溶液;硫化氢的![]() 小于碳酸的
小于碳酸的![]() ,硫化钠耿易水解。
,硫化钠耿易水解。
31.饱和![]() 溶液中电离产生的
溶液中电离产生的![]() 很少,因此没有沉淀。加入氨水后,促进
很少,因此没有沉淀。加入氨水后,促进![]() 的电离,
的电离,![]() 离子浓度增大,有沉淀产生。
离子浓度增大,有沉淀产生。
32.氯化亚铁 硫化氢;先有白色沉淀产生,然后沉淀转化为灰绿色,最终转化为红褐色。
六、(本题共12分)
33.![]()
34.ad
35.使![]() 完全水解为
完全水解为![]() ;
;![]() 、
、![]()
36.电子天平、250mL容量瓶;选用酚酞作为指示剂,不能确定滴定终点;0.982
37.偏高
七、(本题共12分)
38.饱和氯化钠溶液、氢氧化钠溶液
39.100
40.用试管收集氯气,收集满后将试管倒立在氢氧化钠溶液中,观察试管内有无残留气体。
41.高能耗会污染环境
42.答案示例:
![]()
![]()
![]()
八、(本题共8分)
43.苯甲酸>碳酸>苯酚>苯甲醇碱性
44.NaOH溶液或![]() 溶液
溶液![]() 硫酸
硫酸![]() 溶液
溶液
45.![]()
九、(本题共14分)
46.取代反应氧化反应
47.![]() 、浓硫酸、加热;
、浓硫酸、加热;
(1)![]() ,加热(2)盐酸;或盐酸、加热
,加热(2)盐酸;或盐酸、加热
48.
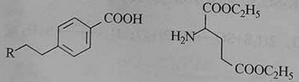
49.
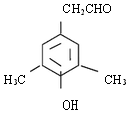
50.
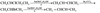
51.酰胺(肽键)水解比醋水解困难
十、(本题共14分)
52.1.25mol/L
53.250×98%÷98×16=40克
54.2934.4÷22.4=131mol设![]() amol
amol![]() bmol
bmol
3a+2b=488a+11÷2b=131a=4b=18
![]()
55.设混合气体为1体积,0.84体积硫化氢完全燃烧生成0.84体积二氧化硫和2.84体积水,消耗1.26体积氧气。
所需空气为1.26÷0.21×1.77=10.62体积
![]() =0.84÷(10.62-1.26+1.84)=0.075
=0.84÷(10.62-1.26+1.84)=0.075