湖南省醴陵二中、醴陵四中2016-2017学年高二下学期期中联考化学试卷
03月05日
2014年高考海南化学试题赏析
第Ⅰ卷
一、选择题:本题共6小题,每小题2分,共12分。在每小题给出的四个选项中,只有一个是正确的
1.化学与日常生活密切相关,下列说法错误的是( )
A.碘酒是指单质碘的乙醇溶液 B.84消毒液的有效成分是NaClO
C.浓硫酸可刻蚀石英制艺术品 D.装饰材料释放的甲醛会造成污染
2.下列有关物质性质的说法错误的是
A.热稳定性:HCl>HI B.原子半径:Na>Mg
C.酸性:H2SO3>H2SO4D.结合质子能力:S2—>Cl—
3.以石墨为电极,电解KI溶液(含有少量的酚酞和淀粉),下列说法错误的是
A.阴极附近溶液呈红色 B.阴极逸出气体
C.阳极附近溶液呈蓝色 D.溶液的PH变小
4.标准状况下,气态分子断开1mol化学键的焓变称为键焓。已知H—H,H—O,和O==O键的键焓△H分别为436KJ/mol,463KJ/mol,495KJ/mol,下列热化学方程式正确的是
A.H2O(g)==H2(g)+1/2O2(g) △H =—485KJ/mol
B.H2O(g)==H2(g)+1/2O2(g) △H = + 485KJ/mol
C.2 H2(g) + O2(g)==2 H2O(g) △H = + 485KJ/mol
D.2 H2(g) + O2(g)==2 H2O(g) △H =—485KJ/mol
5.下列除杂操作可行的是
A.通过浓硫酸除去HCl中的H2O B.通过灼热的CuO除去H2中的CO
C.通过灼热的镁粉除去N2中的O2D.通过水除去CO中的CO2
6.NaOH溶液滴定盐酸的实验中,不必用到的是
A.酚酞 B.圆底烧瓶 C.锥形瓶 D.碱式滴定管
二、选择题:本题共6小题,每小题4分,每小题有1~2个选项符合题意。若正确答案只包括一个选项,多选的0分,若正确答案包括两个选项,只选一个且正确得2分,选两个且正确得4分,但只要选错一个就得0分。
7.下列有关物质水解的说法正确的是
A.蛋白质水解的最终产物是多肽 B.淀粉水解的最终产物是葡萄糖
C.纤维素不能水解成葡萄糖 D.油脂水解产物之一是甘油
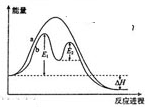 8.某反应工程能量变化如图所示,下列说法正确的是
8.某反应工程能量变化如图所示,下列说法正确的是
A.反应过程a有催化剂参与
B.该反应为放热反应,热效应等于△H
C.改变催化剂,可改变该反应的活化能
D.有催化剂的条件下,反应的活化能等于E1+E2
9.下列有关物质应用的说法错误的是
A.玻璃容器可长期盛放各种酸 B.纯碱可用于清洗油污
B.浓氨水可检验氯气管道泄漏 D.Na2S可除去污水中的Cu2+
10.下列关于物质应用和组成的说法正确的是
A.P2O5可用于干燥Cl2和NH3B.“可燃冰”的主要成分是甲烷和水
C.CCl4可用于鉴别溴水和碘水 D.Si和SiO2都用于制造光导纤维
11.室温下,用0.100mol/L NaOH溶液分别滴定20.00ml 0.100mol/L 的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是
A.Ⅱ 表示的是滴定盐酸的曲线
B.PH=7时,滴定醋酸消耗V(NaOH)小于20ml
C.V(NaOH) =20ml时,C(Cl— )== C(CH3COO— )
D.V(NaOH) =10ml时,醋酸溶液中:
C(Na+ )> C(CH3COO— )> C(H+ )> C(OH— )
12.将BaO2放入密闭真空容器中,反应2BaO2(s)![]() 2BaO(s)+O2(g)达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是
2BaO(s)+O2(g)达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是
A.平衡常数减小 B.BaO量不变 C.氧气压强不变 D.BaO2量增加
第Ⅱ卷
本题包括必考题和选考题两部分,第13题—第17题为必考题,每个试题考生都必须作答,第18—20题为选考题,考生根据要求作答。
13.(9分)4种相邻主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性。回答下列问题:
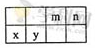 (1)元素x在周期表中的位置是___________周期,___________族,
(1)元素x在周期表中的位置是___________周期,___________族,
其单质可采用电解熔融___________的方法制备。
(2)m、n、y三种元素最高价氧化物的水化物中,酸性最强的是___________,碱性最强的是___________(填化学式)。
(3)气体分子(mn)2的电子式为___________,(mn)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为_________________________________。
14.(9分)硝基苯甲酸乙酯在OH—存在下发生水解反应:
O2NC6H4COOC2H5+OH-![]() O2NC6H4COO-+C2H5OH
O2NC6H4COO-+C2H5OH
两种反应物的初始浓度均为0.050mol/L ,15°C时测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示,回答下列问题:
| t/s | 0 | 120 | 180 | 240 | 330 | 530 | 600 | 700 | 800 |
| α/% | 0 | 33.0 | 41.8 | 48.8 | 58.0 | 69.0 | 70.4 | 71.0 | 71.0 |
(1)列式计算该反应在120~180s与180~240s区间的平均反应速率
__________ ,
__________ ;
比较两者大小可得出的结论是______________________________ 。
(2)列式计算15°C时该反应的平衡常数____________________ 。
(3)为提高O2NC6H4COOC2H5的平衡转化率,除可适当控制反应温度外,还可以采取的措施有______________________________(要求写出两条)。
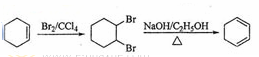
15.(8分)卤代烃在生产生活中具有广泛的应用,回答下列问题:
(1)多氯代甲烷常为有机溶剂,其分子结构为正四面体的是__________,工业上分离这些多氯代物的方法是____________________。
(2)三氟氯溴乙烷(CF3CHClBr)是一种麻醉剂,写出其所有同分异构体的结构简式__________(不考虑立体异构)。
(3)聚氯乙烯是生活中常用的塑料,工业生产聚氯乙烯的一种工艺路线如下:
反应①的化学方程式为________________________________________ ,反应类型为__________,反应②的反应类型为__________。
16.(9分)锂锰电池的体积小,性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。回答下列问题:
(1)外电路的电流方向是由__________极流向__________极。(填字母)
(2)电池正极反应式为________________________________________。
(3)是否可用水代替电池中的混合有机溶剂?__________
(填“是”或“否”)
原因是_______________ 。
(4)MnO2可与KOH和KClO4在高温条件下反应,生成K2MnO4,反应的化学方程式为_____________________________________ ,K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物质的量之比为______________。
17.(9分)硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革的还原剂,它受热、遇酸易分解。工业上可用反应:2 Na2S + Na2CO3+ 4SO2 == 3 Na2S2O3 + CO2制得,实验室模拟该工业过程的装置如图所示,回答下列问题:
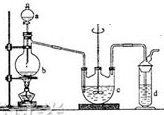
(1)b中反应的离子方程式为______________________________________ ,c中试剂为__________ 。
(2)反应开始后,c中先有浑浊产生,后又变为澄清,此浑浊物是____________。
(3)d中的试剂为__________________。
(4)实验中要控制SO2生成速率,可采取的措施有__________________(写出两条)
(5)为了保证硫代硫酸钠的产量,实验中通入SO2不能过量,原因是
________________________ 。
【选考题】【有机化学基础】
18—Ⅰ(6分)
图示为一种天然产物,具有一定的除草功效,下列有关该化合物的说法错误的是
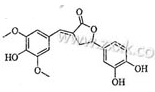 A.分子中含有三种含氧官能团
A.分子中含有三种含氧官能团
B.1 mol 该化合物最多能与6 mol NaOH 反应
C.既可以发生取代反应,又能够发生加成反应
D.既能与FeCl3发生显色反应,也能和NaHCO3反应放出CO2
18—Ⅱ(14分)
1,6— 己二酸(G)是合成尼龙的重要原料之一,可用六个碳原子的化合物氧化制备。下图为A通过氧化反应制备G的反应过程(可能的反应中间物质为B、C、D、E和F)。
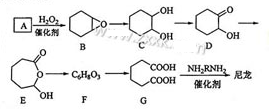
回答下列问题:
(1)化合物A中含碳87.8%,其余为氢,A的化学名称为________________。
(2)B到C的反应类型为________________。
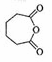
(3)F的结构简式为________________。
(4)在上述中间物质中,核磁共振氢谱出峰最大的是___________,最少的是____________(填化合物代号)。
(5)由G合成尼龙的化学方程式为________________________________。
(6)由A通过两步制备1,3—环己二烯的合成线路为________________________________。
参考答案
一、选择题:本题共6小题,每小题2分,共12分。
1.赏析:考察生活化学知识。二氧化硅不能与浓硫酸反应,不能用浓硫酸可刻蚀石英制艺术品,而是用氢氟酸。选择C。
2.赏析:考察物质性质的比较,涉及热稳定性、原子半径、酸性、碱性的比较。C项,亚硫酸是弱酸,硫酸是强酸,选择C。
3.赏析:考察电解原理。电解KI溶液溶液,阳极产生I2,阴极产生KOH和H2,溶液的PH值变大。D错误,选择D。
4.赏析:考察键能与△H的相互关系。按C项反应,△H=2×436+495-4×463=-485 KJ/mol,选择D。
5.赏析:考察物质的除杂方法和除杂试剂。A项可行,B项氢气也与CuO反应,C项氮气也会与Mg反应,D项二氧化碳虽然可溶于水但溶解性不大。选择A。
6.赏析:考察酸碱中和滴定,不能用到的仪器是圆底烧瓶。选择B。
二、选择题:本题共6小题,每小题4分,每小题有1~2个选项符合题意。若正确答案只包括一个选项,多选的0分,若正确答案包括两个选项,只选一个且正确得2分,选两个且正确得4分,但只要选错一个就得0分。
7.赏析:考察有机水解知识。涉及蛋白质、淀粉、纤维素和油脂的水解。蛋白质水解的最终产物是氨基酸,纤维素可以水解生成葡萄糖。选择BD。
8.赏析:考察能量图像分析。从能量图像看,反应物的总能量高于生成物总能量,是一个放热反应,b曲线降低活化能,有催化剂参加,活化能是E1,改变催化剂,可改变活化能。选择BC。
9.赏析:考察物质的化学性质和用途。A项,二氧化硅能够与氢氟酸反应,玻璃容器可长期盛放氢氟酸,错误,选择A。
10.赏析:考察物质的化学式和用途。A项,P2O5不能干燥氨气;D项,Si不能直接制造光导纤维。选择BC。
11.赏析:考察中和滴定涉及的电离平衡和水解平衡。从滴定曲线起点PH值,HCl是强酸,醋酸是弱酸,I是滴定盐酸的曲线,Ⅱ是滴定醋酸的曲线;考虑生成的NaCl呈中性,醋酸钠成碱性,滴定醋酸时要呈中性,醋酸要过量,所以PH=7时,滴定醋酸消耗V(NaOH)小于20ml;恰好完全反应,考虑醋酸根离子的水解,所以V(NaOH) =20ml时,
C(Cl—)>C(CH3COO—);V(NaOH) =10ml时,醋酸溶液中,实际是CH3COOH和CH3COOH
混合溶液,醋酸的电离能力强于醋酸根离子的水解能力,溶液呈酸性。C(CH3COO— )>C(Na+ )> C(H+ )> C(OH—),所以选择B。
12.赏析:考察化学平衡移动原理,增大压强,平衡朝气体分子数减小的方向移动,平衡常数不变,BaO的量减小,氧气的浓度不变,压强不变,BaO2量增加。选择CD。
本题包括必考题和选考题两部分,第13题—第17题为必考题,每个试题考生都必须作答,第18—20题为选考题,考生根据要求作答。
13.(9分)赏析:考察元素周期律和元素周期表。y的氧化物具有两性,x是Al,Mg是Si,m是C,n是N。x位于第三周期第ⅡA族,Mg通过电解熔融的MgCl2的方法;C、Mg、Al三种元素最高价氧化物的水化物中,酸性最强的是HNO3,碱性最强的是Al(OH)3,(CN)2的结构式是N≡C-C≡N,根据拟卤素性质,与氢氧化钠反应生成NaCN、NaCNO和H2O。
参考答案:
(1)三;ⅡA;MgCl2;
(2)HNO3:Al(OH)3;
(3)![]() ;(CN)2+2NaOH===NaCN+NaCNO+H2O
;(CN)2+2NaOH===NaCN+NaCNO+H2O
14.(9分)赏析:考察化学反应速率与化学平衡。根据表格,120~180s的化学反应速率为
V(O2NC6H4COOC2H5)= =7.3×10—5mol·L-1·s-1;
V(O2NC6H4COOC2H5)= =5.8×10—5mol·L-1·s-1;
随着反应的进行,反应物的浓度降低,反应速率减小。
K==6.0
要通过转化率,可以增大OH-浓度,及时分离出生成物。
(1)V(O2NC6H4COOC2H5)= =7.3×10—5mol·L-1·s-1;
V(O2NC6H4COOC2H5)= =5.8×10—5mol·L-1·s-1;
随着反应的进行,反应物的浓度降低,反应速率减小。
(2)K==6.0
(3)可以增大OH-浓度,及时分离出生成物。
15.(8分)赏析:以乙烯为载体考察有机化合物知识。呈正四面体的是四氯化碳,分离是蒸馏,同分异构用减F换位的思考方法;乙烯→1,2-二氯乙烷是加成反应,1,2-二氯乙烷→氯乙烯是消去反应,氯乙烯→聚氯乙烯是加聚反应。
(1)CCl4;蒸馏
(2)CHF2-CFBrCl;CHFCl-CF2Br;CHFBr- CF2Cl
(3)CH2=CH2+Cl2![]() ClCH2CH2Cl;加成反应;消去反应
ClCH2CH2Cl;加成反应;消去反应
16.(9分)赏析:考察原电池原理。从图中看出,Li失去电子,作负极,Li-e-===Li+; MnO2得到电子,作正极,MnO2+e-+Li+===LiMnO2;电子由a→b,电流由b→a,考虑Li很活泼,不能用水作溶剂,而采用络合有机溶剂。考虑氧化还原反应规律,MnO2可与KOH和KClO4在高温条件下反应的产物有K2MnO4、KCl和水,考虑电子守恒,建立关系式
2KMnO4—MnO2。
(1)b;a;
(2)MnO2+e-+Li+===LiMnO2;
(3)否;Li很活泼,容易与水反应
(4)3MnO2+KClO3+6KOH![]() KCl+3K2MnO4+3H2O;2:1
KCl+3K2MnO4+3H2O;2:1
17.(9分)赏析:考察化学实验。亚硫酸钠与在b中与酸反应产生二氧化硫,通入Na2S 和 Na2CO3的混合溶液生成Na2S2O3;在生成过程中,先与Na2S生成的H2S生成S,S与生成的Na2SO3反应生成产物。
(1)SO32-+2H+===SO2↑+H2O;Na2S 和 Na2CO3的混合溶液;
(2)S
(3)NaOH溶液
(4)控制反应温度;调节酸的滴加速率;
(5)若二氧化硫过量,溶液呈酸性,会与产物反应。
【选考题】【有机化学基础】
18—Ⅰ(6分)赏析:根据结构信息,含有酚羟基、酯基、醚键三种含氧官能团,3mol酚羟基和1mol酯基可最多能与4 mol NaOH 反应;碳碳双键和苯环能够加成,酯基、苯环和酚羟基能够取代;没有羧基,不能能和NaHCO3反应放出CO2。选择AC。
18—Ⅱ(14分)赏析:以1,6— 己二酸的合成流程为载体考察有机化合物知识。突破口是A,A是烃,C、H原子个数比为:=3:5;根据B的6个C,A的分子式为C6H10,A→B是碳碳双键的氧化成醚,B→C,是C—O与水的加成反应,C→D是—OH的氧化反应,E→F是酯基的水解反应,F→G是氧化反应。核磁共振峰,B有3种,C有4种,D有6种,E有6种,F有2种,G有3种。A通过与溴的加成,在和NaOH的醇溶液消去就可以得到1,3—环己二烯。
(1)环己烯
(2)加成反应
(3)
(4)DE;F
(5)nHOOC-(CH2)6-COOH+H2NRNH2→
(6)