
2018江苏生物高考真题
03月10日
高二化学上学期期中考试题
(时间:90分钟,满分:100分) 命题人:陈焕生
一、单项选择题(本题包括20小题,每小题3分,共60分。在每小题给出的四个选项中,只有一个选项符合题目要求)
某学生的实验报告所列出的下列数据中合理的是( )
A.用10mL量筒量取7.16mL稀盐酸
B.用托盘天平称量25.20gNaCl
C.用广泛pH试纸测得某溶液的pH为2.3
D.用25mL滴定管进行中和滴定时,用去某浓度的碱溶液21.70mL
下列方程式书写正确的是( )
A.HCO在水溶液中的水解方程式:HCO+H2O![]() H3O++CO
H3O++CO
B.H2SO3的电离方程式:H2SO3![]() 2H++SO
2H++SO
C.CO的水解方程式:CO+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D.CaCO3的电离方程式:CaCO3====Ca2++CO
水是最宝贵的资源之一。下列表述正确的是( )
A.4℃时,纯水的pH=7
B.温度升高,纯水中的c(H+)增大,c(OH-)减小
C.水的电离程度很小,纯水中主要存在形态是水分子
D.向水中加入酸或碱,都可抑制水的电离,使水的离子积减小
下列有关pH或c(H+)变化的判断中,正确的是( )
A.温度升高,纯水的pH不变
B.加水稀释,碳酸钠溶液的c(H+)减小
C.温度升高,硫酸溶液的c(H+)基本不变
D.pH=5的盐酸稀释1000倍后,溶液的pH变为8
下列叙述正确的是( )
A.pH=3和pH=5的盐酸各10mL混合,所得溶液的pH=4
B.溶液中c(H+)越大,pH值也越大,溶液的酸性就越强
C.液氯虽然不导电,但溶解于水后导电情况良好,因此,液氯也是强电解质
D.当温度不变时,在纯水中加入强碱溶液不会影响水的离子积常数
从植物花汁中提取的一种有机物HIn,可作酸碱指示剂,在水溶液中存在电离平衡:HIn(红色)![]() H++In-(黄色),对上述平衡解释不正确的是( )
H++In-(黄色),对上述平衡解释不正确的是( )
A.升高温度平衡向正方向移动
B.加入盐酸后平衡向逆方向移动,溶液显红色
C.加入NaOH溶液后平衡向正方向移动,溶液显黄色
D.加入NaHSO4溶液后平衡向正方向移动,溶液显黄色
常温下,把1mL0.1mol·L-1的H2SO4加水稀释制成2L溶液,在此溶液中由水电离产生的H+浓度接近于( )
A.1.0×10-4mol·L-1B.1.0×10-8mol·L-1
C.1.0×10-11mol·L-1D.1.0×10-10mol·L-1
等体积等物质的量浓度的MOH强碱溶液和HA弱酸溶液混合后,混合溶液中有关离子浓度关系正确的是( )
A.c(M+)>c(OH-)>c(A-)>c(H+) B.c(M+)>c(A-)>c(H+)>c(OH-)
C.c(M+)>c(A-)>c(OH-)>c(H+) D.c(M+)+c(H+)>c(A-)+c(OH-)
下列各组离子中能大量共存,且溶液为无色透明的是( )
A.K+、Al3+、Cl-、AlO B.Na+、H+、NO、HCO
C.Na+、H+、NO、SO D.Ca2+、Cl-、SO、NH
10.下列有关实验操作的说法错误的是( )
A.中和滴定时盛待测液的锥形瓶中有少量水对滴定结果无影响
B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口
C.滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管中的液面
D.称量时,称量物放在称量纸上,置于托盘天平的左盘,砝码放在托盘天平的右盘
11.常温下,下列离子能使纯水中的H+离子数目增加的是( )
A.S2- B.CO32- C.NH4+ D.Br-
12.将氨水缓缓地滴入盐酸中至中性,下列有关的说法:①盐酸过量 ②氨水过量 ③恰好完全反应 ④c(NH4+)=c(Cl-) ⑤c(NH4+)<c(Cl-) 正确的是( )
A.①⑤B.③④C.②⑤D.②④
13.在2L密闭容器中进行如下反应:mX(g)+nY(g)===pZ(g)+qQ(g),2s时间内X表示的平均反应速率为0.3m/pmol/(L·s),则2s时间内,物质Q增大的物质的量为( )
A.1.2q/p mol B.1.2m/p mol C.1.6q/pmolD.0.6q/pmol
14.向某无色透明溶液中加入铝片,立刻有大量氢气产生,则下列离子在该溶液中一定不会大量存在的是( )
A、Na+ B、NO3- C、CO32- D、HCO3-
15.在配置Al2(SO4)3溶液时,为了防止发生水解,可以加入少量的下列物质是( )
A.盐酸溶液 B.硫酸溶液 C.氢氧化钠溶液 D.硫酸钾溶液
16.当弱电解质在溶液中达到电离平衡时,溶液中已电离的电解质分子数占原来总分子数的百分数叫做该电解质的电离度。现欲粗略测定一定未知浓度的醋酸溶液中的醋酸的电离度,应做的实验和所需的试剂(或试纸)是( )
A、蒸发、NaOH溶液 B、蒸馏、Na2CO3溶液
C、中和反应、石蕊溶液 D、中和滴定、pH试纸
17.下列判断那些是正确的( )
①氢氧化钠是电解质 ②强电解质溶液的导电性一定比弱电解质溶液导电性强 ③氯化银难溶于水,所以氯化银是非电解质 ④蔗糖易溶于水,所以蔗糖是电解质 ⑤氯气溶于水后导电,所以氯气是电解质
A.① B.①③ C.①②⑤ D.①②③⑤
18.下列事实能说明醋酸是弱电解质的是( )
①醋酸与水能以任意比互溶;②醋酸溶液能导电;③醋酸稀溶液中存在醋酸分子;④常温下,0.1 mol/L醋酸的pH比0.1mol/L盐酸的pH大;⑤醋酸能和碳酸钙反应放出CO2;⑥0.1mol/L醋酸钠溶液pH=8.9;⑦大小相同的铁片与同物质的量浓度的盐酸和醋酸反应,醋酸产生H2速率慢;⑧pH=a的溶液的物质的量浓度等于pH=a+1的溶液的物质的量浓度的10倍
A.②⑥⑦⑧ B.③④⑥⑦ C.③④⑥⑧ D.①②
19.为了使稀硫化钠溶液中c(Na+)/c(S2-)的比值变小,可加入的物质是( )
A、适量的盐酸 B、适量的NaOH溶液
C、适量的FeCl2溶液 D、适量的Na2S固体
20.物质的量浓度相同的下列溶液中,含粒子(分子和离子)种类最多的是( )
A、NaCl B、CH3COONa C、氨水 D、K2CO3
二、非选择题(共40分)
21.(6分)pH值相同的HCl、H2SO4、CH3COOH各100毫升
A、HCl最快 B、H2SO4最快 C、CH3COOH最快 D、一样快
22.(8分)现有浓度均为0.1mol·L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水,请回答下列问题:
23.(4分)醋酸是日常生活中最常见的调味剂和重要的化工原料,醋酸钠是其常见的盐。(已知:25 ℃,Ka(CH3COOH)=1.69×10-5)。请回答:
A.稀释醋酸溶液,醋酸的电离程度增大,而稀释醋酸钠溶液则醋酸钠的水解程度减小
B.升高温度可以促进醋酸电离,而升高温度则会抑制醋酸钠水解
C.醋酸和醋酸钠的混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离
D.醋酸和醋酸钠的混合液中,醋酸促进醋酸钠的水解、醋酸钠也促进醋酸的电离
24. (13分)某同学用中和滴定法测定某烧碱的纯度,实验过程如下:
| 实验次数编号 | 盐酸溶液体积V(mL) | 氢氧化钠溶液体积V(mL) |
| 1 | 19.90 | 10.00 |
| 2 | 20.10 | 10.00 |
| 3 | 22.00 | 10.00 |
| 4 | 20.00 | 10.00 |
①碱式滴定管用蒸馏水洗净后没有用待测液润洗
②终点读数时俯视(滴定前读数准确)
③锥形瓶用蒸馏水洗净后没有用待测液润洗
④酸式滴定管尖端气泡没有排除,滴定后消失
⑤酸式滴定管用蒸馏水洗净后没有用标准液润洗
⑥振荡时锥形瓶中液滴飞溅出来
25 .(5分)工业上制备BaCl2的工艺流程图如图所示:
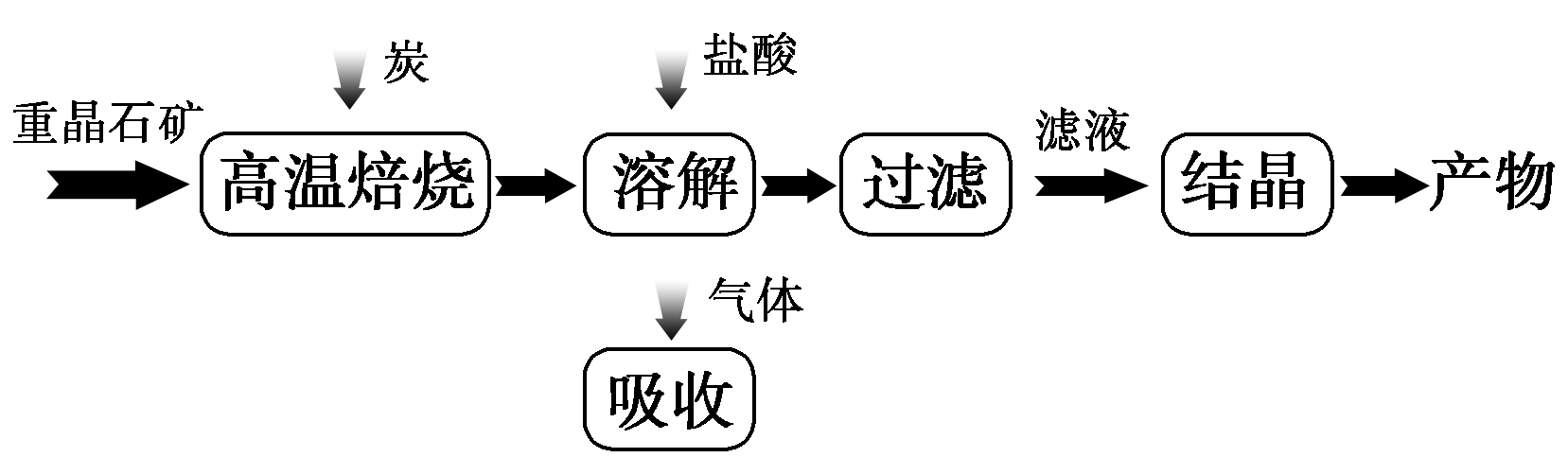
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得:
BaSO4(s)+4C(s)![]() 4CO(g)+BaS(s)
4CO(g)+BaS(s)
ΔH1=+571.2 kJ·mol-1 ①
BaSO4(s)+2C(s)![]() 2CO2(g)+BaS(s)
2CO2(g)+BaS(s)
ΔH2=+226.2 kJ·mol-1 ②
26.(4分).已知室温时,0.1mol/L某一元酸HA在水中有0.1%发生电离,回答下列各问题:
高二化学上学期期中考试题答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| D | D | C | C | D | D | D | C | C | C | C | D | A | D | B | D | A | B | D | D |
21.(6分)(1)CH3COOH (2)CH3COOH (3)D
22.(8分)(1)④②③① (2)⑥④⑤⑦ (3)c(Cl-)=c(Na+)>c(OH-)>c(NH)>c(H+) (4)9∶2
23.(4分)(1)CH3COO-+H2O![]() CH3COOH+OH-(2)C
CH3COOH+OH-(2)C
24.(13分)(1) 250mL容量瓶、胶头滴管(有无量筒均可)
(2)①碱式 ②锥形瓶内溶液颜色的变化 溶液红色褪去(或由红色变为无色),并且半分钟内不复原 (3)0.4020 mol·L-1 98.05% (4)①②⑥ ①④
25.(5分)(1) +172.5
(2)使BaSO4得到充分的还原(或提高BaS的产量)
反应①②为吸热反应,炭和氧气反应放热维持反应所需高温
26.(4分) (1)1×10-7 (2)106