
湖南省醴陵二中、醴陵四中2016-2017学年高二下学期期中联考化学试卷
03月05日
高一化学月考试题(时间:90分钟,分值:100分,只交答题卡)
来源:可能用到的原子量:H 1 C12 N14 O16 Na23 Mg24 Al 27 S32 Cl 35.5 K39 Fe56Cu 64
一、单项选择题(本题包括18小题,1-13每小题3分,14-18每小题4分共59分)
| 1.在1L 1mol/L的氨水中,下列有关说法正确的是( ) |
| A. B.NH4+为1mol ,溶质质量为18g C.溶解状态的NH3分子为1mol,溶质质量为17g D.氨水中NH3、 |
2.有5种单核粒子,它们分别是、、+、2+、(“”内元素符号未写出),则它们所属元素种类有( )
A.2种 B.3种 C.4种 D.5种
3. X、Y、Z三种短周期元素在周期表中的位置如下图,X通过共用三对电子形成X2分子,下列说法不正确的是( )
| X | ||
| Y | Z |
A.化合物XZ3中各原子均满足8电子的稳定结构
B.X、Y、Z三种元素形成的含氧酸都是强酸
C.常温下,Z单质可与Y的氢化物发生置换反应
D.Z的气态氢化物比Y的气态氢化物更加稳定
4.下列性质的递变规律不正确的是( )
A.NaOH、KOH、CsOH碱性依次增强
B.Li、Na、K、Rb、Cs的失电子能力逐渐增强
C.Al3+、Mg2+、Na+的离子半径依次减小
D.F2、Cl2、Br2、I2的熔沸点依次升高,密度依次增大
5.下列说法正确的是( )
A.常温、常压下,只有一种元素的单质是液体
B.元素周期表中的所有元素都是从自然界中发现的
C.过渡元素不全是金属元素
D.常温、常压下,气态单质的分子都是由非金属元素的原子形成的
6.下列说法一定不正确的是( )
A.某些花岗石产生氡(Rn),从而对人体产生伤害,Rn的质量数是222
B.Se是人体必需的微量元素,Se和Se互为同位素
C.C-NMR(核磁共振)可用于含碳化合物的结构分析,C的中子数为6
D.原子结构示意图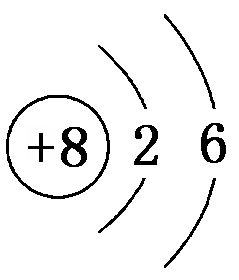 既可以表示16O,也可以表示18O
既可以表示16O,也可以表示18O
7.根据元素周期表判断,下列叙述不正确的是( )
A.周期表中第7周期共有32种元素
B.周期表中共有18个列,其中形成化合物种类最多的在第14列
C.除过渡元素外周期表中最外层电子数相同的元素都位于同一族中
D.L层电子为奇数的所有元素所在族的序数与该元素原子的L层电子数相等
8.目前人类已发现的非金属元素除稀有气体外,共16种。对这16种元素的相关判断:①都是主族元素,最外层电子数都大于4,②单质在反应中都只作氧化剂,③氢化物常温下都呈气态,④氧化物常温下都可以与水反应生成酸,其中不正确的是( )
A.只有①② B.只有①③ C.只有③④ D.①②③④
9.下图中,a、b、c、d、e为元素周期表中前四周期的一部分元素,下列有关叙述正确的是( )
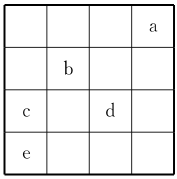
A.元素b位于ⅥA族,有+6、-2两种常见化合价
B.五种元素中,元素e的性质最稳定
C.元素c和d的最高价氧化物对应的水化物的酸性:c>d
D.元素c和e的气态氢化物的稳定性:c>e
来源:10. A和B是短周期元素,A2-和B+的核外电子总数之差为8,下列说法中正确的是( )
A.A和B的原子序数之差为8
B.A和B原子最外层电子数之和为8
C.A和B原子最外层电子数之和为3
D.A、B原子核外电子数总和可能为11
11.在某100ml的混合液中,硝酸和硫酸的物质量浓度分别是0.4mol/L,0.1mol/L,向该混合液中加入1.92g铜粉,加热,待充分反应后,所得溶液中铜离子物质量浓度是 ( )mol/L
A 0.15 B 0.225 C 0.35 D 0.45
12. X、Y、Z均为元素周期表中前20号元素,Xa+、Yb-、Z(b+1)-简单离子的电子层结构相同,下列说法正确的是( )
A.已知mXa+与nYb-,得m+a=n-b
B.离子半径:Yb->Z(b+1)->Xa+
C.Z(b+1)-的还原性一定大于Yb-
D.气态氢化物的稳定性Hb+1Z一定大于HbY
13. X、Y、Z、W四种元素在周期表中相对位置如图,Y、Z质子数之和为21,下列说法正确的是( )
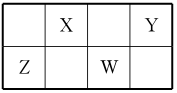 A.常温下,四种元素单质中,全部是固体
A.常温下,四种元素单质中,全部是固体
B.Z的阳离子与Y的阴离子电子层结构相同
C.X的气态氢化物比Y的气态氢化物稳定
D.W元素原子半径比Z元素原子半径小
14. X、Y、Z、W为周期表中前20号元素中的四种,原子序数依次增大,W、Y为金属元素,X原子的最外层电子数是次外层电子数的3倍,Y、Z位于同周期,Z单质是一种良好的半导体。W能与冷水剧烈反应,Y、Z原子的最外层电子数之和与X、W原子的最外层电子数之和相等。下列说法正确的是( )
A.原子半径:W>Y>Z>X
B.气态氢化物的稳定性:X 来源:C.最高价氧化物对应水化物的碱性:Y>W D.Y、Z的氧化物都有酸性和碱性 15.下列各组物质中,分子中的所有原子都满足最外层8电子结构的是( ) ①BeCl2、PF5②PCl3、N2③COCl2(光气)、SF6④XeF2、BF3⑤SO2、H2O2、HClO A.①② B.③④ C.② D.⑤ 16.两种短周期元素组成的化合物中,原子个数比为1:3,若两种元素的原子序数分别为a和b,则a和b的关系可能是( ) ①a=b+6 ②a+b=8 ③a+b=30 ④a=b+8 A.①②③ B.①②④ C.②③④ D.①②③④ 17.含n克HNO3的稀溶液恰好与m克Fe完全反应,若HNO3只被还原为NO,则n : m可能是 ①5 : 1、②9 : 2、③3 : 1、④2 : 1、⑤4 : 1 18.将Mg和 Cu的合金2.64克,投入适量的稀HNO3中恰好反应,固体全部溶解时,收集的还原产物为NO,体积为0.896L(标况),向反应后的溶液中加入2mol/L NaOH溶液60mL时,金属离子恰好完全沉淀,则形成沉淀的质量为 二、非选择题(本题包括4小题,共41分) 19.(10分)(1)请用下列4种物质的序号填空: ①O2②NH4NO3③K2O2④NH3,既有离子键又有极性键的是________。 (2)X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,其电子式为 _______________________________________________________。 (3)氯化铝的物理性质非常特殊,如:氯化铝的熔点为190℃(2.02×105Pa),但在180℃就开始升华。据此判断,氯化铝是________(填“共价化合物”或“离子化合物”),可以证明你的判断正确的实验依据是 _____________________________________________________________________。 (4)现有a~g 7种短周期元素,它们在周期表中的位置如下,请据此回答下列问题: ①元素的原子间反应最容易形成离子键的是________。 A.c和f B.b和g C.d和g D.b和e ②d与g元素形成的分子中所有原子________(填“是”或“不是”)都满足最外层为8电子 20.(8分)某学生课外活动小组利用右图所示装置分别做如下实验: (1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是________________溶液;加热时溶液由红色逐渐变浅的原因是: _______________________________________________________________。 (2)在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是________________溶液;加热时溶液由无色变为红色的原因是: _______________________________________________________________。 21.(11分)阅读下面信息,推断元素,按要求回答问题: 22.(12分)A、B、C、D、E、F是原子序数依次增大的短周期主族元素,A的最外层电子数是次外层电子数的2倍,B是短周期中金属性最强的元素,C是同周期中阳离子半径最小的元素,D元素的最高价氧化物对应水化物与B元素的最高价氧化物对应水化物反应的产物M是制备木材防火剂的原料,E的最外层电子数与内层电子数之比为3:5。请回答: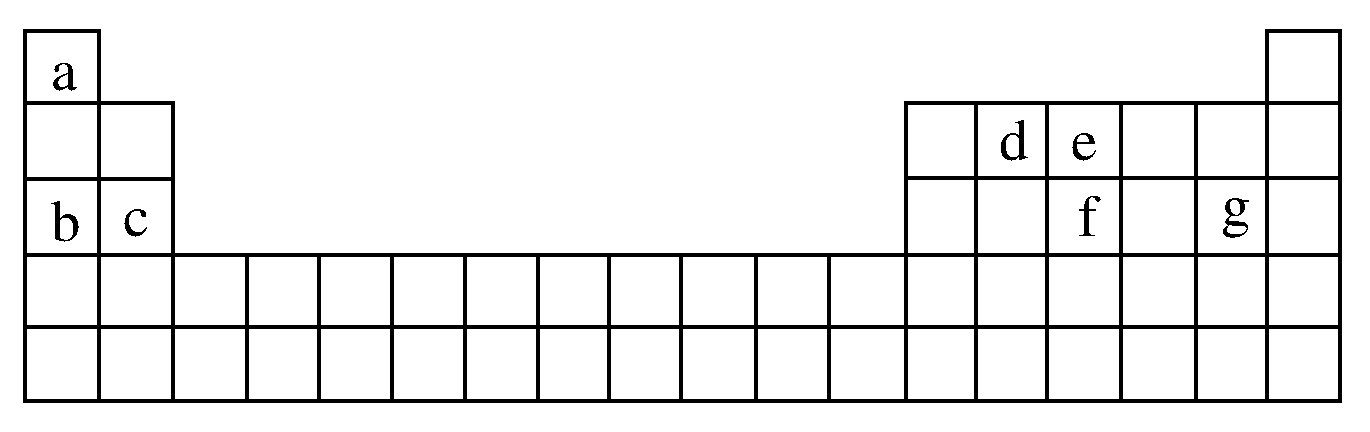
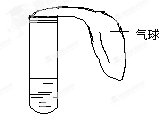
信息 问题 ①短周期元素X、Y、Z、W,原子序数依次增大,最外层电子数均不少于最内层电子数
A.氢 B.碳
C.氧 D.硫②一定条件下,上述四种元素的单质均能与足量的氧气反应,生成的氧化物有两种能溶于稀硫酸,三种能溶于浓NaOH溶液,氧化物的相对分子质量都大于26 (2)这四种元素中有铝元素吗?________ ③向上述四种元素的单质的混合物中,加入足量的盐酸,固体部分溶解,过滤,向滤液中加入过量的烧碱溶液,最终溶液中有白色沉淀 (3)白色沉淀的化学式为________ ④向上述四种元素的单质的混合物中,加入足量的烧碱溶液,固体部分溶解,过滤,向滤液中加入过量的盐酸,最终溶液中有白色沉淀 (4)生成白色沉淀的离子方程式为________ ⑤X与W同主族 (5)X的最高价氧化物的电子式为________