
湖南省醴陵二中、醴陵四中2016-2017学年高二下学期期中联考化学试卷
03月05日
马鞍山市第二中学2016—2017学年度
第二学期期中素质测试
高一年级化学试题
命题人: 林东祥 审题人: 李文方
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Al:27 Cl:35.5 Fe:56 Cu:64 Ag:108
注意:请将选择题答案填涂在机读卡上,非选择题答案填在第Ⅱ卷上。
第 Ⅰ 卷
1.材料与化学密切相关,表中对应关系错误的是( )
| 选项 | 材 料 | 主要化学成分 |
| $来&源:A | 刚玉、金刚石 | 三氧化二铝 |
| B | 大理石、石灰石 | 碳酸钙 |
| C | 普通水泥、普通玻璃 | 硅酸盐 |
| D | 沙子、石英 | 二氧化硅 |
2.下列污染现象主要与SO2有关的是 ( )
A.臭氧空洞B.酸雨C.光化学烟雾 D.温室效应
3. 对于化学方程式SiO2+3CSiC+2CO↑,有关叙述正确的是( )
A.反应中SiO2是氧化剂,C是还原剂
B.硅元素被还原了,碳元素被氧化了
C.在反应中C只作还原剂
D.在反应中氧化剂与还原剂的物质的量之比为1∶2
4.下列有关氯水的叙述,正确的是( )
A. 新制氯水可使无色酚酞试纸先变红,后褪色
B. 新制的氯水只含Cl2和H2O分子
C. 氯水放置数天后,酸性增强
D. 光照氯水有气泡逸出,该气体是Cl2
5.对下列事实的解释错误的是 ( )
A.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
B.浓硝酸在光照下颜色变黄,说明浓硝酸不稳定$来&源:
C.常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应
D.反应CuSO4+H2S=CuS+H2SO4能进行,说明硫化铜既不溶于水,也不溶于稀硫酸
6.现有下列五个转化,其中不可能通过一步反应实现的是( )
①SiO2→Na2SiO3 ②CuSO4→CuCl2 ③SiO2→H2SiO3 ④CuO→Cu(OH)2 ⑤Na2O2→NaOH
A.①②B.③④C.②③④D.②③④⑤
7.可以在实验室安全快速制取氨气的方法是 ( )
A.在浓氨水中加固体NaOH B.混合NH4Cl溶液和NaOH溶液
C.加热分解NH4Cl晶体 D.加热消石灰和NH4NO3的固体混合物
8.某溶液既能溶解Al(OH)3,又能溶解H2SiO3,在该溶液中可以大量共存的离子组是( )
A. K+、Na+、HCO3-、NO3- B. Na+、SO42-、Cl-、ClO-
C. H+、Mg2+、SO42-、NO3- D. Ag+、K+、NO3-、Na+
9.能把Na2SO3、NH4NO3、KCl、(NH4)2SO4四种无色溶液区别开的一种试剂是
(必要时可加热) ( )
A.Ba(OH)2 B.KOH C.NaOH D.AgNO3
10.甲、乙、丙三瓶等体积的新制氯水,浓度均为0.1 mol·L-1。如果在甲瓶中加入少量的CaCO3晶体(m mol),在乙瓶中加入少量CaSO3晶体(m mol),丙瓶不变,片刻后,甲、乙、丙三瓶溶液中HClO的物质的量的浓度大小关系是(溶液体积变化忽略不计)( )
A.甲=乙>丙 B.丙>甲=乙 C. 甲>乙>丙 D.甲>丙>乙
11.10mLNO、CO2的混合气体通过足量的Na2O2后,气体的体积变为6mL(相同状况),则NO和CO2的体积比为 ( )资*源%库
A.1∶1 B.2∶1 C.3∶2 D.1∶2
12.下列说法中正确的是 ( )
A.铵盐都易溶于水 B.铵盐受热分解都能得到氨气资*源%库
C.除去NH4Cl溶液中少量的CaCl2,加过量的NH4HCO3溶液后过滤
D.铵盐与碱液共热都能生成使蓝色石蕊试变红的气体
13.某单质能跟足量浓HNO3反应,若参与反应的单质与硝酸的物质的量之比为1∶4,则该单质在反应中所显示的化合价可能是 ( ) 资*源%库
A.+1 B.+2 C.+3 D.+5
14. 下列溶液可以盛放在玻璃试剂瓶中但不能用磨口玻璃塞的是 ( )
A.稀盐酸溶液B.氢氟酸C.氢氧化钠溶液D.氯化钠溶液
15.下列离子方程式错误的是 ( )$来&源:
A.氨气通入稀硫酸 NH3+H+=NH4+
B.稀烧碱溶液和氯化铵溶液混合 NH4++ OH-=NH3·H2O
C.碳酸氢铵和足量浓烧碱溶液混合加热 NH4++ OH-=NH3↑+H2O
D.Cl2和水反应 Cl2+H2O=H++Cl-+HClO
16.下列关于硫酸的说法正确的是 ( )$来&源:
A.浓硫酸有脱水性,故可用做干燥剂
B.浓硫酸有强酸性,故能与金属活动顺序氢后的金属反应
C.硫酸的酸性比盐酸强,利用复分解反应用硫酸可以制盐酸
D.由于浓硫酸具强氧化性,因此不能干燥硫化氢和碘化氢气体
17.已知某溶液中Cl-、Br-、I-的物质的量之比为2∶3∶4,欲使溶液中Cl-、Br-、I-的物质的量之比变成4∶3∶2,那么要通入Cl2的物质的量是原溶液中I-的物质的量的( )
A. B. C. D.
18.以下集气装置中不正确的是 ( )
 A.CO2的收集 B.NO的收集 C.NH3的收集 D.Cl2的收集
A.CO2的收集 B.NO的收集 C.NH3的收集 D.Cl2的收集
(液体为H2O) (试管口为棉花) (液体为H2O)
19.化学实验中,常将溶液或试剂进行酸化,下列酸化处理的措施中正确的是( )
A.定性检验SO![]() ,将BaCl2溶液用HNO3酸化
,将BaCl2溶液用HNO3酸化
B.为了提高KMnO4溶液的氧化能力,用盐酸将其酸化
C.检验某溶液中是否含Cl–,用HNO3酸化的AgNO3溶液
D.配制FeCl2溶液时通常加少量HNO3酸化
20.将14 g铜银合金与足量的HNO3反应,将产生的气体与1.12 L O2(标准状况下)混合后,通入水中,恰好被全部吸收,则合金中Ag的质量为 ( )
A.3.2 gB.4.8 gC.6.4 gD.10.8 g
21.为了除去混入CO2中的SO2,最好将混合气体通入下列哪种溶液中 ( )
A.饱和烧碱溶液 B.饱和小苏打溶液 C.饱和纯碱溶液 D.浓硫酸
22.某种混合气体可能含有N2、HCl和CO,把混合气体依次通过足量的NaHCO3溶液和灼热的CuO,气体体积都没有变化。经干燥后再通过足量的Na2O2固体,气体体积减少。最后通过灼热的铜网,经充分反应后气体体积又减少,但还有剩余气体。以下对混合气体的判断正确的是 ( )
A.一定没有N2,HCl和CO至少有一种 B.一定没有N2,HCl和CO都有
C.一定有N2,HCl和CO至少有一种 D.一定有N2和HCl,肯定没有CO
第 Ⅱ 卷 非选择题
二.填空题(共52分,每小空2分))
23.(1)除去二氧化硅中少量碳酸钙、检验二氧化硅中是否含碳酸钙都可用______ 试剂。
(2)鉴别CO2和SO2,使品红试液褪色的是________,或者使橙色溶液 褪色的是SO2,反应的离子方程式为 。
(3)氨是重要的化工原料,工业制硝酸有一步反应是氨的催化氧化,该反应方程式为____________ ,实验室制氨气可以用 干燥。
(4)高岭石Al2(Si2O5)(OH)4用氧化物的形式可表示为____________ 。
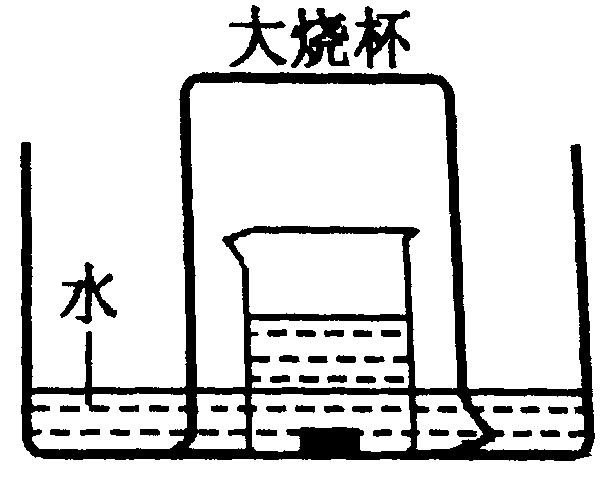 24.在如下图所示的实验装置中,盛有足量水的水槽里放两个烧杯,小烧杯里放有少量铜片和过量浓硝酸,小烧杯外面倒扣一大烧杯,请回答下列问题:
24.在如下图所示的实验装置中,盛有足量水的水槽里放两个烧杯,小烧杯里放有少量铜片和过量浓硝酸,小烧杯外面倒扣一大烧杯,请回答下列问题:
(1)实验过程中,观察到的主要现象是:
①___________________________________ ;
②___________________________________ ;
③___________________________________ ;
④___________________________________ 。
(2)用该装置做铜与浓硝酸反应的实验,最突出的优点是:_______________
___________________________________。
(3)若要验证最终得到的气体生成物,最简便的方法是:_________________
________________________。
25.下图是一个制取氯气并以氯气为原料进行特定反应的装置,请回答下列问题。
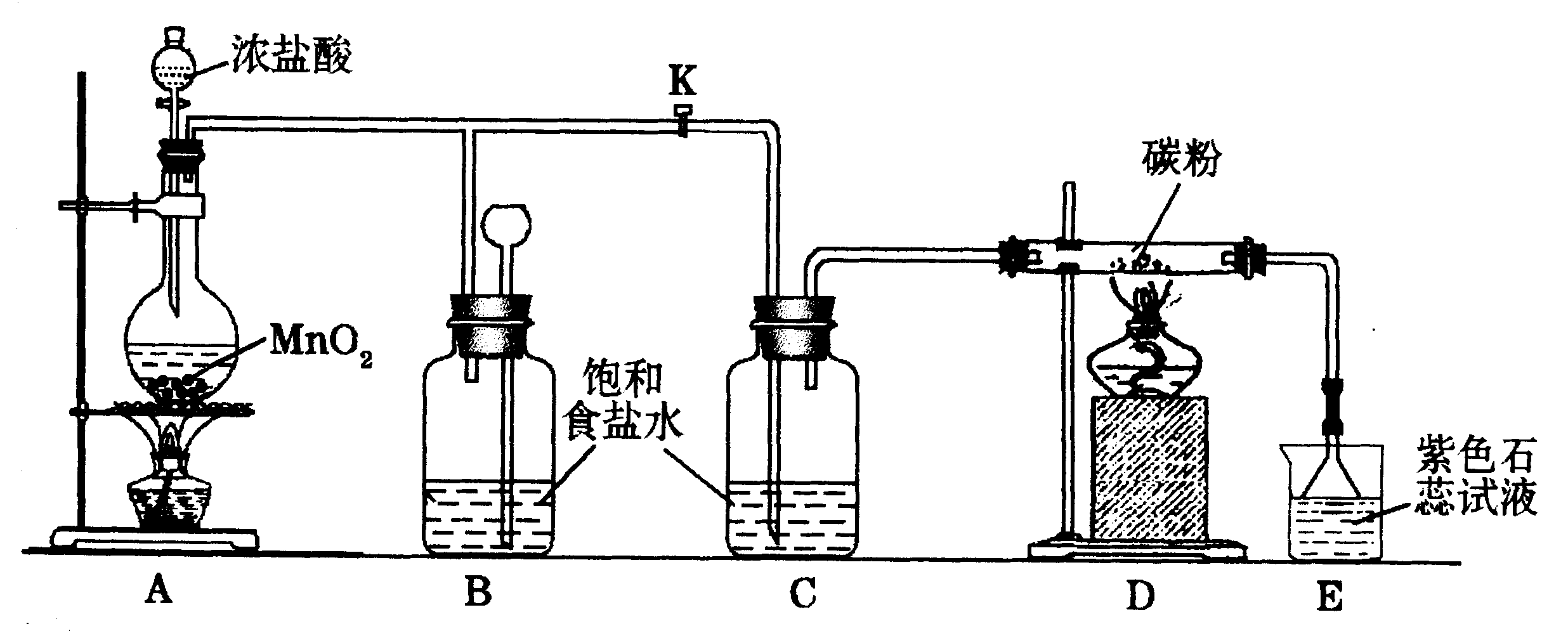
(1)A是氯气发生装置,其中发生反应的离子方程式为________________ 。
(2)实验开始时,先点燃装置A处的酒精灯,打开弹簧夹K,让Cl2充满整个装置,再点装置D处的酒精灯,Cl2通过C瓶后再进入D(D装置的硬质玻璃管内盛有碳粉)发生氧化还原反应,其产物为CO2和HCl。D中发生反应的化学方程式为______________________________,装置C的作用是______________________。
(3)实验过程中,E处产生的现象为___________________________。
(4)D处反应完毕后,关闭弹簧夹K,移去酒精灯,由于余热的作用,A处仍有Cl2产生,此时B中出现的现象是__________________________,装置B的作用是 ___________________________。
(5)若实验中使12 mol · L – 1的浓盐酸10 mL与足量的MnO2反应,则生成的Cl2的物质的量总是小于0.03 mol,其原因是__________________________。
(6)若要吸收从硬质玻璃管中导出的气体,E中应盛放__________溶液,其中有毒气体与之反应的离子方程式是_________________________。
26.将5.5 g铁铝混合物粉末加入过量的1L1mol/L HNO3溶液中,充分反应后,得3.36L(标准状况)NO气体,求
⑴假设反应前后溶液的体积不变,剩余硝酸的浓度为___________mol/L
⑵混合物中铝的质量分数为_________%,
⑶向反应后的溶液中加入___________ mL 1mol/L NaOH溶液时,生成的沉淀量最大,
再加________ mL 1mol/L NaOH溶液才能使沉淀的量不再发生变化。
三.计算题(4分)
27.在标准状况下,1体积水溶解700体积氨气,所得溶液的密度为0.9g/mL,则氨水的质量分数是多少?该氨水的物质的量浓度是多少?(保留三位有效数值)