
湖南省醴陵二中、醴陵四中2016-2017学年高二下学期期中联考化学试卷
03月05日
广西陆川县中学2017年春季期高一3月月考试卷
化学试题
(命题人:李虎 审题人:李林)
第I部分 选择题(共48分)
一、选择题(本题包括16小题,每题3分,共48分)
1.下列关于3 2He的说法正确的是( )
A.3 2He原子核内含有2个中子 B.3 2He原子核内含有3个质子
C.3 2He原子核外有3个电子 D.3 2He的质量数为3
2.下列有关化学用语表示正确的是( )
A.H2O的结构式:H===O===H B.F-的结构示意图:![]()
C.中子数为20的氯原子:Cl D.NH3的电子式:![]()
3、某工厂运输NH3的管道出现小孔导致NH3泄漏,技术人员常常用一种液体进行检查,你觉得该液体最有可能是
A.浓盐酸 B.烧碱溶液C.浓硫酸 D.碳酸钠溶液
4.下列有关说法正确的是( )
A.次氯酸钙溶液中通入少量SO2气体的离子方程式:
Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO
B. CaCl2既含有离子键,又含有非极性键。
C.SO2使KMnO4酸性溶液和滴有酚酞的NaOH溶液褪色的原理相同。
D.将铁屑溶于过量盐酸后,再加入硝酸锌,会有三价铁生成。
5.铍元素性质与铝元素性质相似,下列方法能证明氯化铍由共价键构成的是( )
A.溶于水加硝酸银溶液,观察是否有白色沉淀生成
B.溶于水做导电实验,观察是否导电C.熔融状态,做导电实验,观察是否导电 D.测定氯化铍熔点
6. 2012年6月16日,“神舟九号”飞船发射成功,14时后完成了与此前发射的“天宫一号”的成功交会对接,其中新材料铝锂合金为“太空之吻”提供了保障。下列对铝元素和锂元素的认识正确的是 ( )资*源%库
A.锂是碱金属元素,可以保存在煤油中
B.铝离子和锂离子的核外电子排布相同
C.Li+的半径大于H-的半径
D.通常情况下,短周期中能与强碱反应产生H2的金属元素是铝,在周期表中位于第ⅢA族
7.若把元素周期表原先的主、副族号取消,由左到右按原顺序编为18列。如碱金属为第1列,稀有气体为第18列,按这个规定,下列说法中不正确的是 ( )
A.计算机芯片的组成元素Si位于第14列B.第10列元素全部是金属元素
C.第18列元素单质全部是气体 D.只有第2列元素的原子最外层有2个电子
8.下列说法正确的是( )
A.形成离子键的阴阳离子间只存在静电吸引力
B.HF、HCl、HBr、HI的热稳定性和还原性从左到右依次减弱
C.第三周期非金属元素含氧酸的酸性从左到右依次增强
D.元素周期律是元素原子核外电子排布周期性变化的结果
9.下列关于原子结构、元素性质的说法正确的是( )
A.非金属元素组成的化合物中只含共价键
B.ⅠA族金属元素是同周期中金属性最强的元素
C.同种元素的原子均有相同的质子数和中子数
D.ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强
10.如图所示,a、b、c、d、e为元素周期表中前4周期的一部分元素,下列有关叙述正确的是( )
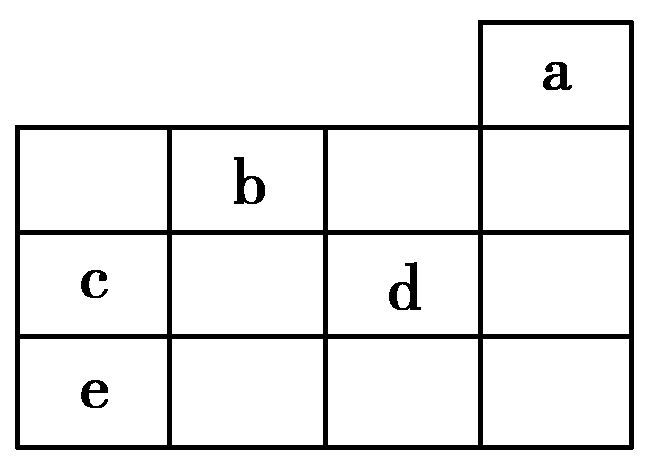
A.元素b位于第ⅥA族,有+6、-2价两种常见化合价
B.五种元素中,元素e的性质最稳定
C.元素c和d的最高价氧化物对应的水化物的酸性:c>d
D.元素c和e的气态氢化物的稳定性:c>e
11.短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,Y原子的最外层只有2个电子,Z单质可制成半导体材料,W与X属于同一主族。下列叙述正确的是(双选)( )
A.元素X的简单气态氢化物的热稳定性比W的强
B.元素W的最高价氧化物对应水化物的酸性比Z的弱
C.化合物YX、ZX2、WX3中化学键的类型相同
D.原子半径的大小顺序:rY>rZ>rW>rX
12.在一定条件下,RO与R-可发生反应:RO+5R-+6H+===3R2+3H2O,下列关于R元素的叙述中,正确的是( )
A.元素R位于周期表中第ⅤA族B.RO中的R只能被还原
C.R2在常温常压下一定是气体D.若1 mol RO参与该反应,则转移的电子的物质的量为5 mol
13.下列不能说明氯元素的非资*源%库金属性比硫元素强的事实是( )
①HCl比H2S稳定 ②HClO氧化性比H2SO4强 ③HClO4酸性比H2SO4强 ④Cl2能与H2S反应生成S ⑤Cl原子最外层有7个电子,S原子最外层有6个电子 ⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS
A.②⑤ B.①②C.①②④D.①③⑤
14.短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,乙位于第ⅤA族,甲与丙同主族,丁原子最外层电子数与电子层数相等,则 ( )
A.原子半径:丁>丙>乙 B.单质的还原性:丁>丙
C.甲、乙、丙的氧化物均为共价化合物
D.乙、丙、丁的最高价氧化物对应的水化物能相互反应
15.短周期元素A、B、C、D的原子序数依次递增,它们的原子序数之和为32,且原子最外层电子数之和为10;A、C原子的最外层电子数之和等于B原子的次外层电子数;A与C,B与D均为同主族元素。下列叙述正确的是 ( )A.四种元素的原子半径:A>B>C>D
B.最高价氧化物对应的水化物的酸性:B>D
C.C元素处于元素周期表中第三周期第ⅡA族
D.B、D的最高价氧化物中,B、D与氧原子之间均为单键
16、已知锶与钙同主族,下列对锶及其化合物的叙述正确的是
A.碳酸锶难溶于水 B.氢氧化锶的碱性比氢氧化钙弱
C.单质锶跟冷水不反应 D.锶是第四周期元素
第Ⅱ卷(非选择题,共52分)
二、非选择题(本题包括4小题,共52分)
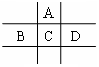 17.(14分)有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如右图所示。E的单质既可以与盐酸反应,又可以与NaOH溶液反应放出H2,且E的阳离子与A的阴离子核外电子层结构完全相同。
17.(14分)有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如右图所示。E的单质既可以与盐酸反应,又可以与NaOH溶液反应放出H2,且E的阳离子与A的阴离子核外电子层结构完全相同。
回答下列问题:
(1)A与E形成的化合物的化学式是。
(2)B的最高价氧化物化学式为,C的元素名称为,
D的单质与水反应的方程式为。
(3)向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量,观察到的现象是
,有关反应的离子方程式为
。
18.(12分)科学家发现:具有2、8、20、28、50、82、114、126、184等数目的质子或中子的原子核具有特别的稳定性,并将这些数称为“幻数”,而具有双幻数的He、Ni、50Sn、82Pb等尤为稳定。根据此信息回答下列问题:
19.(12分)有一瓶澄清的溶液,其中可能含有NH4+、K+、Na+、Mg2+、Ba2+、
Fe3+、SO42―、CO32―、Cl―和I―。你取该溶液进行了以下实验:
(1)用pH试纸检验,表明溶液呈强酸性;
(2)取部分溶液,加入CCl4及数滴氯水,经振荡后CCl4层呈紫红色;
(3)另取部分溶液,加入稀NaOH 溶液使其变为碱性,溶液中无沉淀生成;
(4)取部分上述碱性溶液,加Na2CO3溶液有白色沉淀生成;
(5)将(3)得到的碱性溶液加热,有气体放出,该气体能使润湿的红色石蕊试纸变蓝;
根据上述实验事实,你可知道该溶液中肯定含有的离子是①;肯定不存在的离子②;还不能确定是否存在的离子是③,若要确定其中的阳离子可采用的方法④;写出第(2)步骤中的离子方程式是⑤;
第(5)步骤中得到的气体化学键类型是⑥;
20.(11分)某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成碳族元素中C与Si的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律。
据图1回答:
(1)甲同学设计实验的依据是____________________________________。
(2)写出选用的化学试剂:B____________,其作用为___________。
(3)C中反应的离子方程式为____________________________________________。
据图2回答:
乙同学的实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡,静置后CCl4层溶液变为紫红色。
(4)写出B处反应的离子方程式 ___________________________________________。
(5)A中验证氯气的氧化性强于碘的实验现象是_____________________。
(6)过程Ⅲ实验的目的是_________________________。
(7)综合甲、乙两同学的实验得出的结论是:同主族元素从上到下元素的非金属逐渐减弱,
其原因是___________________________________________(试从原子结构角度解释)。
化学答案
1.D 2.B 3.A4.D 5.C6. D7.D8.D9.B10.D11.AD12.D13.A14.D15.B 16.A
17.(14分)
(1)Al2O3(2分)
(2)P2O5(2分),硫(2分), Cl2+H2O=HCl+HClO(2分)
(3)先有白色胶状沉淀产生并逐渐增多,随NaOH加入又逐渐溶解最终澄清 (2分)
Al3++3OH-=Al(OH)3↓ (2分)
Al(OH)3+OH-=AlO2-+2H2O (2分)
18.(1)He:![]()
(2)8O (3)七 ⅣA >
19.(12分)NH4+、Ba2+、I-;Mg2+、Fe3+、 SO42-、CO32-;
K+、Na+、Cl-;④焰色反应.
⑤2I-+Cl2=2Cl-+I2⑥极性共价键
20.(11分)
(1)较强酸制较弱酸(1分)
(2)饱和NaHCO3溶液(1分)吸收挥发出来的HCl气体(1分)
(3)CO2+SiO32-+H2O=H2SiO3+CO32_或2CO2+SiO32-+2H2O=H2SiO3+2HCO3_(2分)
(4)Cl2+2Br-=Br2+2Cl- (2分)
(5)湿润淀粉KI试纸变蓝(1分)
(6)确认装置C的黄色溶液无Cl2,否则Cl2也能氧化KI溶液,对溴置换碘的实验造成干扰(合理即可)(2分)
(7)最外层电子数相同,电子层数增加,原子半径依次增大,对最外层电子引力减小(合理即可)(1分)