
湖南省醴陵二中、醴陵四中2016-2017学年高二下学期期中联考化学试卷
03月05日
重庆市巫山高级中学校高2017级高一下期期末质量监测
化学试题卷
满分:100分 考试时间:90分钟
可能用到的相对原子质量:C—12 H—1 Ag-108
一、单项选择题(每题3分,共48分,请将选择的答案在答题卷相应题号的位置涂黑)
1.下列有关能源和能量转换的叙述正确的是( )
A.推广使用太阳能、风能、海洋能、氢能,有利于缓解温室效应。
B.乙醇和汽油都是可再生能源,应大力推广“乙醇汽油”。
C.普通锌锰干电池不含环境污染物,用完后可以随意扔掉,使用方便。
D.燃料电池是利用燃料燃烧,将化学能转化为热能,然后再转化为电能的化学电源。
2.下列叙述中正确的是( )
A.在稀溶液中,1 mol酸和1 mol碱完全反应所放出的热量,叫做中和热。
B.在101 kPa时,1 mol物质燃烧时所放出的热量叫做该物质的燃烧热。
C.热化学方程式中,各物质前的化学计量数不表示分子个数。
D.如果反应物所具有的总能量小于生成物所具有的总能量,则发生的反应是放热反应。
3.根据热化学方程式:S(l)+O2(g)===SO2(g) ΔH =-293.23 kJ·mol-1,分析下列说法中正确的是( )
A.1mol固体S单质燃烧放出的热量大于293.23 kJ 。
B.1mol气体S单质燃烧放出的热量小于293.23 kJ 。
C.1 mol SO2(g)的键能的总和大于1 mol S(l)和1 mol O2(g)的键能之和。
D.1 mol SO2(g)的键能的总和小于1 mol S(l)和1 mol O2(g)的键能之和。
4.下列有关化学用语的表示方法中正确的是( )
A.氯元素的原子结构示意图:![]() B.N2的结构式:N≡N
B.N2的结构式:N≡N
C.原子核内有8个中子的氧原子:![]() D.二氧化碳的电子式:
D.二氧化碳的电子式:![]()
5.已知aAn+,bB(n+1)+,cCn-,dD(n+1)-是具有相同的电子层结构的短周期元素形成的简单离子,下列叙述正确的是( )
A.最外层电子数:C>D>A>B B.原子序数:b>a>c>d
C.离子半径:Cn->D(n+1)->An+>B(n+1)+D.单质还原性:A>B>C>D
6.下列有关化学键和化合物的说法不正确的是( )
A.离子键就是阴阳离子间强烈的静电作用。
B.H和Cl形成的分子中存在的是极性共价键。
C.氯化铵中没有金属元素,所以不是离子化合物。
D.11号与9号元素能够形成离子化合物,该化合物中存在离子键。
 7.某分子的球棍模型如下图所示。已知该分子中所有原子的最外层均达到8电子稳定结构,原子间以单键相连。下列有关说法中错误的是( )
7.某分子的球棍模型如下图所示。已知该分子中所有原子的最外层均达到8电子稳定结构,原子间以单键相连。下列有关说法中错误的是( )
A.X原子可能为第ⅤA族元素
B.Y原子为第ⅠA族元素
C.该分子中既含有极性共价键又含有非极性共价键
D.从圆球的大小分析,该分子可能为N2F4
8.有A、B、C、D四种金属。将A与B用导线连接起来,浸入电解质溶液中,B不易腐蚀。将A、D分别投入等浓度盐酸中,D比A反应剧烈。将铜浸入B的盐溶液里,无明显变化。如果把铜浸入C的盐溶液里,有金属C析出。据此判断它们的活动性由强到弱的顺序是( )
A.D>C>A>B B.D>A>B>C C.D>B>A>C D.B>A>D>C
9.下列有关金属腐蚀及其防护的叙述 中不正确的是( )
A.金属的电化学腐蚀比化学腐蚀更普遍 。
B.用牺牲锌块的方法来保护船身。
C.用铜质铆钉铆接铁板,铁板不易被腐蚀 。
 D.浸泡在水中钢闸门,水面附近区域的腐蚀程度大于长期在水下的部分。
D.浸泡在水中钢闸门,水面附近区域的腐蚀程度大于长期在水下的部分。
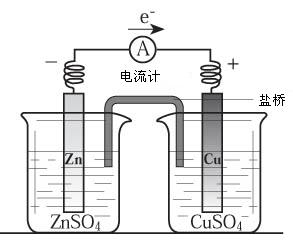
10.有关右图所示原电池(盐桥中装有含琼脂的KCl饱和溶液)的叙述,正确的是( )
A.铜是阳极,铜片上有气泡产生。
B.铜离子在铜片表面被还原。
C.电流从锌片经导线流向铜片。
D.反应中,盐桥中的K+会移向ZnSO4溶液。
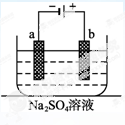 11.右图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和 b 附近分别滴加一滴石蕊溶液。下列实验现象中错误的是( )
11.右图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和 b 附近分别滴加一滴石蕊溶液。下列实验现象中错误的是( )
A.a电极附近呈红色,b电极附近呈蓝色。
B.a电极附近呈蓝色,b电极附近呈红色。
C.逸出气体的体积,a电极的大于b电极的。
D.a、b两电极都逸出无色无味气体。
12.关于铜电极的叙述中不正确的是( )
A.铜锌原电池中铜是正极 B.在镀件上镀铜时可用金属铜作阳极
C.用电解法精炼铜时粗铜做阳极 D.在电解饱和食盐水的装置可用铜做阳极,且电极产物是Cl2
13.下列电极反应正确的是( )
A.用惰性电极电解饱和食盐水阳极反应式:2Cl-+ 2H+=H2↑+ Cl2↑
B.碱性氢氧燃料电池的负极反应式:O2+2H2O+4e-=4OH-
 C.钢铁发生电化学腐蚀的正极反应式:Fe-2e-=Fe2+
C.钢铁发生电化学腐蚀的正极反应式:Fe-2e-=Fe2+
D.铅蓄电池放电时的负极反应式为:Pb+SO42--2e-=PbSO4
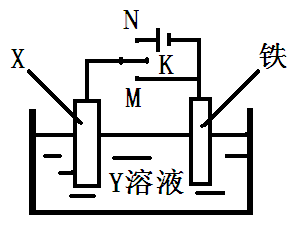
14.利用如图装置,完成很多电化学实验。下列有关此装置的叙述中,正确的是( )
A.若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓锌的腐蚀,这种方法称为牺牲阴极保护法。
B.若X为碳棒,Y为NaCl溶液,开关K置于N处,可加快铁的腐蚀。
C.若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动。
D.若X为铜棒,Y为硫酸铜溶液,开关K置于N处,可用于铁表面镀铜,溶液中铜离子浓度将减小。
15.甲、乙、丙为二、三周期的元素,原子序数依次增大,甲和乙同周期,甲和丙同主族,甲、乙原子序数之和与丙的原子序数相等,甲、丙原子的最外层电子数之和与乙原子的电子总数相等。下列说法不正确的是( )
A.乙是地壳中含量最多的元素 B.丙的氢化物比甲的氢化物热稳定性强
C.乙与丙形成的化合物可制作光导纤维 D.甲、乙两种元素形成的化合物中一定含有共价键
16.有五个系列同族元素的物质,101.3 kPa时测定它们的沸点(℃)如下表所示:
| ① | He -268.8 |
| Ar -185.8 | Kr -151.7 |
| ② | F2 -187.0 | Cl2 -33.6 | (b) 58.7 | I2 184.0 |
| ③ | (c) 19.4 | HCl -84.0 | HBr -67.0 | HI -35.3 |
| ④ | H2O 100.0 | H2S -60.0 | (d) -42.0 | H2Te -1.8 |
对应表中内容,下列叙述中正确的是( )
A.系列①的(a)物质中没有离子键,应有共价键和分子间作用力。
B.系列③中(c)物质的沸点比HCl高是因为(c)中的共价键更牢固。
C.系列②中(b)物质的元素的原子序数应为35,且该物质常温下为液态。
D.系列④中H2O沸点变化出现反常,是因为分子内有氢键的影响。
二、填空题(请在答题卷相应题号上作答,4个小题共52分)
17.(1—6项每空1分,7、8项每空2分,共10分)
下表为元素周期表的一部分,参照元素①~⑫在表中的位置,请回答下列问题。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | ① | |||||||
| 二 | ② | ③ | ④ | ⑤ | ||||
| 三 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ⑪ | ⑫ |
(1).画出⑦的离子结构示意图________________________。
(2).⑤、⑥、⑪的原子中半径最大的是______________(写编号)。
(3).⑥和⑧的最高价的氧化物的水化物中碱性弱些的是________。(填化学式)
(4).④、⑩的气态氢化物中的稳定性强些的是_______。(填化学式)
(5).写出②和⑫组成的各原子最外层电子都满足8电子的物质的化学式_____________。
(6).写出一种由①④组成且含有非极性键的物质的电子式_____________。
(7).③的最高价含氧酸的稀溶液与铜粉反应的离子方程式_______________________。
(8).利用较强酸能制出较弱酸的原理,写出一个能证明②和⑨非金属性强弱的一个常见反应的化学方程式_____________________________________________________。
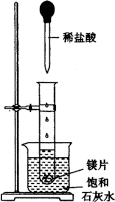 18.(每项2分,共16分)
18.(每项2分,共16分)
Ⅰ).如右图所示,把试管放入盛有25℃的饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中。试回答下列回答:
(1)实验中能观察到的现象是____________________。(选填代号)
A.试管中镁片逐渐溶解 B.试管中产生无色气泡
C.烧杯外壁变冷 D.烧杯底部析出少量白色固体
(2)由实验推知,MgCl2溶液和H2的总能量________(填“大于”“小于”“等于”)镁片和盐酸的总能量。
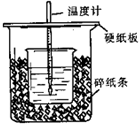 Ⅱ).用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
Ⅱ).用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 ,除此之外还有一处错误的是 。
(2)大烧杯上如不盖硬纸板,求得的中和热数值(绝对值) (填“偏大、偏小、无影响”)。
Ⅲ). (1)煤燃烧的反应热可通过以下两个途径来利用:a.利用煤在充足的空气中直接燃烧产生的反应热;b.先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧。这两个过程的热化学方程式为:
a.C(s)+O2(g)===CO2(g) ΔH=E1①
b.C(s)+H2O(g)===CO(g)+H2(g) ΔH=E2②
H2(g)+O2(g)===H2O(g) ΔH=E3③
CO(g)+O2(g)===CO2(g) ΔH=E4④
请表达E1、E2、E3、E4之间的关系为E2=_________________。
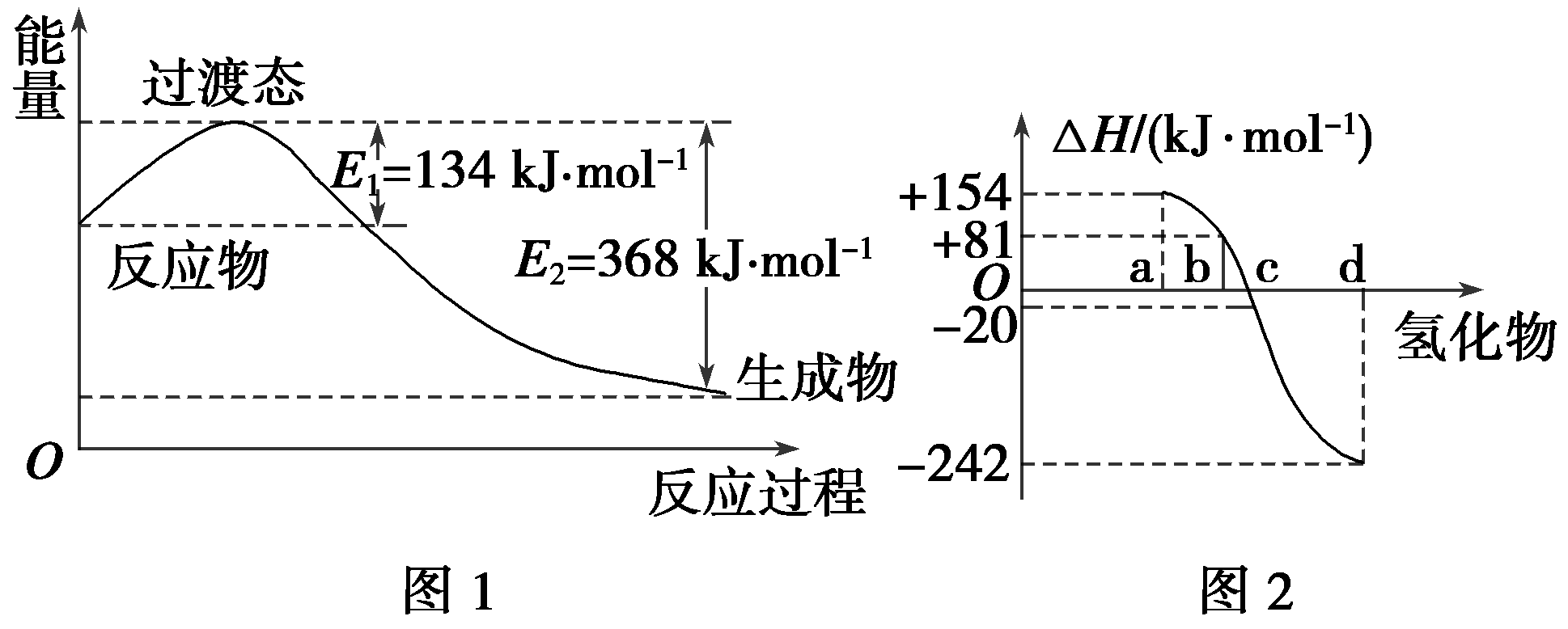 (2)如右图所示是1摩尔NO2和1摩尔CO完全反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: 。
(2)如右图所示是1摩尔NO2和1摩尔CO完全反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: 。
(3)化学反应的焓变与反应物和生成物的键能有关。已知某些化学键的键能如下表所示:
| 共价键 | H—H | Cl—Cl | H—Cl |
| 键能/(kJ·mol-1) | 436 | 247 | 434 |
则反应:H2(g)+Cl2(g)===2HCl(g)的焓变ΔH = 。
19.(每空2分,共14分)
有电化学装置如图连接,请回答下列问题:
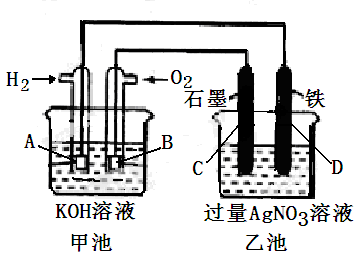
(1)图中甲、乙两池的名称:甲池是 装置;乙池是 装置。
(2)请回答下列电极的名称:通入H2的电极名称是 ,C(石墨)电极的名称是 。
(3)写出电极反应式:通入O2的电极的电极反应式是 。
(4)乙池中反应的化学方程式为 。
(5)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗H2mL(标准状况下)。
20.(每空2分,共12分)
某短周期非金属元素固体单质A,呈淡黄色。它与另一常见的短周期金属单质 B在加热条件下反应生成化合物 C,C 与水反应生成白色沉淀 D 和一种臭鸡蛋味的气态氢化物 E,D 是某元素的最高价氧化物的水化物,既能溶于强酸,又能溶于强碱。E 在足量空气中燃烧时,有刺激性气味的气体 G生成,G 在大气中能导致酸雨的形成。E 被足量氢氧化钠溶液吸收得到无色溶液 F。溶液 F 在空气中长期放置发生反应,生成物之一为 H。H 与过氧化钠的结构和化学性质相似。请回答下列问题:
(1). 组成单质 A的元素在周期表中的位置 。
(2). 写出化学式: 沉淀D , 臭鸡蛋味气体 E 。
(3).G 与氯水反应的氧化产物为__________。(填化学式)
(4).溶液 F 在空气中长期放置生成 H 的化学方程式为:________________________。
(5).H 的溶液与稀硫酸反应产生的现象为_______________________。
重庆市巫山高级中学校高2017级高一下期期末质量监测
化学试题参考答案
一、单项选择题(每题3分,共48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | A | C | C | B | B | C | B | B |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | C | B | A | D | D | C | B | C |
二、填空题(4个小题共52分)
17.(1—6项每空1分,7、8项每空2分,共10分)
(1).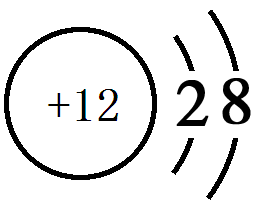
(2).⑥
(3).Al(OH)3
(4).H2O
(5).CCl4
(6).![]()
(7).3Cu + 8H++2NO3- = 3Cu2+ +2NO↑+ 4H2O
(8).Na2SiO3 + H2O +CO2= H2SiO3↓+Na2CO3
18.(每项2分,共16分)
Ⅰ).
(1)A B D(选填代号)
(2)小于
Ⅱ).
(1)环形玻璃搅拌棒 ,小烧杯口和大烧杯口没有平齐(其它合适答案给分)
(2)偏小
Ⅲ).
(3ΔH =-185 kJ·mol-1
19.(每空2分,共14分)
(1)原电池(或化学能转变为电能) 电解池(或电能转变为化学能)
(2)负极 阳极
(3)![]()
(4)![]()
(5)560
20.(每空2分,共12分)
(1).第三周期,第VIA族
(2).Al(OH)3, H2S
(3).H2SO4
(4).4Na2S+2H2O +O2=2Na2S2+4NaOH
(5).溶液中产生淡黄色沉淀,同时有臭鸡蛋(恶臭)味气体放出