
湖南省醴陵二中、醴陵四中2016-2017学年高二下学期期中联考化学试卷
03月05日
高二学年十月月考
化学试题
一、选择题:(本题包括10小题,每小题4分,共80分。每小题只有一个选项符合题意。)
1.在2A+B![]() 3C+4D反应中,表示该反应速率最快的是
3C+4D反应中,表示该反应速率最快的是
A.υ(A)= 0.5 mol/(L·s) B.υ(B)= 0.3 mol/(L·s)
C.υ(C)= 0.8 mol/(L·s) D.υ(D)= 1 mol/(L·s)
2.下列说法正确的是
A.增大反应物浓度,可增大活化分子的百分数,从而使有效碰撞次数增多
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
C.升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数
D.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率
3.过程的自发性的作用是
A.判断过程的方向 B.确定过程是否一定会发生
C.判断过程发生的速率 D.判断过程的热效应
4.在2升的密闭容器中,发生以下反应:2A(g)+ B(g) ![]() 2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是
2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是
5.一定条件下反应2AB(g)![]() A2(g)+B2(g)达到平衡状态的标志是
A2(g)+B2(g)达到平衡状态的标志是
A.单位时间内生成nmolA2,同时消耗2n molAB
B.容器内,3种气体AB、A2、B2共存
C.AB的消耗速率等于A2的消耗速率
D.容器中各组分的体积分数不随时间变化
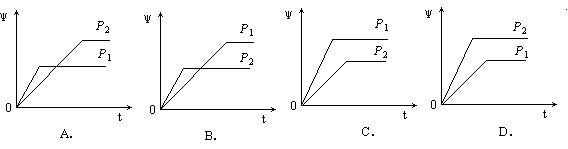
6.在一定温度不同压强(P1<P2)下,可逆反应2X(g)![]() 2Y(g) + Z(g)中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系有以下图示,正确的是
2Y(g) + Z(g)中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系有以下图示,正确的是
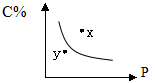 7.对于mA(s)+nB(g)
7.对于mA(s)+nB(g)![]() pC(g)的可逆反应,在一定温度下C的百分含量与压强的关系如图所示,则下列判断正确的是
pC(g)的可逆反应,在一定温度下C的百分含量与压强的关系如图所示,则下列判断正确的是
A.m+n<p B.n>p
C.x点的状态是v正>v逆D.y点的状态是v正>v逆
8.对可逆反应4NH3(g)+ 5O2(g)![]() 4NO(g)+ 6H2O(g),下列叙述正确的是
4NO(g)+ 6H2O(g),下列叙述正确的是
A.达到化学平衡时,4υ正(O2)= 5υ正(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2υ正(NH3)= 3υ正(H2O)
9.已知反应A2(g)+2B2(g)![]() 2AB2(g)△H<0,下列说法正确的
2AB2(g)△H<0,下列说法正确的
A.升高温度,正向反应速率增加,逆向反应速率减小
B.升高温度有利于反应速率增加,从而缩短达到平衡的时间
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
 10.常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,现进行下列两个实验:(N2O4
10.常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,现进行下列两个实验:(N2O4![]() 2NO2△H> 0)
2NO2△H> 0)
(a)将两容器置于沸水中加热
(b)在活塞上都加2 kg的砝码
在以上两情况下,甲和乙容器的体积大小的比较,正确的是
A.(a)甲>乙,(b)甲>乙 B.(a)甲>乙,(b)甲=乙
C.(a)甲<乙,(b)甲>乙 D.(a)甲>乙,(b)甲<乙
 11.密闭容器中,用等物质的量A和B发生如下反应:A(g)+2B(g)
11.密闭容器中,用等物质的量A和B发生如下反应:A(g)+2B(g)![]() 2C(g),反应达到平衡时,若混合气体中A和B的物质的量之和与C的物质的量相等,则这时A的转化率为( )
2C(g),反应达到平衡时,若混合气体中A和B的物质的量之和与C的物质的量相等,则这时A的转化率为( )
A.40% B.50% C.60% D.70%
12.右图曲线a表示放热反应X(g) + Y(g) ![]() Z(g) + M(g) + N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是
Z(g) + M(g) + N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是
A.升高温度 B.加大X的投入量
C.加催化剂 D.增大体积
13.已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ。且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H-O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为
A.920 kJ B.557 kJ
C.436 kJ D.188 kJ
14.在密闭容器中进行如下反应:X2(g)+Y2(g)![]() 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
A. Z为0.3mol/L B. Y2为0.4mol/L
C. X2为0.2mol/L D. Z为0.4mol/L
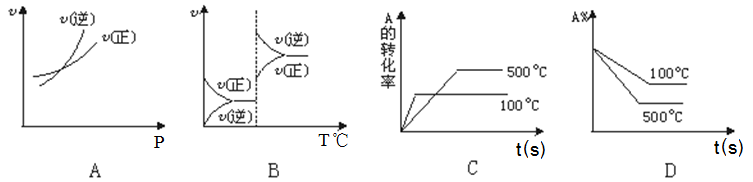
15.对于可逆反应A(g)+2B(g)![]() 2C(g)(正反应吸热),下列图象中正确的是 P T ℃ t s ( )
2C(g)(正反应吸热),下列图象中正确的是 P T ℃ t s ( )
16.在恒温时,一固定容积的容器内发生如下反应:2NO2(g)![]() N2O4(g) 达到平衡时,再向容器
N2O4(g) 达到平衡时,再向容器
内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比,NO2的体积分数
A.不变 B.增大 C.减小 D.无法判断
17.反应4A(g)+5B(g)![]() 4C(g)+6D(g) △H<0,在一定温度下达到化学平衡状态时,下列说法正确的是
4C(g)+6D(g) △H<0,在一定温度下达到化学平衡状态时,下列说法正确的是
A.2 v(C)正=3v(D)逆
B. 若升高温度最终能生成更多的C和D
C. 单位时间里有4n mol A消耗,同时有5n mol B生成
D. 容器里A、B、C、D的浓度比一定是4:5:4:6
18.在密闭容器中发生下列反应aA(g)![]() cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
A.A的转化率增大 B.平衡向正反应方向移动
C.D的体积分数变大 D.a < c+d
19.把6molA和5molB两气体通入容积为4L的密闭容器中,一定条件下反应:
3A(g)+B(g)![]() 2C(g)+x D(g)△H> 0,5min达平衡,此时生成2molC,测得D的
2C(g)+x D(g)△H> 0,5min达平衡,此时生成2molC,测得D的
平均反应速率为0.1mol·(L·min)-1。下列说法中正确的是( )
A.降低平衡体系的温度,逆反应速率减小,正反应速率增大,平衡正向移动
B.恒温下达到平衡的标志是C和D的生成速率相等
C.A的平均反应速率为0.15mol·(L·min)-1
D.B的转化率为25%
20. 某温度下,在固定容积的容器中,可逆反应A(g)+3B(g) ![]() 2C(g)达到平衡,此时测得n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以n(A)∶n(B)∶n(C)=2∶2∶1的比例向该容器中再充入A、B和C,下列叙述正确的是
2C(g)达到平衡,此时测得n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以n(A)∶n(B)∶n(C)=2∶2∶1的比例向该容器中再充入A、B和C,下列叙述正确的是
C. 平衡向逆反应方向移动 D. 物质C的质量分数增大
 二、填空题:(共20分)
二、填空题:(共20分)
21.用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如右图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)。
(4)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 (填“偏大”、“偏小”、“无影响”)。
 21.(1)在恒温、恒容容器中发生反应:2SO2 + O2
21.(1)在恒温、恒容容器中发生反应:2SO2 + O2![]() 2SO3 , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么用O2浓度变化来表示的反应速率为 。如果开始时SO2浓度为4mol/L,O2浓度为2mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为 ,达平衡时与反应前压强之比为 。
2SO3 , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么用O2浓度变化来表示的反应速率为 。如果开始时SO2浓度为4mol/L,O2浓度为2mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为 ,达平衡时与反应前压强之比为 。
(2)右图表示在密闭容器中反应:2SO2+O2![]() 2SO3△H<0达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,a时刻改变条件后达到平衡,新平衡的平衡常数比a时刻前平衡常数(填“增大”、“减小”或“不变”);b c过程中改变的条件可能是; 若增大压强时,反应速率变化情况画在c~d处.
2SO3△H<0达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,a时刻改变条件后达到平衡,新平衡的平衡常数比a时刻前平衡常数(填“增大”、“减小”或“不变”);b c过程中改变的条件可能是; 若增大压强时,反应速率变化情况画在c~d处.
答案
第一部分 选择题(共80分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | B | C | A | B | D | B | D | A | B | D |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | A | C | C | A | D | C | C | D | C | D |
第二部分 非选择题(共20分)
二、
21.环形玻璃搅拌棒 保温、隔热减少实验过程中热量损失 偏小 偏小
22.
(1)1mol/(L·min); 2mol/L 5:6
(2)减小;减小 SO3浓度;