
湖南省醴陵二中、醴陵四中2016-2017学年高二下学期期中联考化学试卷
03月05日
黄骅中学2016-2017年度高中二年级第一学期期中考试
化学试卷
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷两部分。第Ⅰ卷1至 4页,第Ⅱ卷5 至 8页。共100分。考试时间90分钟。
第Ⅰ卷(客观题 共 44分)
注意事项:答第Ⅰ卷前,考生务必将自己的姓名、学号、班级及准考证号等分别写在试卷相应位置和涂在答题卡上;不能将题直接答在试卷上。
1、下列有关化学反应与能量变化的叙述正确的是 ( )
A.化学反应中的能量变化只体现为热量的形式
B.铝与氧化铁反应既是氧化还原反应,又是吸热反应[
C.甲烷燃烧反应过程中,旧键断裂吸收的能量小于新键形成释放的能量
D.外界条件相同时,放热反应的速率一定大于吸热反应的速率
2、下列设备工作时,将化学能转化为热能的是 ( )
| A | B | C | D |
 |  |  | |
| 硅太阳能电池 | 锂离子电池 | 太阳能集热器 | 燃气灶 |
3、用铂电极电解下列溶液时,阴极和阳极上的主要产物分别为H2和O2的是 ( )
A.稀HCl溶液 B.稀Na2SO4溶液 C.CuCl2溶液 D. AgNO3溶液
4、在一定条件下,密闭容器中发生如下反应:2SO2 + O2![]() 2SO3,当达到平衡时,通入18O2,再次平衡时,18O存在于 ( )
2SO3,当达到平衡时,通入18O2,再次平衡时,18O存在于 ( )
A.SO2 、O B.SO2、SO3C.SO2、O2、SO3D.O2、SO3
5、 现有反应4NH3+5O2=错误!未找到引用源。4NO+6H2O,反应速率分别用v (NH3)、v (O2)、v (NO)、v (H2O)、表示,其关系正确的是 ( )
A.4v (NH3)=5(O2) B.4 v(NH3)=5 v(H2O) C.4(O2)=5 v(NO) D.4 v(NH3)=5 v(NO)
6、在密闭容中发生下列反应aA(g)![]() cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.9倍,下列叙述正确的是( )
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.9倍,下列叙述正确的是( )
A.a > c+d B.平衡向正反应方向移动 C.D的体积分数变大 D. A的转化率变小
7、可逆反应:aA(g)+bB(s)![]() cC(g)+d D(g),当其他条件不变时,反应过程中某物质在混合物中的百分含量与温度(T)、压强(P)的关系如图所示,下列判断正确的是 ( )
cC(g)+d D(g),当其他条件不变时,反应过程中某物质在混合物中的百分含量与温度(T)、压强(P)的关系如图所示,下列判断正确的是 ( )
A.T1<T2ΔH>0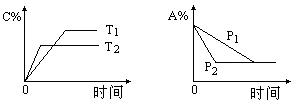
B.T1>T2ΔH<0
C.P1<P2a=c+d
D.P1<P2a+b=c+d
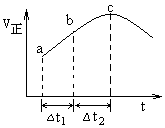 8、向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g)
8、向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g)![]() SO3(g)+NO(g)达平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是 ( )
SO3(g)+NO(g)达平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是 ( )
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.反应物的总能量低于生成物的总能量
D.Δt1=Δt2时,SO2的转化率:a~b段小于b~c段
9、有如下三个热化学方程式:2H2(g)+O2(g)===2H2O(g) ΔH=akJ·mol-1
2H2(g)+O2(g)===2H2O(l) ΔH=bkJ·mol-1
4H2(g)+2O2(g)===4H2O(l) ΔH=ckJ·mol-1
关于它们的下列表述正确的是( )
A.它们都是吸热反应 B.a、b和c均为正值 C.a=bD.2b=c
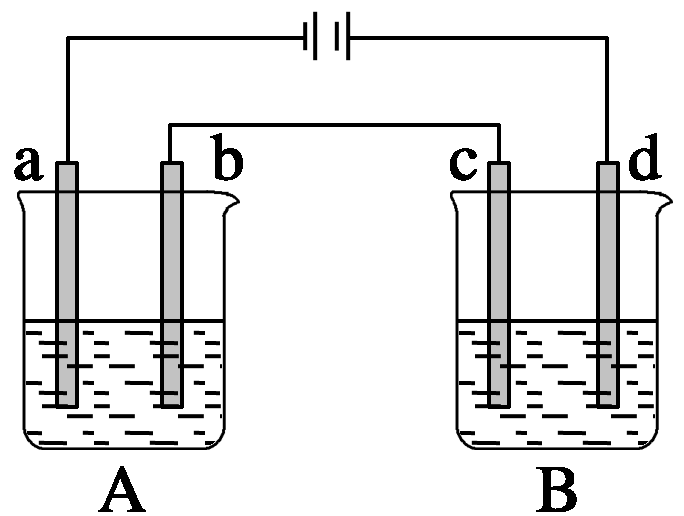 10、如图所示的A、B两个电解池中的电极均为铂,在A池中加入0.05 mol·L-1的CuCl2溶液,B池中加入0.1 mol·L-1的AgNO3溶液,进行电解。a、b、c、d四个电极上所析出的物质的物质的量之比是( )
10、如图所示的A、B两个电解池中的电极均为铂,在A池中加入0.05 mol·L-1的CuCl2溶液,B池中加入0.1 mol·L-1的AgNO3溶液,进行电解。a、b、c、d四个电极上所析出的物质的物质的量之比是( )
A.2∶2∶4∶1 B.1∶1∶2∶1 C.2∶1∶1∶1 D.2∶1∶2∶1
11、对已经达到化学平衡状态的下列反应2X(g)+Y2(g)![]() Z(g),减小压强时,对反应产生的影响是 ( )
Z(g),减小压强时,对反应产生的影响是 ( )
A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C.正、逆反应速率都减小,平衡向逆反应方向移动
D.正、逆反应速率都增大,平衡向正反应方向移动
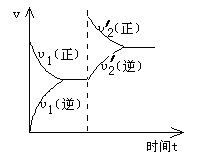 12、一定条件下,可逆反应 X(s)+ Y(g)
12、一定条件下,可逆反应 X(s)+ Y(g)![]() W(g)+ Z(g)(正反应是放热反应),在一体积不变的容器中反应达到平衡后,改变条件,反应速率(v)随时间变化的情况如图所示。下列条件的改变与图中情况相符的是 ( )
W(g)+ Z(g)(正反应是放热反应),在一体积不变的容器中反应达到平衡后,改变条件,反应速率(v)随时间变化的情况如图所示。下列条件的改变与图中情况相符的是 ( )
A.增大了Y的物质的量 B.降低了温度
C.增加了X的物质的量 D.增大了压强
13、已知H-H键能为436 KJ/mol,H-N键能为391 KJ/mol,根据热化学方程式N2(g)+3H2(g)=2NH3(g); ΔH= -92.4KJ/mol,则 N≡N的键能是( )
A.431 KJ/mol B.946 KJ/mol C.649 KJ/mol D.869 KJ/mol
14、在298K、100kPa时,已知:2 H2 (g) + O2 (g) =2 H2O(g) ΔH1
Cl2(g) + H2(g) = 2 HCl(g) ΔH2
2 Cl2(g) + 2H2O(g) = 4 HCl(g) + O2(g) ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是 ( )
A.ΔH3=ΔH1+ 2ΔH2B.ΔH3=ΔH1+ΔH2
C.ΔH3 = 2ΔH2-ΔH1D.ΔH3=ΔH1-ΔH2
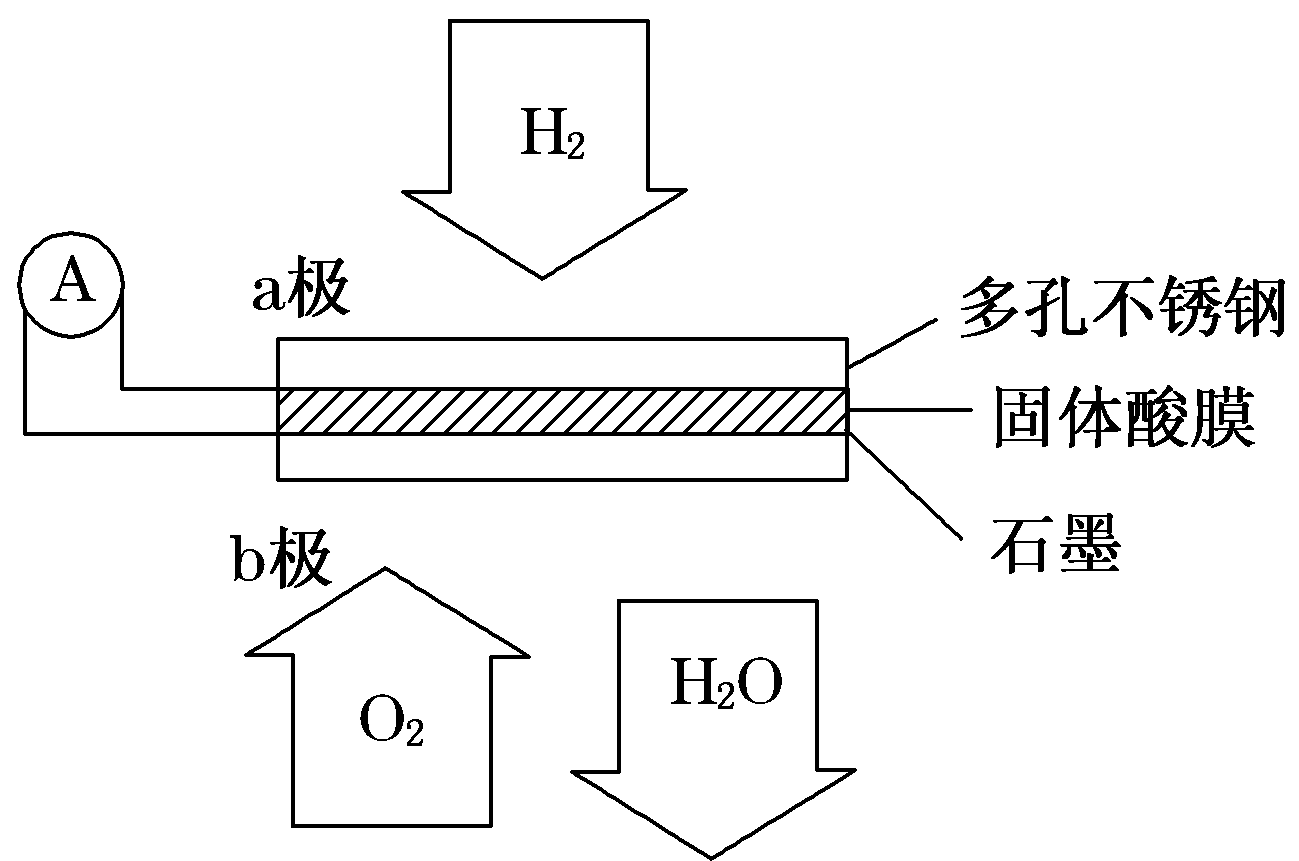 15、在一定温度下,向一个容积为2 L的密闭容器内(预先加入催化剂)通入2mol NH3,经过一段时间后,测得容器内的压强为起始时的1.2倍。则NH3的转化率为 ( )
15、在一定温度下,向一个容积为2 L的密闭容器内(预先加入催化剂)通入2mol NH3,经过一段时间后,测得容器内的压强为起始时的1.2倍。则NH3的转化率为 ( )
A.25% B.80% C.10% D.20%
16、某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构如图所示,电池总反应可表示为2H2+O2===2H2O,下列有关说法正确的是( )
资*源%库 A.电子通过外电路从b极流向a极
B.b极上的电极反应式为O2+2H2O+4e-===4OH-
C.每转移0.1 mol电子,消耗1.12 L的H2
D.H+由a极通过固体酸电解质传递到b极
17、在某温度下,可逆反应mA(g)+nB(g)![]() pC(g)+qD(g)平衡常数为K,下列说法正确的是 ( )
pC(g)+qD(g)平衡常数为K,下列说法正确的是 ( )
A.K越大,达到平衡时,反应进行的越完全 B. K随反应物浓度的改变而改变
C.K越小,达到平衡时,反应物的转化率越大 D.K不随温度的升高而改变
18、100℃时,将0.1 mol N2O4置于1 L密闭的烧瓶中,然后将烧瓶放入100℃的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g)![]() 2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到反应限度的是 ( )
2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到反应限度的是 ( )
A.N2O4的消耗速率与NO2的生成速率之比为1∶2
B.烧瓶内气体的颜色不再加深;
C.烧瓶内气体的平均相对分子质量不再变化; D.烧瓶内气体的压强不再变化。
19、下列措施或事实不能用勒夏特列原理解释的是 ( )
A.新制的氯水在光照下颜色变浅 B.H2、I2、HI平衡混合气加压后颜色变深
C.在合成氨的反应中,降温或加压有利于氨的合成
D.Fe(SCN)3溶液中加入6mol/L NaOH溶液后颜色变浅
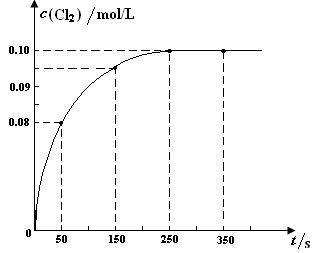 20、温度为T时,向2 L恒容密闭容器中充入1 mol PCl5,发生反应:PCl5(g)
20、温度为T时,向2 L恒容密闭容器中充入1 mol PCl5,发生反应:PCl5(g)![]() PCl3(g) + Cl2(g)。反应过程中c(Cl2) 随时间变化的曲线如下图所示,下列说法不正确的是 ( )
PCl3(g) + Cl2(g)。反应过程中c(Cl2) 随时间变化的曲线如下图所示,下列说法不正确的是 ( )
A.反应在0 ~50 s 的平均速率v(Cl2) =1.6×10-3mol/(L·s)
B.该温度下,反应的平衡常数K = 0.025
C.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol/L, 则该反应的ΔH <0
D.反应达平衡后,再向容器中充入1molPCl5,该温度下再达到平衡 时, 0.1 mol/L
21、在KI溶液中存在下列平衡:I2(aq)+I-(aq)![]() I3-(aq), 某I2、KI混合溶液中,
I3-(aq), 某I2、KI混合溶液中,
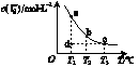 c(I3-)与温度T的关系如下图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是 ( )
c(I3-)与温度T的关系如下图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是 ( )
A.反应 I2(aq)+I-(aq)![]() I3-(aq)ΔH>0
I3-(aq)ΔH>0
B.若温度为T1、T2,反应的平衡常数分别为K1、K2,
则K2>K1
C.若T1时,反应进行到状态d时,一定有υ正 >υ逆
D.状态a与状态b相比,状态b时I2的转化率更高
22、某电动汽车配载一种可充放电的锂离子电池。放电时电池的总反应为:Li1-xCoO2+LixC6=LiCoO2+ C6(x<1)。下列关于该电池的说法不正确的是( )
A.放电时,Li+在电解质中由负极向正极迁移
B.放电时,负极的电极反应式为LixC6-xe-= xLi++ C6
C.充电时,若转移1mole-,石墨C6电极将增重7xg
D.充电时,阳极的电极反应式为LiCoO2-xe-=Li1-xCoO2+Li+
黄骅中学2016-2017年度高中二年级第一学期期中考试
第Ⅱ卷(共56 分)
23、(8分)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应为 反应(选填“吸热”、“放热”)。
(2)830℃时,容器中的反应已达到平衡。在其他条件不变的情况下,扩大容器的体积。平衡 移动(选填“向正反应方向”、“向逆反应方向”、“不”)。
(3)若 830℃时,向1L密闭容器中充入1mol CO、1mol H2O,反应达到平衡后,其化学平衡常数K 1.0(选填“大于”、“小于”、“等于”),平衡时,CO的浓度是
(4)若1200℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2 mol·L-1、2 mol·L-1、4 mol·L-1、4 mol·L-1,则此时上述反应的平衡移动方向为
(选填“正反应方向”、“逆反应方向”、“不移动”)
24、(8分)稀强酸、稀强碱反应生成1mol水时放出57.3 kJ的热。
(1)实验室中可用稀盐酸和氢氧化钡稀溶液反应来测定中和热。请写出能表示该反应中和热的热化学方程式
(2)分别取100 mL 0.50 mol/L盐酸与100 mL 0.55 mol/L NaOH溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。假设盐酸和氢氧化钠溶液的密度都是1g/cm3,中和后生成溶液的比热容c = 4.18 J/(g·℃)。实验时,测得反应前盐酸与NaOH溶液的平均温度为21.5℃,反应后混合溶液的温度为24.9℃。则实验测得的中和热△H=____ ___(保留1位小数)
(3) 如果用含1 mol HCl的稀醋酸与足量氢氧化钠固体反应,反应放出的热____57.3 kJ(填“大于”、“小于”或“等于”);理由是____________
25、(8分)科学家一直致力于“人工固氮”的方法研究。
合成氨的原理为:N2(g)+3H2(g)![]() 2NH3(g),该反应的能量变化如图所示。
2NH3(g),该反应的能量变化如图所示。
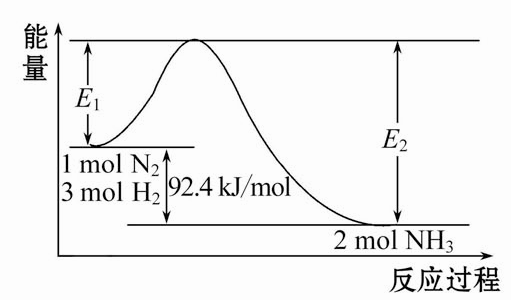 (1)在反应体系中加入催化剂,反应速率 ,E2的变化是 (填“增大”、“减小”或“不变”)
(1)在反应体系中加入催化剂,反应速率 ,E2的变化是 (填“增大”、“减小”或“不变”)
(2)该反应的反应热ΔH= ,已知E2=212.4 kJ/mol,则该反应正反应的活化能是
$来&源:
(3)该反应化学平衡常数的表达式:K=
该反应的化学平衡常数K和温度t的关系如下表所示:
| t℃ | 473 | 573 | 673 | …… |
| K | 4.4×10-2 | K1 | K2 | …… |
则K1K2(填>、<、=)
(4)该反应的△S 0,(填大于、小于或等于),理论上在 条件下可以自发。
26、(10分)某学生为了探究铁与盐酸反应过程中的速率变化,他在100 mL稀盐酸中加入足量的铁粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(气体体积为标准状况下测定的体积)
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5 min)反应速率最大 ,
原因是
(2)哪一段时段的反应速率最小 ,原因是
(3)如果反应太激烈,为了减缓反应速率而又不影响产生氢气的量,他在盐酸中分别加入等体积的下列溶液,你认为可行的是(填编号)
A.蒸馏水 B.NaOH溶液 C.Na2CO3溶液 D.CuSO4溶液 E.NaCl溶液
(4)2~3分钟时间段以盐酸的浓度变化来表示的该反应速率为
27、(14分)新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液。某研究小组将甲烷燃料电池作为电源,进行饱和氯化钠溶液电解实验,如图所示。回答下列问题:
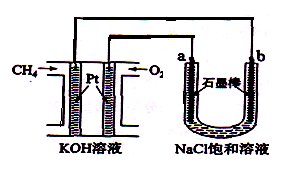
(1)甲烷燃料电池正极、负极的电极反应分别为:正极________________ ,负极________________
(2)b电极上得到的气体是___________,电解氯化钠溶液的总反应方程式为 _____
____
(3)若甲烷通入量为1 L(标准状况),且反应完全,则最多能产生的氯气体积为______L(标准状况)。
(4)以甲醇(CH3OH)为燃料的电池中,电解质溶液为酸性,则正极、负极的电极反应
分别为:正极________________ ,
负极________________
28、(8分)工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为:CrOCr2OCr3+Cr(OH)3↓
其中第①步存在平衡:2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若该平衡处于强酸性环境中,则溶液显 色
(2)能说明第①步反应达平衡状态的是
a.Cr2O72-和CrO42-的浓度相同 b.2v(Cr2O72-) =v(CrO42-) c.溶液的颜色不变
方法2:电解法
该法用Fe做阳极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(3)用Fe做电极的原因为
(4)在阴极附近溶液pH升高的原因是(用电极反应式解释)
溶液中同时生成的沉淀还有
化学答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| C | D | B | C | C | D | C | D | D | A | C |
| 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| A | B | C | D | D | A | A | B | C | C | C |
23、(8分)(1) 吸热 (1分)(2)不 (1分)
(3)等于(2分)0.5mol/L(2分)(4)逆(2分)
24、(8分)(每空2分)
(1)½ Ba(OH)2(aq) + HCl (aq) == ½BaCl2(aq) + H2O(l)△H = —57.3kJ/mol
(2)△H= —56.8 kJ/mol (3)大于 氢氧化钠溶解放热
25、(8分)(每空1分)
(1)增大 减少 (2)-92.4KJ/mol 120KJ/mol
(3) 略 >(4)< 低温
26、(10分)
(1)2~3(1分)锌与盐酸反应放出热量,温度升高,速率加快(2分)
(2)4~5(1分) 盐酸浓度太小,使反应减慢(2分)
(3)AE(2分) (4)0.1 mol·L-1·min-1(2分)
27、(14分)(每空2分)(1)O2+4e-+2H2O=4OH-,CH4-8e-+10OH-=CO32-+7H2O
(2)H2,略。(3)4L (4)O2+4e-+4H+=2H2O,CH3OH-6e+H2O-=CO2+6H+
28、(8分)(1)橙色 (1分) (2)c (1分) (3)Fe-2e-=Fe2+,做还原剂(2分) (4)2H++2e-=H2↑(2分) Fe(OH)3(2分)