
湖南省醴陵二中、醴陵四中2016-2017学年高二下学期期中联考化学试卷
03月05日
海南中学2014-2015年度第一学期期终考试
高二文科化学
第I卷
(17、18、19、20班用 考试时间:45分钟)
一、选择题(每小题只有一个正确答案,共20×3=60分)
1、清晨的树林,可以观测到一束束的阳光透过树叶,射入林间,这是种现象源自胶体的
A.丁达尔效应 B.聚沉 C.电泳D.折射
2、把0.1molNaCl固体溶于水,配成1L 溶液,溶液中NaCl的物质的量浓度是
A.2 mol/L B.0.2 mol/L C.1 mol/L D.0.1mol/L
3、四种仪器中,不能用来加热的是
A.烧杯B.容量瓶C.试管D.烧瓶
4、与盐酸或氢氧化钠溶液反应都能放出氢气的是
A.CuB.MgC.FeD.Al
5、浓H2SO4能干燥氯气,是利用了浓H2SO4的
A.强酸性B.吸水性C.脱水性D.强氧化性
6、有关水在人体中的作用,正确的说法是
A.水是一种很好的溶剂B.水在人体内没有调节体温的作用
C.饮用水越纯净越好D.没有污染的水就是纯净水
7、下列物质中,水解的最终产物含有葡萄糖的是
A.油脂B.蛋白质C.淀粉D.酶
8、氢气在氯气中燃烧,会发出
A、苍白色火焰 B、淡黄色火焰 C、蓝紫色火焰 D、耀眼白光
9、胶体区别于其他分散系的本质特征是
A、加热会聚沉 B、产生丁达尔现象
C、胶体微粒不能透过半透膜 D、分散质颗粒大小在1-100nm之间
10、将一小块钠投入到煤油和水的试管中(煤油和水均足够多)想一想可能观察到的现象是
A、钠浮在试管的液面上 B、钠沉入试管底部
C、钠燃烧起来 D、钠处于煤油和水交界处
11、下列反应中,属于氮的固定的是
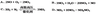
12、在标准状况下,气体摩尔体积约为22.4L/mol,则标准状况下0.5mol水的体积约为
A、0.5L B、5L C、11.2L D、不能确定
13、配制一定物质的量浓度的溶液时,由于操作不慎,使得液面略超过容量瓶的刻度(标线),这时应采取的措施是
A、再加点溶质到容量瓶中去 B、影响不大,不再处理
C、用胶头滴管准确吸出标线上的溶液 D、重新配制
14、已知下列溶液的溶质都是强电解质,这些溶液中的Cl浓度与50mL 1mol/L MgCl2溶液中的Cl浓度相等的是
A、150 mL 1 mol/L NaCl溶液 B、75 mL 2 mol/L CaCl2溶液
C、150 mL 2 mol/L KCl溶液 D、75 mL 1 mol/L AlCl3溶液
15、有反应方程式:Cu + 2H2SO4(浓)∆CuSO4 + SO2 ↑+ H2O,当32gCu完全反应时,被还原的H2SO4的物质的量为(已知:MCu= 64 g/mol)
A、0.5mol B、1.0mol C、1.5mol D、2.0mol
16、下列离子方程式中正确的是
A、石灰石与盐酸反应: CO32- + 2H+ = H2O + CO2↑
B、氯化铝溶液中加入过量氨水:Al3++ 3OH- = Al(OH)3↓
C、向氯化亚铁溶液中加入氯水:Fe2+ + Cl2 = Fe3+ + 2Cl-
D、二氧化碳通入碳酸钠溶液中:CO2 + CO32- + H2O = 2HCO3-
17、下列说法中正确的是
A、氧化还原的本质是元素化合价发生变化
B、还原剂是一种能得到电子的物质
C、物质所含元素化合价升高的反应是还原反应
D、氧化反应和还原反应是同时发生的
18、下列物质中,属于电解质是
A、铜丝 B、 NaCl C、酒精 D、蔗糖
19、 下列物质所含的分子数(或原子数)等于阿伏加德罗常数的是
A、0.5mo1 C2H4 B、11.2L(标准状况) C2H2气体
C、23g Na D、9g H2O
20、关于反应方程式Cl2 + 2I- = 2Cl- + I2,说法不正确的是
A、Cl2是氧化剂 B、I2是还原产物
C、上述反应属于置换反应 D、上述反应属于离子反应
第II卷
二、填空题(共40分)
21、(10分)以下是氮循环的一部分:
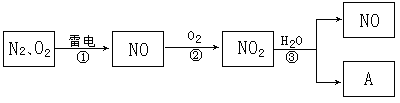
溶液B
FeCl3粉末
+AlCl3粉末
沉淀C
操作②
加入过量的NaOH溶液
溶液A
操作①
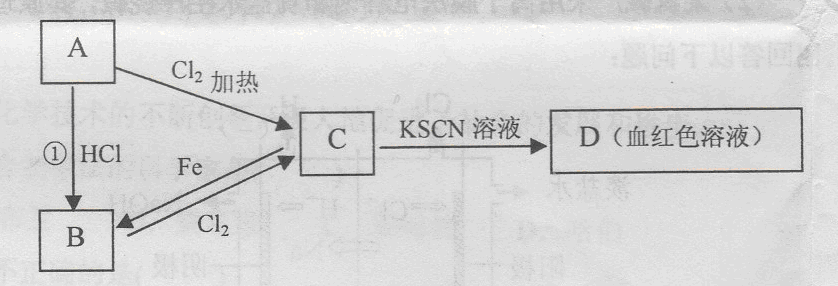 试回答下列问题:
试回答下列问题:23.(每空2分)(1)Fe (2)C:FeCl3
(3)红褐色沉淀
(4)置换反应
24. (每空2分)(1)CO2(2)SO2
催化剂
(3)2SO2+O2========2SO3
SO2+H2O ===H2SO3
SO3+H2O ===H2SO4
2H2SO3+O2===2H2SO4