
湖南省醴陵二中、醴陵四中2016-2017学年高二下学期期中联考化学试卷
03月05日
莆田第二十五中学2016—2017学年下学期月考一试卷
高二化学
一.单选题 每小题3分,共18题,54分
1下列说法中错误的是( )
A.所有的非金属元素都分布在p区
B.元素周期表中ⅢB族到ⅡB族10个纵行的元素都是金属元素
C.在同一主族中,自上而下第一电离能逐渐减小
D.第ⅠA、ⅡA族元素的原子,其半径越大,电负性越小
2下列物质中属离子化合物的是( )
A.苛性钾 B.碘化氢 C.硫酸 D.醋酸
3下列关于体心立方堆积晶体结构(如图所示)的叙述中正确的是( )
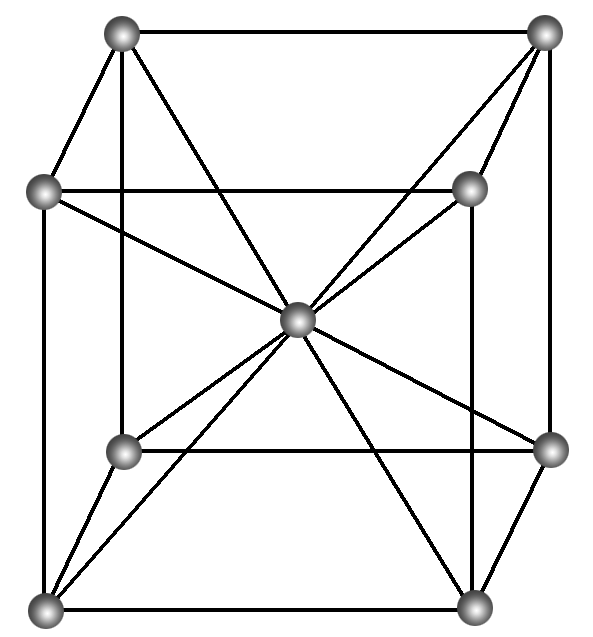 A.是密置层的一种堆积方式
A.是密置层的一种堆积方式
B.晶胞是六棱柱
C.每个晶胞内含2个原子
D.每个晶胞内含6个原子
4金属的熔沸点与金属键强弱有关,判断下列金属熔点逐渐升高的是( )
A.Li、Na、K B.Na、Mg、Al
C.Li、Be、Mg D. Li、Na、Mg
5铝的熔沸点比镁高的原因是( )
A.镁比铝活泼 B.铝的化合价比镁高
C.铝能与酸碱反应 D.铝比镁的价电子多,半径比镁小
6.下列不属于金属晶体共性的是( )
A.易导电 B.易导热 C.有延展性 D.高熔点
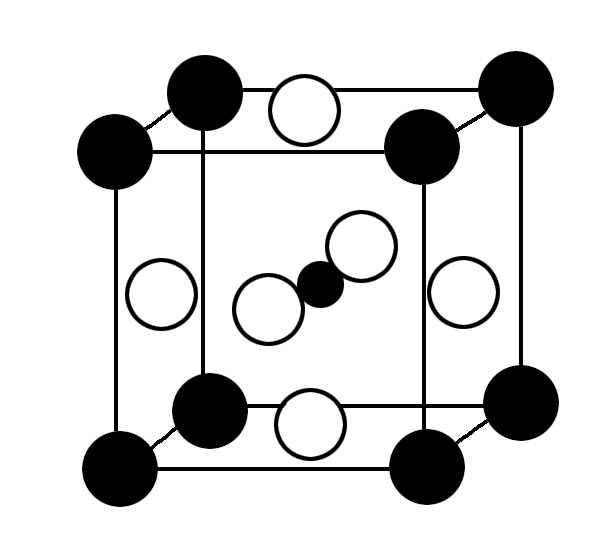 7最近发现,只含镁、镍和碳三种元素的晶体竟然也具有超导性。鉴于这三种元素都是常见元素,从而引起广泛关注。该新型超导材料的一个晶胞(碳原子用小●球,镍原子用大○球,镁原子用大●球)如图所示。该晶体的化学式是( )
7最近发现,只含镁、镍和碳三种元素的晶体竟然也具有超导性。鉴于这三种元素都是常见元素,从而引起广泛关注。该新型超导材料的一个晶胞(碳原子用小●球,镍原子用大○球,镁原子用大●球)如图所示。该晶体的化学式是( )
A.Mg2CNi3B.MgC2Ni
C.MgCNi2D.MgCNi3
8.A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应的水化物均呈碱性,且碱性B>A,C和D的气态氢化物的稳定性C>D;E是这五种元素中原子半径最小的元素,则它们的原子序数由小到大的顺序是( )
A.A、B、C、D、E B.E、C、D、B、A
C.B、A、D、C、E D.C、D、A、B、E
9.实现下列变化,需克服相同类型作用力的是( )
A.碘和干冰升华 B.二氧化硅和生石灰熔化
C.氯化钠和铁熔化 D.汞和乙烷蒸发
10.我国报道的高温超导体中,铊(Tl)是组成成分之一。已知铊和Al是同族元素,关于铊的判断错误的是( )
A.铊是银白色质软的金属 B.氢氧化铊是两性氢化物
C.能生成+3价化合物 D.能置换出盐酸中的氢原子
11.根据下表中提供的数据,判断可以形成合金的是( )
| 金属或非金属 | 钠 | 铝 | 铁 | 硅 | 硫 |
| 熔点/℃ | 97.8 | 660.4 | 1535 | 1410 | 112.8 |
| 沸点/℃ | 883 | 2467 | 2750 | 2353 | 444.6 |
A.铝与硅B.铝与硫
C.钠与硫D.钠与硅
12 M元素的1个原子失去2个电子,该2个电子转移到Y元素的2个原子中去,形成离子化合物Z,下列说法中正确的是( )
A.Z具有较高的熔点
B.Z的化学式可表示为M2Y
C.Z一定能溶于水
D.Z的电子式为![]()
13现有四种元素的基态原子的电子排布式如下:
①1s22s22p63s23p4;②1s22s22p63s23p3;
③1s22s22p3;④1s22s22p5。
则下列有关比较中正确的是( )
A.第一电离能:④>③>②>①
B.原子半径:④>③>②>①
C.电负性:④>③>②>①
D.最高正化合价:④>③=②>①
14下列各组元素性质的递变情况错误的是( )
A.Li、Be、B原子最外层电子数依次增多
B.P、S、Cl元素最高正价依次升高
C.N、O、F电负性依次增大
D.Na、K、Rb第一电离能逐渐增大
15萤石(CaF2)晶体属于立方晶系,萤石中每个Ca2+被8个F-所包围,则每个F-周围最近距离的Ca2+数目为( )
A.2 B.4 C.6 D.8
16若某基态原子的外围电子排布为4d15s2,则下列说法正确的是 ( )
A.该元素基态原子中共有3个电子 B.该元素原子核外有5个电子层
C.该元素原子最外层共有3个电子 D.该元素原子M能层共有8个电子
17下列能级的能量大小比较,正确的是 ( )
A.E(4s)>E(3d) B.E(6p)>E(5f) C.E(6s)<E(5p) D.E(4d)<E(5p)
18“各能级最多容纳的电子数,是该能级原子轨道数的二倍”,支撑这一结论的理论是( )
莆田第二十五中学2016—2017学年下学期月考一答题卷
高二化学
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | |||||||||
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
二、填空题,(每空2分,共46分)
19. X原子在第二电子层上只有一个空轨道,则X是________;其轨道表示式为____________________;R原子的3p轨道上只有一个未成对电子,
则R原子可能是________;Y原子的核电荷数为33,其外围电子排布是________,其在元素周期表中的位置是____________________,是属于________区的元素
20.在核电荷数1—18的元素中的金属晶体单质中,密度最小的是_____________,地壳中含量最多的是_____________,熔点最低的是_____________,既能与酸反应,又能与碱反应除了Be还有_____________,单质的还原性最强的是_____________。
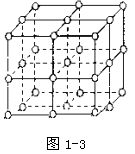 21金属的常见堆积方式有三种,配位数为8的是___________堆积,铜属于___________堆积。
21金属的常见堆积方式有三种,配位数为8的是___________堆积,铜属于___________堆积。
22如图,直线交点处的圆圈为NaCl晶体中![]() 离子或
离子或![]() 离子所处的位置.这两种离子在空间3个互相垂直的方向上都是等距离排列的.
离子所处的位置.这两种离子在空间3个互相垂直的方向上都是等距离排列的.
的距离为______________________ cm.
23如图所示的甲、乙、丙三种晶体:
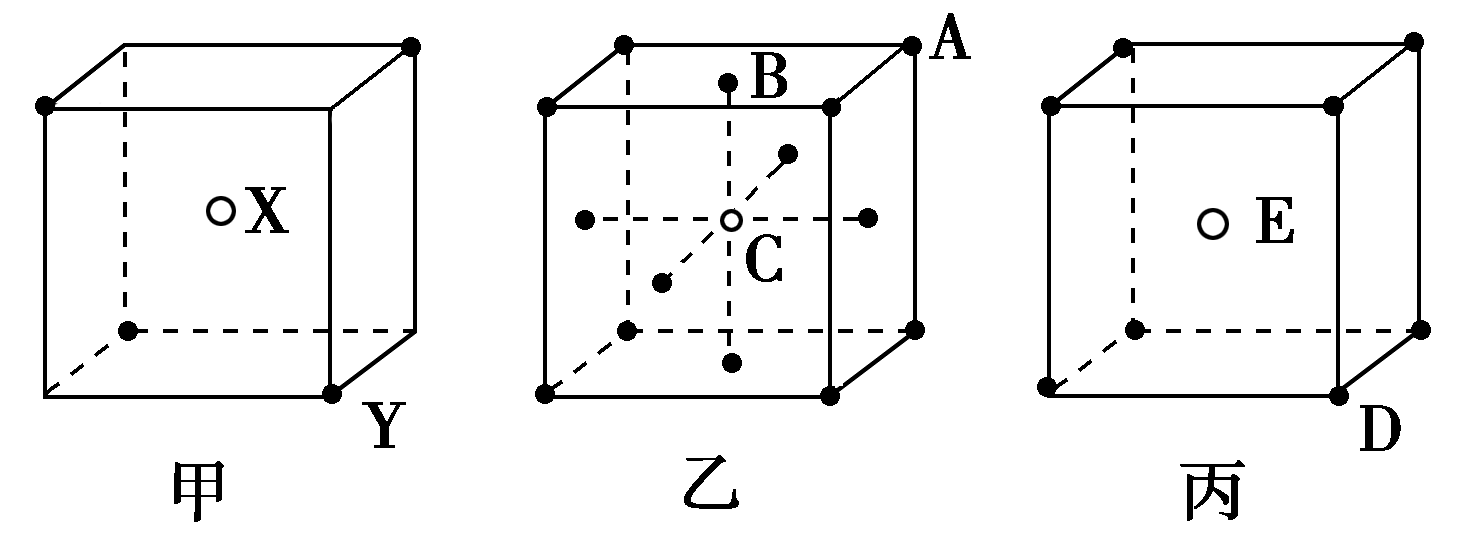
试推断甲晶体的化学式(X为阳离子)为___________,乙晶体中A、B、C三种微粒的个数比是___________,丙晶体中每个D周围结合E的个数是___________个
24已知有关物质的熔、沸点数据如下表:
| 物质 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 熔点/℃ | 2 852 | 2 072 | 714 | 190(2.5×105Pa) |
| 沸点/℃ | 3 600 | 2 980 | 1 412 | 182.7 |
请参考上述数据填空和完成问题:
(1)工业上常用电解熔融MgCl2的方法生产金属镁,电解Al2O3与冰晶石熔融混合物的方法生产铝。为什么不用电解MgO的方法生产镁,也不用电解AlCl3的方法生产铝?_________________________________________________________________________。
(2)设计可靠的实验证明MgCl2、AlCl3所属的晶体类型,其实验方法是_________________________________________________________________________。
