佳木斯第二中学高二学年上学期期中考试
化学试卷
命题人:徐爱莉 审题人:王丽芳
本试卷分第I卷(选择题)和第II卷(综合题)两部分。满分100分。考试用时90分钟。
注意事项:
- 答题前,考生务必将自己的姓名、考号、考试科目用铅笔涂写在答题卡I上。
- 每小题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案标号。选择题部分不能答在试题卷上。
- 第II卷各题的答案,必须答在答题卡II规定的地方,规定区域外答题不得分。
相对原子质量:H:1 C:12 N:14 O:16
第I卷(选择题:共60分)
- 选择题(每小题只有一个正确选项,每小题3分,共60分)。
1.研究物质变化时,人们可以从不同的角度、不同的层面来认识物质变化时所引起的化学
键及能量变化。据此判断以下叙述中错误的是 ( )
A.金属钠与氯气反应生成氯化钠后,其结构的稳定性增强,体系的能量升高
B.物质燃烧可看成“储存”在物质内部的能量(化学能)转化为热能释放出来
C.现在人们使用的能源正向多元化发展,许多新能源不断被开发利用,其中氢能和太阳能均属于清洁能源
D.需加热才能发生的反应不一定是吸收能量的反应
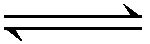 2.反应2SO2+O2 2SO3经一段时间后,SO2的浓度减少了0.4 mol/L,在这段时间内用O2表示的反应速率为0.04 mol/(L·s),则这段时间为( )
2.反应2SO2+O2 2SO3经一段时间后,SO2的浓度减少了0.4 mol/L,在这段时间内用O2表示的反应速率为0.04 mol/(L·s),则这段时间为( )
A.0.1 s B.2.5 s C.5 s D.10 s
3.下列溶液一定显碱性的是( )
A、pH = 8的某电解质的溶液 B、c(OH-)>1×10-7mol/L
C、溶液中含有OH-D、溶液中c(OH-)>c(H+)
4.如图是可逆反应N2(g)+3H2(g) 2NH3(g) 在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
2NH3(g) 在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )

A.t1时,只有正方向反应 B.t2时,反应到达限度
C.t2-t3,反应不再发生 D.t2-t3,各物质的浓度相等且不再发生变化
5.已知H2(g)+Cl2(g)===2HCl(g) ΔH1=-184.6 kJ/mol,则反应HCl(g)=== H2(g)+ Cl2(g)的ΔH为( )
A.+184.6 kJ/mol B.-92.3 kJ/mol
C.+92.3 kJ D.+92.3 kJ/mol
6.在一定条件下的定容密闭容器中,当物质的下列物理量不再变化时,不能表明反应: A(s)+2B(g) C(g)+D(g)已达平衡的是( )
C(g)+D(g)已达平衡的是( )
A.混合气体的压强 B.混合气体的密度
C.B的物质的量浓度 D.混合气体的平均相对分子质量
7.将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g) 2C(g)。若经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
2C(g)。若经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的反应平均速率为0.6 mol·L-1·s-1
②用物质B表示的反应的平均速率为0.15mol·L-1·s-1
③2s时物质A的转化率为30%
④2s时物质B的浓度为0.3 mol·L-1
其中正确的是( )
A.①③ B.①④ C.②③ D.③④
8.下列关于热化学反应的描述正确的是( )
A.HCl和NaOH反应的中和热ΔH=-57.3 kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ/mol
B.CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)===2CO(g)+O2(g)反应的ΔH=+(2×283.0) kJ/mol
C.反应热的大小与反应物和生成物的键能无关
D.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
9.下列说法正确的是( )
A.根据醋酸溶液中分子和离子共存,即可证明溶液达到了电离平衡状态
B.c(CH3COO-)=c(H+),则醋酸溶液达到电离平衡状态
C.当NH3·H2O达到电离平衡时,溶液中NH3·H2O和OH-的浓度肯定相等
D.磷酸是分步电离的,电离程度依次减弱
10.向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g) 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下图和下表表示。下列说不正确的是( )
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下图和下表表示。下列说不正确的是( )| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | 1.0L |
| 温度/℃ | T1 | T2 | T2 |
反应物
起始量 | 1.5molA
0.5molB | 1.5molA
0.5molB | 6.0molA
2.0molB |

A.10min内乙容器中反应的平均速率: v(A) = 0.05mol·(L·min)-1
B.由图可知T1>T2,且该反应为吸热反应
C.x=1,若平衡时保持温度不变,改变容器体积平衡不移动
D.T2℃,丙容器比乙容器反应快的原因可能是使用了催化剂
11.下列说法正确的是( )
A.电离平衡常数受溶液浓度的影响
B.电离平衡常数不可以表示弱电解质的相对强弱
C.电离常数越大的酸,其溶液的c(H+)一定越大
D.H2CO3的第一步电离的电离常数表达式:K=
12.已知A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:| 温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
830℃时,向一个2 L的密闭容器中充入0.2mol的A和0.8mol的B,反应初始4 s内A的平均反应速率v(A)=0.005 mol/(L·s)。下列说法正确的是( )
A.4 s时c(B)为0.76 mol/L
B.830℃达平衡时,A的转化率为80%
C.反应达平衡后,升高温度,平衡正向移动
D.1200℃时反应C(g)+D(g) A(g)+B(g)的平衡常数的值为0.4
A(g)+B(g)的平衡常数的值为0.4
13.在密闭容器中发生如下反应:mA(g)+nB(g) pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的一半,当达到新平衡时,C的浓度为原来1.9倍,下列说法错误的是( )
pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的一半,当达到新平衡时,C的浓度为原来1.9倍,下列说法错误的是( )
A.平衡向逆反应方向移动 B.A的转化率降低
C.m+n>p D.C的体积分数减小
14.氢离子浓度相同的等体积的两份溶液A和B,A为盐酸,B为醋酸,分别和锌反应,若最后仅有一份溶液中存在锌,且放出氢气的体积相等,则下列说法正确的是( )
①反应所需要的时间B>A ②开始反应时的速率A>B ③参加反应的锌的物质的量A=B ④反应过程的平均速率B>A ⑤盐酸中有锌剩余 ⑥醋酸中有锌剩余
A.③④⑤ B.③④⑥ C.②③⑤ D.②③⑤⑥
15.T℃时,某一气态平衡体系中含有X(g)、Y(g)、Z(g)、W(g)四种物质,此温度下发生反应的平衡常数表达式为: ,有关该平衡体系的说法正确的是( )
,有关该平衡体系的说法正确的是( )
A.该反应可表示为X(g) + 2Y(g) 2Z(g) + 2W(g)
2Z(g) + 2W(g)
B.减小X浓度,平衡向逆反应方向移动,平衡常数K减小
C.增大反应容器的压强,该反应速率一定增大
D.升高温度,W(g)体积分数增加,则正反应是放热反应
16.下列过程一定不能自发进行的是( )
A.2N2O5(g)=4NO2(g)+O2(g);ΔH>0 B.2CO(g)=2C(s)+O2(g);ΔH>0
C.(NH4)2CO3(s)=NH4HCO3(s)+NH3(g);ΔH>0 D.2H2(g)+O2(g)=2H2O(l);ΔH<0
17.一元弱酸HA溶液中存在下列电离平衡:HA H++A—。将1.0 mol HA分子加入1.0 L水中,如图,表示溶液中HA、H+、A-的物质的量浓度随时间而变化的曲线正确的是( )
H++A—。将1.0 mol HA分子加入1.0 L水中,如图,表示溶液中HA、H+、A-的物质的量浓度随时间而变化的曲线正确的是( )

18.在2A + B = 3C + 4D的反应中,下列表示该反应速率最大的是( )
A.V(C)=0.5mol / (L·min) B.V(A)=0.8mol / (L·min)
C.V(B)=0.3mol / (L·min) D.V(D)= 1mol / (L·min)
19.2.0molPCl3和1.0molCl2充入体积不变的密闭容器中,在一定条件下发生下述反应:
PCl3(g)+Cl2(g) PCl5(g);反应达到平衡时,PCl5为0.4mol;如果此时移走1.0molPCl3和0.5molCl2,在相同的温度下再达到平衡时,PCl5的物质的量为
PCl5(g);反应达到平衡时,PCl5为0.4mol;如果此时移走1.0molPCl3和0.5molCl2,在相同的温度下再达到平衡时,PCl5的物质的量为- 0.4mol B. 0.2mol
C. 小于0.2mol D. 大于0.2mol,小于0.4mol
20.将pH=4的酸性溶液与pH=10的NaOH溶液等体积混合后,溶液的pH可能是( )
A.等于7 B.大于7 C.小于7 D.无法确定
第II卷(非选择题:共40分)
- 非选择题(本题包括4个小题,共40分)
- (10分)
(1)写出硫酸氢钠在水溶液中的电离方程式_________________________________
(2)卫星发射时可用肼(N2H4)做燃料,1 mol N2H4(L)在氧气(g)中燃烧,生成氮气(g)和水(L),放出622KJ热量。请书写该反应的热化学方程式_________________________________
(3)写出H2S在水溶液中的电离方程式_________________________________
(4)写出H2SO4溶液与Na2S2O3溶液反应的离子方程式_______________________
(5)下列物质中,能导电的是________,属于电解质的是________
①Cu ②H2SO4 ③NaCl溶液 ④NaOH ⑤BaSO4 ⑥蔗糖 ⑦石墨 ⑧熔融KCl
22.(12分)燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等。
(1)对燃煤废气进行脱硝处理时,常利用甲烷催化还原氮氧化物:
①CH4(g)+4NO2(g)==4NO(g)+CO2(g)+2H2O(g) ΔH=-570 kJ·mol-1
②CH4(g)+4NO(g)==2 N2(g) +CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
则CH4(g)+2NO2(g)== N2(g)+CO2(g)+2H2O(g) ΔH=___________。 - 将燃煤废气中的CO2转化为甲醚的反应原理为:
2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
已知在压强为a MPa下,该反应在不同温度、不同投料比时,CO2的转化率见下图:

①此反应为 (填“放热”、“吸热”);若温度不变,提高投料比[n(H2)/n(CO2)],则K将________(填“增大”、“减小”或“不变”)。
②在a MPa和一定温度下,将6 mol H2和2 mol CO2在2 L密闭容器中混合,当该反应达到平衡时,测得平衡混合气中CH3OCH3的体积分数约为16.7%(即1/6),此时CO2的转化率为
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实
验
组 | 温
度
/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min |
| H2O | CO | H2 | CO |
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
①650℃时该反应的化学平衡常数数值为 ,该反应的逆反应为 (填“吸”或“放”)热反应。
②若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t<3 min,则a、b应满足的关系是 (用含a、b的数学式表示)。
23.(12分)
(Ⅰ)Al(OH)3的电离方程式可表示为:H2O+AlO2—+H+ Al(OH)3
Al(OH)3 Al3++3OH—,试根据平衡移动原理解释下列有关问题:
Al3++3OH—,试根据平衡移动原理解释下列有关问题:
- 向Al(OH)3沉淀中加入苛性钠溶液,沉淀溶解,其原因是__________________________
- 向Al(OH)3沉淀中加入盐酸,沉淀溶解,有关的离子方程式是 。
(Ⅱ)已知4℃时,纯水中c(H+)=5×10-8mol/L,此时KW数值为__________;在25℃时,pH=4的盐酸溶液中由H2O电离产生c(H+)=_______________,由上述数据可以得出:升温时水的电离程度__________;加酸或加碱时水的电离程度__________。(填“增大”或“减小”或“不变”)
- (6分)
25℃时,有pH=12的NaOH溶液100 mL,要使其pH变为11
- 若加入蒸馏水,应加__________mL;
- 若加入pH为10的NaOH溶液,应加______mL;
- 若加入0.01 mol/L的盐酸,应加________mL。(以上数据均要求保留整数)
高二化学上学期期中考试答案
- 单选(3×20=60分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| A | C | D | B | D | A | C | B | D | B | D | B | C | A | D | B | C | B | C | D |
21(10分)
(1)NaHSO4=Na++H++SO42-1分
(2)N2H4(l)+O2(g)=N2(g)+2H2O(l)ΔH=—622 kJ/mol 2分
(3)H2S = HS—+H+ 1分
(4) S2O32-+2H+=S+SO2+H2O2分
(5)①⑦⑧2分④⑤⑧2分
22(12分)
- ΔH=—865 kJ/mol 2分 (2)①放热 1分 不变 1分 80% 2分
- ①8/3 2分 吸热 2分 2a=b a>1 2分
23(12分)
(Ⅰ)(1)加入氢氧根消耗氢离子,使得氢离子浓度降低,平衡向生成偏铝酸根的方向移动,使得氢氧化铝溶解 2分
(2)3H++Al(OH)3=3H2O+Al3+2分
(Ⅱ)2.5×10-172分10-10mol/L 2分 增大 2分 减小 2分
24(6分)- 900 2分 (2)1000 2分 (3)82 2分




![]() CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)

![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:![]() Al(OH)3
Al(OH)3![]() Al3++3OH—,试根据平衡移动原理解释下列有关问题:
Al3++3OH—,试根据平衡移动原理解释下列有关问题: