
湖南省醴陵二中、醴陵四中2016-2017学年高二下学期期中联考化学试卷
03月05日
大庆铁人中学2015—2016年度第一学期高二阶段性检测
化学试题命题人:
说明:1、可能用到的相对原子质量:
H1 C 12 O 16 Na 23 S 32 Cl35.5 Cu 64 Zn 65
2、满分:100分 考试时间:90分钟
第Ⅰ卷(选择题 共2分)
本题共21小题,每小题只有一个选项最符合题意,每小题2分,共42分
1、决定化学反应速率快慢的因素是( )
A、温度 B、浓度 C、催化剂 D、反应物的性质
2.下列说法中正确的是( )
B. C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1);△H=-5518kJ·mol-1
C. C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1);△H=+5518kJ·mol-1
D. C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1);△H=-48.40kJ·mol-1
9、已知反应A2(g)+2B2(g)![]() 2AB2(g)△H<0,下列说法正确的( )
2AB2(g)△H<0,下列说法正确的( )
A.升高温度,正向反应速率增加,逆向反应速率减小
B.升高温度有利于反应速率增加,从而缩短达到平衡的时间
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
 10、有关右图装置的叙述不正确的是( )
10、有关右图装置的叙述不正确的是( )
A.这是电解NaOH溶液的装置
B.该装置中Pt为正极,电极反应为:
O2 + 2H2O + 4e-![]() 4OH-
4OH-
C.该装置中Fe为负极,电极反应为:Fe—2e—=Fe2+
D.溶液中最终产生红褐色沉淀
11.把0.6 mol X气体和0.4 mol Y气体混合于容积为2 L的容器中,使其发生反应3X(g)+Y(g)===nZ(g)+2W(g)。5 min末生成0.2 mol W,若测知0~5 min内以Z的浓度变化表示的平均反应速率为0.01 mol/(L·min),则n的值为( )
A.1 B.2 C.3 D.4
12、一定条件下的反应:PCl5(g)![]() PCl3(g)+Cl2(g)(△H>0)达到平衡后,下列情况使PCl5分解率降低的是( )
PCl3(g)+Cl2(g)(△H>0)达到平衡后,下列情况使PCl5分解率降低的是( )
A.温度、体积不变,充入氩气B.体积不变,对体系加热
C.温度、体积不变,充入氯气D.温度不变,增大容器体积
13、下图两个装置中,液体体积均为200ml,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上都通过了0.02mole—,若不考虑溶液体积的变化,下列叙述正确的是( )
A.产生气体体积①=②
B.电极上析出固体质量①<②
C.电极反应式:①中阳极:4OH-—4e-=2H2O+O2↑②中负极2H++2e-=H2↑
D.溶液的pH变化:①减小②增大
14.在密闭容中发生下列反应aA(g)![]() cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
A.A的转化率变大 B.平衡向正反应方向移动
C.D的体积分数变大 D.a < c+d
15.下列关于热化学反应的描述中正确的是 ( )
A.已知H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,则:
2H+(aq)+SO(aq)+Ba2+(aq)+2OH-(aq)===BaSO4(s)+2H2O(l) ΔH=-114.6 kJ·mol-1
B.燃料电池中将甲醇蒸气转化为氢气的热化学方程式是:
CH3OH(g)+O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1,
则CH3OH(g)的燃烧热为192.9 kJ·mol-1
C.H2(g)的燃烧热是285.8 kJ·mol-1,则2H2O(g)===2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1
D.葡萄糖的燃烧热是2 800 kJ·mol-1,则
C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(l) ΔH=-1 400 kJ·mol-1
16.已知:①C(s)+O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
②C(s)+O2(g)===CO2(g) ΔH=-393.51 kJ·mol-1
计算反应C(s)+CO2(g)===2CO(g)的反应热ΔH的值为( )
A.-283.01 kJ·mol-1 B.+172.51 kJ·mol-1
C.+283.1 kJ·mol-1 D.+504.00 kJ·mol-1
17、 有关下列电化学装置的说法中正确的是( )

A.图a是原电池装置,可以实现化学能转化为电能
B.图b电解一段时间后,加入适量CuO固体,可以使硫酸铜溶液恢复到原浓度
C.图c中的X极若为负极,则该装置可实现粗铜的精炼
D.图d中若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀
18、对于可逆反应mA(g)+nB(g)![]() pC(s)+qD(g)反应过程中,其他条件不变时,产物D的质量分数D%与温度T或压强P的关系如图所示,请判断下列说法正确的是( )。
pC(s)+qD(g)反应过程中,其他条件不变时,产物D的质量分数D%与温度T或压强P的关系如图所示,请判断下列说法正确的是( )。
A.降温,化学平衡向正反应方向移动
B.使用催化剂可使D%有所增加
C.化学方程式中气体的化学计量数m+n>q
D.B的颗粒越小,正反应速率越快,有利于平衡向正反应方向移动

19、25℃,101kPa时,使1.0 g钠与足量氯气反应,生成氯化钠晶体并放出17.87kJ的热量,生成1 mo NaCl的反应热为( )
A、17.87kJ B、—17.87kJ/mol C、411 kJ/mol D、—411 kJ/mol
20、将 4 mol A 气体和 2 mol B 气体在 2 L 的容器中混合并在一定条件下发生如下反应:
2A(g)+B(g)=2C(g)若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1,现有下列几种说法正确的是( )
①用物质 A 表示的反应的平均速率为 0.3 mol·L-1·s-1
② 用物质 B 表示的反应的平均速率为 0.6 mol·L-1·s-1
③ 2 s 时物质 B 的浓度为 0.7 mol·L-1
④2 s 时物质 A 的转化率为70%
A.①③ B. ①④ C. ②③ D. ③④
21、现有下列热化学方程式:
①C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
②2CO(g)+O2(g)===2CO2(g) ΔH2=-566 kJ·mol-1
③CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH3=-890 kJ·mol-1
④CH3CH2OH(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH4=-1 367 kJ·mol-1
下列说法正确的是________。
A.CO(g)的燃烧热比C(s)的燃烧热大
B.ΔH4>ΔH3>ΔH2>ΔH1
C.CO(g)具有的能量比CO2(g)高
D.1 mol C2H5OH蒸气完全燃烧生成CO2和液态水,放出大于1 367 kJ的热量
第Ⅱ卷(非选择题 共58分)
22、(14分)请回答下列问题:
(1)下表列出了一些化学键的键能E:
| 化学键 | H—H | O===O | O—H |
| E/kJ·mol-1 | 436 | x | 463 |
反应H2(g)+O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1,则x=__________。
(2)铅蓄电池是正极板上覆盖有PbO2,负极板上覆盖有Pb,电解质溶液是H2SO4溶液,电池放电时的总反应:Pb+PbO2+2H2SO4=2PbSO4+2H2O。
请写出充电时阴极的电极反应式:
(3)反应m A+n B![]() p C,在某温度下达到平衡。
p C,在某温度下达到平衡。
①若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的关系是_______。
②若C为气体,且m + n = p,在加压时化学平衡发生移动,则平衡必定向_______方向移动。
③若再升高温度,平衡向逆向移动,则正反应为 反应(填“吸热”或“放热”)
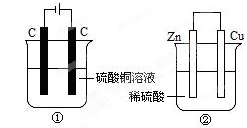
(4)依据氧化还原反应Zn(s)+Cu2+(aq)===Zn2+(aq)+Cu(s)设计的原电池如图所示。
①请在图中标出电极材料及电解质溶液(写化学式)


②盐桥中的Cl-向________极移动(填“左”或“右”)。
23.(12分)硫及其化合物在工业生产中有重要的应用,它们性质的研究对工业生产有重要的指导意义。
(1)2SO2(g)+O2(g)![]() 2SO3(g),反应过程的能量变化如图所示。
2SO3(g),反应过程的能量变化如图所示。
已知1 mol SO2(g)氧化为1 mol SO3(g)放出的热量为99 kJ。请回答下列问题:
①图中E表示_________,E的大小对该反应的反应热有无影响?___________。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?____________,理由是_____________;
②图中ΔH=________kJ·mol-1;
(2)下图表示在密闭容器中反应2SO2+O2![]() 2SO3达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况。
2SO3达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况。
①a b过程中改变的条件可能是 ;
②b c过程中改变的条件可能是 ;
③若增大压强时,反应速率变化情况画在c~d处。
24、(16分)如图所示装置,回答下列问题:

a、b、c、e、f均为石墨电极,甲、乙、丙三个烧杯依次分别盛放足量的NaOH溶液、足量的CuSO4溶液和足量含有酚酞的K2SO4溶液.
(1)通电进行电解,发现丙中f极先变红色。
①直流电源的M极是 (填“正极”或“负极”)
②请写出甲池a 电极上的电极反应式:
③甲池电解过程中溶液的pH (填“增大”或“减小”),原因是:
④如果导线中通过4mol电子,则丙中溶液质量 (填“增大”或“减小”) g
(2)若用丙装置在铁上镀铜,需要将丙装置进行改装,则e应该是 (填“铁”或“铜”),电镀液是 溶液,电镀过程中电镀液的浓度 (填“增大”、“减小”或“不变”)。
(3)若用丙装置对铁的腐蚀进行防护, (填e或f)为铁电极,该防护方法称为
25、(16分)甲醇(CH3OH)是一种重要的化工原料,也是一种比较理想的燃料。甲醇在各个领域有着广泛的应用。
(1)实验测得:32 g甲醇在氧气中完全燃烧,生成二氧化碳气体和液态水时释放出726.4 kJ的热量,试写出甲醇燃烧的热化学方程式:_______________________________________。
(2)燃料电池是一种连续地将燃料和氧化剂的化学能直接转换成电能的化学电池。下图是一个化学过程的示意图。2CH3OH+3O2+4KOH![]() K2CO3+6H2O
K2CO3+6H2O

①A(石墨)电极的名称是 。
②通入O2的电极的电极反应式是
③写出通入CH3OH的电极的电极反应式是 。
④乙池中反应的化学方程式为 。
⑤当电路中通过0.01mol电子时,丙池溶液的C(H+) = mol/L(忽略电解过程中溶液体积的变化)。
(3)合成甲醇的主要反应是:2H2(g)+ CO(g)![]() CH3OH(g) △H=—90.8 kJ·mol—1。
CH3OH(g) △H=—90.8 kJ·mol—1。
①在恒温恒容条件下,充入一定量的H2和CO,发生反应2H2(g)+ CO(g)![]() CH3OH(g)。则该反应达到平衡状态的标志有
CH3OH(g)。则该反应达到平衡状态的标志有
a.混合气体的密度保持不变 b.混合气体的总压强保持不变
c.CO的质量分数保持不变 d.甲醇的浓度保持不变
e.v正(H2)= v逆(CH3OH) f.v(CO)= v(CH3OH)
②要提高反应2H2(g)+ CO(g)![]() CH3OH(g)中CO的转化率,可以采取的措施是:
CH3OH(g)中CO的转化率,可以采取的措施是:
a.升温 b.加入催化剂 c.增加CO的浓度
d.加入H2 e.加入惰性气体 f.分离出甲醇
大庆铁人中学2015—2016年度第一学期高二阶段性检测
化学试题 参考答案
第Ⅰ卷(选择题 共42分)
一、选择题(本题共20小题,每小题只有一个选项最符合题意,每小题2分,共40分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | |
| D | B | A | C | D | B | C | B | B | A | |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 |
| A | C | D | D | D | B | B | A | D | A | D |
第Ⅱ卷(非选择题 共58分)
22、每空2分,共14分
(1)496.4
(2)PbSO4+2e—=Pb+SO42—
(3)①m+n>p
②逆向(或左)
③放热
(4)
①

②左
23.(1)①每空1分,其余每空2分,共12分
(1)①(正反应)活化能,无影响,降低,催化剂能改变反应路径,使反应所需的活化能降低;
②—198;
(2)①升高温度
②降低产物(SO3)浓度
③

24、(16分)
(1)①正极(1分)
②4OH——4e—=2H2O+O2↑(2分)
③增大;甲池电解水,c(NaOH)增大,pH增大(每空2分)
④减小(2分);36(每空2分)
(2)铜,CuSO4(或硫酸铜),不变(每空1分)
(3)f,外加电流的阴极保护法(每空1分)
25、每空2分,共16分
(1)2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=—1452.8 kJ·mol—1
(2)①阳
②2H2O+O2+4e—=4OH—
③CH3OH—6 e—+8OH—=CO32—+6H2O
④4AgNO3+2H2O![]() 4Ag+O2↑+4HNO3(反应条件1分)
4Ag+O2↑+4HNO3(反应条件1分)
⑤0.1
(3)①bcd ②df