湖南省醴陵二中、醴陵四中2016-2017学年高二下学期期中联考化学试卷
03月05日

第I卷 (选择题)
一、选择题:每小题6分。在每小题给出的四个选项中,只有一项是符合题目要求的。
7.下列说法正确的是
A.液态植物油通过催化加氢可制得人造奶油
B.饱和(NH4)2SO4溶液可使蛋白质变形
C.淀粉和蛋白质的组成元素相同
D.石蜡油经分馏可以获得乙烯
8.下列离子组一定能大量共存的是
A.甲基橙呈红色的溶液中:Fe2+ 、Cl-、NO3-、Na+
B.石蕊呈蓝色的溶液中:K+、AlO2-、SiO32-、HSO3-
C.含大量Al3+的溶液中:K+、Ca2+、NO3-、HCO3-
D.含大量OH一的溶液中:CO32-、ClO3-、F-、K+
9分子式为C6H12O2,属于酯类,且能发生银镜反应的同分异构体有
A.8种 B.9种 C.10种 D.11种
10.设NA为阿伏加德罗常数,下列叙述正确的是
A.红磷在氯气中反应,1mol红磷失去的电子数一定为5NA
B.标准状况下22.4L C3H8中含中子数为18NA
C.1L 1mol/L的葡萄糖溶液中,含有的分子数为NA个
D.常温下78 g过氧化钠和122 g水混合,所得溶液质量分数为40%
11.将10.8 g 金属铝投入到400mL 2.0 mol/L的某溶液中有氢气产生,充分反应后有金属剩余,则该溶液可能为
A.HNO3溶液 B.Ba(OH)2溶液 C.H2SO4溶液 D.HCl溶液
12.在反应“X+酸→化合物+H2O”中,反应条件已省去,X不可能是
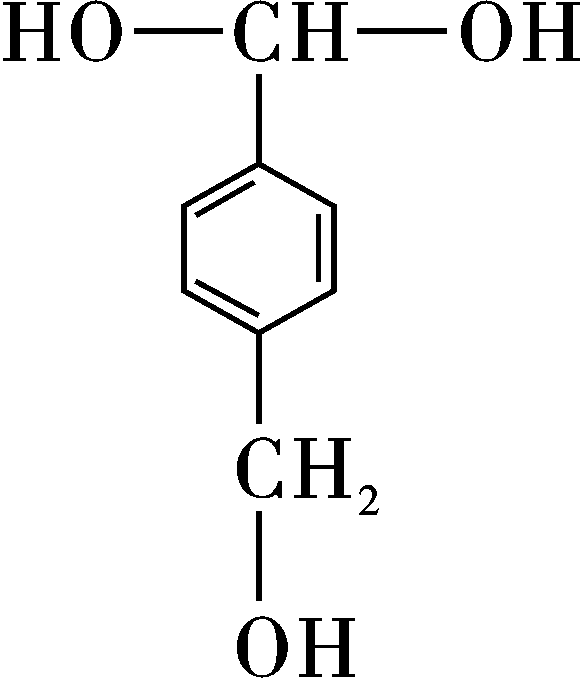
A.CuO B.NaCl C.SiO2 D. ![]()
13.仅用下表提供的玻璃仪器(非玻璃仪器任选)就能实现相应实验目的的是
| 选项 | 实验目的 | 玻璃仪器 |
| A | 分离乙醇和乙酸的混合物 | 分液漏斗、烧杯、玻璃棒 |
| B | 用0.10mol/L的盐酸配制 100 mL 0.050mol/的盐酸 | 100 mL容量瓶、烧杯、玻璃棒、胶头滴管 |
| C | 用溴水、淀粉KI溶液比较 Br2和I2的氧化性强弱 | 试管、胶头滴管 |
| D | 用NH4Cl固体和Ca(OH)2固体制备并收集NH3 | 酒精灯、烧杯、导管、集气瓶 |
第II卷( 非选择题 )
26.磷化铝是用红磷和铝粉烧制而成。因杀虫效率高、经济方便而应用广泛。可作粮仓熏蒸的磷化铝片,熏蒸每吨粮食只需3~5片(3.20g/片)。
(1)写出磷化铝的化学式:________;举一例红磷的同素异形体,写出其化学式:________。
(2)磷化铝毒性主要为遇水、酸时则迅速分解,放出吸收很快、毒性剧烈的磷化氢气体,写出磷化铝
和水反应的化学方程式:____________________________________________________________。
(3)磷化氢是一种无色、剧毒、易燃的气体,该气体比空气重并有类似臭鱼的味道,其结构和NH3相似,写出磷化氢的电子式:________;磷化氢具有强的还原性,通入硫酸铜溶液中会生成单质铜和磷酸,写出该反应的离子方程式:___________________________________________。
(4)磷化氢在空气中的最高允许值为0.3ppm,空气中超标的PH3气体可以用重铬酸钾、活性炭、氢碘酸处理,你认为他们的反应原理是否相同,原因是____________________________________。
(5)磷的含氧酸很多,H3PO4是常见的一种,多个磷酸分子通过脱水作用由O原子连接而成为多磷酸,三聚磷酸钠(Na5P3O10·6H2O)是常见的多磷酸盐,该盐373K时,可发生如下反应Na5P3O10·6H2O=== Na3HP2O7+X+5H2O,请你推出X的化学式:__________________;并且写出X溶液中离子电荷守恒的等式:________________________________________________________。
27.(14分)可逆反应mA(g)+nB(g)⇌pC(g)+ qD(g)△H=a KJ/mol,反应时间与C%(产物C的体积分数)函数关系如图13所示。
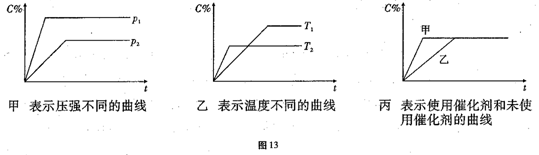
(1)据上述信息试比较下列大小关系:P1_______ P2,T1_______T2,△H_____0,△S_____0(增色填“﹥”“﹤”或“=”),图丙中使用催化剂的是_______反应线。
(2)该反应在_______(填“高温”或“低温”)下能自发进行。
(3)当该反应在两个体积相等的恒容密闭容器中进行反应时,如图14:
丁:放入4molA、4molB
丙:放入2molA、2molB
图14
请分析丙容器和丁容器达到平衡时C%(产物C的体积分数)是否可能相等,_____ (填“能”或“不能”),其原因是_____ _____ _____ 。
(4)假设第(3)问中,图中物质的量不变,在相同温度下达到平衡时丁中A、B的浓度分别是丙中A、B的浓度的ω倍,求m:n的值为 。
28.(15分)硫酸铵是常见的化肥,是强酸弱碱盐,室温下,可用酸碱滴定法测定其氮元素的含量,但由于NH4+的酸性太弱(Ka=5.6×10-10),直接用NaOH标准溶液滴定有困难,生产和实验室中广泛采用甲醛法测定铵盐中的含氮量。甲醛法是基于甲醛与一定量铵盐作用,生成酸(H+)和六次甲基四铵盐(Ka=7.1×10-6)反应如下:4NH4++ 6HCHO====(CH2)6N4H++ 6H2O+ 3H+,生成物可用酚酞为指示剂,用NaOH标准溶液滴定[在室温下(25℃),通常Ka表示弱酸的电离平衡常数,Kb表示弱碱的电离平衡常数]。硫酸铵含氮量的
测定步骤如下:
①准确称取1.800g (NH4)2SO4于烧杯中。
②用适量蒸馏水溶解,然后定量地移至250mL容量瓶中,并用蒸馏水稀释至刻度,摇匀备用。
③用移液管移取试液25mL于锥形瓶中,加入8mL 1:1的甲醛溶液,再加入1~2滴酚酞指示剂摇匀,静置
一分钟后,用0.100 mol/L NaOH标准溶液滴定至溶液呈浅红色持续半分钟不褪色,即为终点。
④记录读数,平行做2~3次,NaOH标准溶液滴定消耗的平均体积为27.00mL。
根据实验回答下列问题:
(1)硫酸铵水溶液呈酸性的原因是__________________________________。(用离子方程式说明)
(2)步骤①称取硫酸铵固体样品是否能使用托盘天平______________(填“是”或“否”)。
(3)步骤③加入的甲醛溶液使用前需要加入一定量的NaOH,原因是________________________。
(4)NH4NO3中氮的百分含量是否能用该方法测定______________(填“是”或“否”)。原因是
_________________________________。
(5)据题目给出的信息计算样品中氮的百分含量为_________________ ____。
(6)若室温下,C mol/L氨水的电离平衡常数为Kb,则该氨水的电离度a=_________ ____。(用C
和Kb表示),由此在恒定温度下,你能得出的结论为_________________ ____。
36.【化学——选修2:化学与技术】(15分)
淡水是一种重要的自然资源,是人类赖以生存不可缺少的物质。按要求回答下列问题:
(1)水质优劣直接影响人体健康。天然水在净化处理过程中加入的混凝剂可以是______________(填 一种物质的名称),其净水作用的原理是_________________________ ____。混凝剂难以清除溶解于水中的有机物、无机物、微生物,混凝剂沉淀后还需要_____________。
(2)硬水的软化指的是_________________________ ____________________________ ___。
(3)硬度为1°的水是指每升水含10mg CaO或与之相当的物质(如7.1mg MgO)。若某天然水中c(Ca2+)=1.2×10-3mol/L,c(Mg2+)=6×10-4mol/L,则此水的硬度为_____________。
(4)若(3)中的天然水还含有c(HCO3-)=8×10-4mol/L,现要软化10m3这种天然水,则需先加入Ca(OH)2____________g, 后加入Na2CO3___________g 。
(5)如图21是电渗析法淡化海水的原理图,其中,电极A接直流电源的正极,电极B接直流电源的负极。
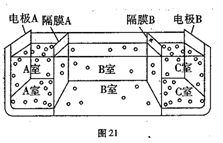
①隔膜A是_________(填“阴”或“阳”)离子交换膜。
②某种海水样品,经分析含有大量的Na+、Cl-,以及少量的K+、SO42-。若用上述装置对该海水进行淡化,当淡化工作完成后,A、B、C三室中所得溶液(或液体)的pH分别为pHa、pHb、pHc,则其大小顺序为
________________________。
37.【化学——选修3:物质结构与性质】(15分)
已知A、B、C、D四种短周期元素,它们的核电荷数依次增大。A、C原子的L能层中都有两个未成对的电子,C、D同主族。E、F都是第四周期元素,E原子核外有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满。根据以上信息填空:
(1)基态E原子中,电子占据的最高能层符号为______________,该能层具有的原子轨道数为___________。
(2)E3+离子的价层电子排布式为______________。
(3)DCl2中D原子采取的轨道杂化方式为_____________,C元素的气态氢化物的VSEPR模型名称为__________________________。
(4)写出一个与DAB-离子互为等电子体的合理分子式:__________________________。
(6)已知F的晶体结构为面心立方,F的原子直径d= 0.256nm,求1cm3 F中,含有F原子的个数约为
_______________个。(保留3位有效数字)()
38.【化学——选修5:有机化学基础】(15分)
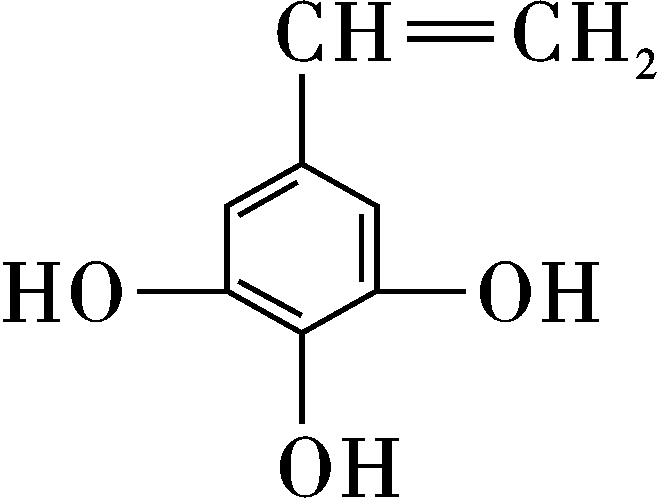
图22是某课题组设计的合成聚酯类高分子材料![]() 的路线:
的路线:
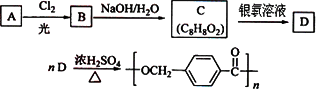
图22
已知:①烃A的相对分子质量为106;
②同一碳原子上连两个羟基时结构不稳定,易脱水生成醛或酮: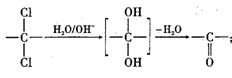
③C可发生银镜反应。
请根据以上信息回答下列问题:
(1)A的结构简式为______________________。
(2)由A生成B的反应类型是________;由C生成D的反应类型是________。
(3)由B生成C的化学方程式为________________________________________________________,该反应过程中生成的不稳定中间体的结构简式应是________________________________________。
(4)D的分子式为________;D的同分异构体中,满足下列条件的有______________种。
①仅含有苯环,无其他环状结构;
②遇三氯化铁溶液显紫色;
③1mol能与3mol金属钠反应生成1.5mol氢气。
其中核磁共振氢谱表明分子中有四种氢,且其峰面积之比为3:2:2:1,请写出其结构简式:________。
第Ⅰ卷(选择题)
一、选择题:每小题6分。
| 题号 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 | A | D | A | B | D | B | C |
第Ⅱ卷(非选择题)
26.(除特殊标注外,每空2分,共14分)
(1)AlP(1分) P4(1分)
(2)AlP + 3H2O=Al(OH)3+ PH3↑
(3)![]() PH3 + 4Cu2+ + 4H2O=8H++H3PO4 + 4Cu↓
PH3 + 4Cu2+ + 4H2O=8H++H3PO4 + 4Cu↓
(4)不同,重铬酸钾和PH3是氧化还原反应,活性炭是吸附能力,HI和PH3是化合反应生成PH4I
(5)Na2HPO4 c(Na+)+ c(H+)= 2c(HPO)+ c(H2PO)+ 3c(PO)+ c(OH-)
27.(除特殊标注外,每空1分,共14分)
(1)>< < < 甲
(2)低温(2分)
(3)能(2分) 平衡在不同温度下建立(合理答案均给分)(3分)
(4)1(2分)
28.(除特殊标注外,每空2分,共15分)
(1)NH + H2O====NH3·H2O + H+
(2)否
(3)少量甲醛被空气中的氧气氧化为甲酸,需加碱中和
(4)是 因为NH4NO3中NO离子虽然没有反应,但可以通过NH∶NO 为1∶1计算N的百分含量
(5)21%
(6)![]() 温度恒定,加水稀释溶液时,Kb不变,电离度增大(1分)(其他合理答案均给分)
温度恒定,加水稀释溶液时,Kb不变,电离度增大(1分)(其他合理答案均给分)
36.(除特殊标注外,每空2分,共15分)
(1)明矾,硫酸铝,硫酸铁,硫酸亚铁(填其中任意一种)(1分) 铝盐或铁盐在水中发生水解反应生成相应的氢氧化物胶体,它可吸附天然水中的悬浮物并破坏天然水中的其他带异电的胶体,使其聚沉达到净水的目的 消毒、杀菌(1分)
(2)除去或减少水中的Ca2+、Mg2+等的过程
(3)10°
(4)740 1484
(5)①阴(1分) ②pHa 37.(除特殊标注外,每空2分,共15分) 38.(除特殊标注外,每空2分,共15分) (1) (2)取代反应 氧化反应 (3) (4)C8H8O3 6 
![]() (1分)
(1分)![]()