
湖南省醴陵二中、醴陵四中2016-2017学年高二下学期期中联考化学试卷
03月05日
石嘴山市第三中学2018届高三12月月考
化 学 试 题
相对原子质量 H—1 Al—27 Cu—64 O—16 N—14 Cl—35.5
一、选择题:(本题共17小题,每小题3分,只有一项符合题目要求。)
1、化学是与社会、环境等密切相关。下列有关说法中正确的是( )
B.人造纤维、合成橡胶和光导纤维都属于有机高分子化合物
C.LED光源中的氮化镓(GaN)熔点为1700℃,属分子晶体
D.甲型H1N1流感病毒的蛋白质由C、H、O三种元素组成
2、2010年2月19日IUPAC(国际纯粹与应用化学联合会)宣布,第112号化学元素正式名称为“Copernicium”,元素符号为“Cn”,以纪念著名天文学家哥白尼,该元素的一种核素含有的中子数为165。下列关于Cn说法不正确的是( )
A.Cn是金属元素 B.Cn是过渡元素
C.Cn原子的最外电子层为Q层 D.Cn元素的相对原子质量为277
3、清代赵学敏《本草纲目拾遗》中关于“鼻冲水”的记载明确指出:“鼻冲水,出西洋,……贮以玻璃瓶,紧塞其口,勿使泄气,则药力不减……惟以此水瓶口对鼻吸其气,即遍身麻颤出汗而愈。虚弱者忌之。宜外用,勿服。”这里的“鼻冲水”是稀硫酸、氢氟酸溶液、氨水、醋酸溶液中的一种。下列有关“鼻冲水”的推断正确的是( )
A.“鼻冲水”滴入酚酞溶液中,溶液不变色 B.“鼻冲水”中含有5种粒子
C.“鼻冲水”是弱电解质 D.“鼻冲水”不能使二氧化硅溶解
4、用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. 在密闭容器中充入1.5molH2和0.5 molN2,充分反应后可得到NH3的分子数为NA
B. 常温常压下,Na2O2与足量H2O反应,生成4.48LO2,转移电子的数目为0.2NA
C. 在1L0.1mol/L的硫化钠溶液中,阴离子总数大于0.1NA
D.电解精炼铜的过程中,电路中每通过NA个电子,阳极溶解铜32g
5、常温下,下列各组离子或分子组能大量共存且满足相应要求的是( )
| 选项 | 离子 | 要求 |
| A | K+、AlO2-、Cl-、MnO4- | C(K+)< C(Cl-) |
| B | Fe3+、NO3-、I-、HCO3- | 逐滴加入盐酸立即有气体产生 |
| C | NH4+、Al3+、SO42-、H+ | 逐滴加入NaOH溶液立即有气体产生 |
| D | Na+、Cu2+、Cl-、SO42- | 逐滴加氨水先有沉淀产生,后沉淀消失 |
6、下列有关离子方程式正确的是( )
A.将氟气通入水中:F2+H2O==H++F++HFO
B.将磁性氧化铁溶于盐酸:Fe3O4+8H+==2Fe3++Fe2++4H2O
C.硝酸银溶液中滴加过量氨水:Ag++NH3·H2O==AgOH ↓+NH4+
D.往KAl(SO4)2溶液中滴入Ba(OH)2溶液至沉淀的物质的量最大Al3++2SO42-+2Ba2++4OH-==AlO2-+2BaSO4↓+2H2O
7、如图R、W、X、Y、Z为五种物质,若箭头表示能一步转化的常见反应,则其中常温下能实现图示转化关系的是( )
| 选项 | R | W | X | Y | Z | 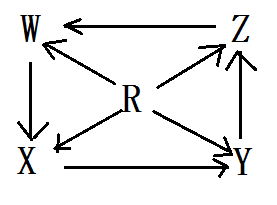 |
| A | Si | SiO2 | H2SiO2 | Na2SiO2 | SiCl4 | |
| B | Na | Na2O | Na2O2 | Na2CO3 | NaOH | |
| C | Fe | Fe(OH)2 | FeCl2 | FeCl3 | Fe(NO3)3 | |
| D | Al | NaAlO2 | Al2(SO4)3 | AlCl3 | Al(NO3)3 |
8、利用如图所示装置进行下列实验,实验现象与结论均正确的是( )
| a | b | c | 实验现象 | 实验结论 | |
| A | 浓氨水 | 碱石灰 | FeCl2溶液 | 产生白色沉淀,迅速变为灰绿色,最后变为红褐色 | 氨气具有氧化性 |
| B | 稀硫酸 | FeS | AgCl悬浊液 | 悬浊液由白色变为黑色 | Ksp(AgCl)>Ksp(FeS) |
| C | 浓硝酸 | 铜 | BaSO3悬浊液 | 悬浊液变澄清 | +4价硫具有还原性 |
| D | 浓盐酸 | KMnO4 | 紫色石蕊试液 | 溶液先变红后褪色 | Cl2有酸性和漂白性 |
9、用下列实验装置进行相应实验,能达到实验目的的是( )


A.用图1所示装置除去Cl2中含有的少量HCl
B.用图2所尔装置蒸干NH4Cl饱和溶液制备NH4Cl晶体.
C.用图3所示装置取少量纯净的CO2气体
D.用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层
10、某酸性废水可能含有Fe2+、Fe3+、Al3+、Mg2+、Na+、K+、CO32-、SO42-。取废水样品分别进行如图所示①~④四个实验。下列推断正确的是( )

A.废水含有Na+,不含K+B.废水含有SO42-和CO32-
C.废水不含Fe3+,可能含Fe2+D.废水一定含有Na+、Al3+、SO42-
11、LiAlH是重要的储氢材料,其组成类似于Na3AlF6,常见的供氢原理如下面两个方程式所示:①![]()
![]()
![]() ,②
,②![]()
![]() .下列说法正确的是( )
.下列说法正确的是( )
A.若反应①中生成3.36![]() 氢气,则一定有2.7g铝生成
氢气,则一定有2.7g铝生成
B. 生成等质量的氢气,反应①、②转移电子数之比为4:3
C. 氢化锂也是一种储氢材料,供氢原理为![]()
![]()
D.![]() 是共价化合物,
是共价化合物,![]() 是离子化合物
是离子化合物
12、短周期主族元素,、![]() 、、
、、![]() 的原子序数依次增大。四种元素形成的单质依次为、、
的原子序数依次增大。四种元素形成的单质依次为、、![]() 、
、![]() 时;、
时;、![]() 、是这些元素组成的二元化合物,其中为形成酸雨的主要物质之一;25℃,
、是这些元素组成的二元化合物,其中为形成酸雨的主要物质之一;25℃,
 0.01mol/L W溶液中,
0.01mol/L W溶液中,![]() 。上述物质的转化关系如图所示。下列说法正确的是( )
。上述物质的转化关系如图所示。下列说法正确的是( )
A.原子半径的大小:![]()
B.氢化物的沸点:![]()
C.的电子式为:![]() D.
D.![]() 、含有的化学键类型完全相同
、含有的化学键类型完全相同
13、铁氧体(Fe3O4)法是处理含铬废水的常用方法,其原理是:用FeSO4把废水中Cr2O72-还原为Cr3+,并通过调节废水的PH,使生成物组成符合类似于铁氧体(Fe3O4或Fe2O3·FeO)的复合氧化物(![]() ).处理含1mol Cr2O72-废水至少需要加入molFeSO4·7H2O。下列结论正确的是( )
).处理含1mol Cr2O72-废水至少需要加入molFeSO4·7H2O。下列结论正确的是( )
A.x=0.5,a=10 B. x=1,a=5 C. x=2,a=10 D. x=0.5,a=8
14、下列实验设计能够成功的是( )
A.检验亚硫酸钠试样是否变质:试样![]()
![]() 白色沉淀
白色沉淀![]() 沉淀不溶
沉淀不溶
B.从氧化铝、二氧化硅混合物中提取氧化铝:氧化铝(二氧化硅)![]() 铝离子溶液
铝离子溶液![]() 氢氧化铝
氢氧化铝![]() 氧化铝
氧化铝
C.除去氯化钠晶体中少量硝酸钾:试样![]()
![]()
![]()
![]() 再重结晶
再重结晶
D.从含有Ca2+、SO42的粗盐中提取NaCl:粗盐水![]()
![]() 滤液
滤液![]() 氯化钠溶液
氯化钠溶液
 15、在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)的关系如下图所示。下列叙述错误的是( )
15、在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)的关系如下图所示。下列叙述错误的是( )
A.与![]() 的差值为0.01mol
的差值为0.01mol
B.原溶液中C(Cl-)=0. 85mol/L
C. 原溶液的C(H+)=0.1mol/L
D.原溶液中n(Mg2+):n(Al3+)=5:1
16、A、B、C、D、E五种短周期元素,其中A是地壳中含量最多的元素;C元素的单质存在于火山喷发口附近或地壳的岩层里;E原子的电子总数等于其电子层数的3倍;D的一种原子核中没有中子; A、B、C三种元素的族序数之和为16。下列说法错误的是( )
A.D与E可形成既含极性键又含非极性键的分子
B. B、C、E三种元素的最高价氧化物对应的水化物中,B的酸性最弱
C. B的最高价氧化物为酸性氧化物,不能与任何酸反应
D.A、C、D中两种或三种元素形成的钠盐溶液可显酸性、中性或碱性
17、向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5![]() ,固体物质完全反应,生成NO和Cu(NO3)2。在所得溶液中加入1.0mol/L的NaOH溶液1.0
,固体物质完全反应,生成NO和Cu(NO3)2。在所得溶液中加入1.0mol/L的NaOH溶液1.0![]() ,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是( )
,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是( )
A.Cu和Cu2O的物质的量之比为2:1 B.硝酸的物质的量浓度为2.6mol/L
C.产生的NO在标准状况下的体积为4.48![]() D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol
D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol
二、填空题(共69分)
18、(6分) (1)W和焦炭在高温下发生反应,所制得的半导体材料应用广泛.请写出该反应的化学方程式: .
(2)若取两支试管分别加入少量X溶液,往一支试管中滴入KSCN溶液,无明显现象.
往另一支试管中加入足量氯水,再加入适量CCl4,振荡,静置,下层溶液呈紫红色;往上层溶液中滴入KSCN溶液,溶液呈红色.
② 上述实验中,X与足量氯水反应的离子方程式为: .
(3)若Z是产生光化学烟雾主要气体之一,其溶于水能生成一种一元强酸.
①请写出Z溶于水的化学方程式: .
②该气体Z可用氢氧化钠溶液来处理,请写出该反应的离子方程式: .
(4)管道工人曾经用浓氨水检验氯气管道是否漏气,如果管道某处漏气,会出现白烟现象,写出对应的化学方程式 .
19、(10分)已知①~⑩号元素在周期表中的位置如图。试回答下列问题:

(1)上述元素中属于d区的有:________(填编号)。
(2)②、③、④三种元素的第一电离能由大到小的顺序为_______________(用元素符号表示)。
(3)写出由①、④两种元素组成的原子个数比为1:1的分子的电子式:_____________________。
(4)⑧号元素在元素周期表中的位置是___________,⑩号原子处于基态时核外电子排布式为__________________,已知元素⑩和⑦的电负性分别为1.9和2.5,则⑩与⑦形成的化合物属于________(填“离子”或“共价”)化合物。
(5)③号元素原子与①号元素原子形成的原子个数比为1∶3的分子X的空间构型为________,X在①与④形成的化合物Y中的溶解度很大,其主要原因是_____________________,X分子中中心原子为________杂化,X分子与⑩号元素对应的二价阳离子形成的配离子的化学式为______________。
20、(5分)某溶液中仅含有下表中的一些离子(不考虑水的电离和离子的水解)
| 阳离子 | Na+Mg2+Fe2+Al3+Fe3+ |
| 阴离子 | OH﹣Cl﹣CO32﹣NO3﹣SO42﹣ |
为鉴定这些离子,取少量溶液加入稀HCl,有无色气体生成.该气体遇空气变为红棕色,且溶液中阴离子的种类不变;
(1)通过分析该实验,能确定溶液中一定存在的离子是 .一定不存在的离子是 .
(2)写出实验中发生的离子方程式 .
(3)通过对实验的分析,尚不能确定溶液中是否存在的阴离子是 ,如何进一步鉴别该离子是否存在 .
21、(9分)黄铁矿既是硫矿又是铁矿,因其呈黄色俗称“愚人金”,是重要的工业原料.工业煅烧过程中常产生废渣,废渣成分主要含铁的几种氧化物和二氧化硅等,利用该废渣可以制备高效净水剂聚合硫酸铁,工艺流程如图:

(1)检验“酸溶”后的溶液中含有Fe2+,试剂是 .
(2)硫铁矿烧渣在“酸溶”前要粉碎的主要目的是 .
(3)“操作Ⅲ”系统操作名称依次为 、 、过滤和洗涤.
(4) 加入适量H2O2的目的是氧化Fe2+,写出H2O2氧化Fe2+的离子方程式: .
II.【测定![]() 含量】
含量】
(1)称取上述样品 10.0g,溶于适量的稀硫酸中,配成 100mL 溶液,需要的仪器除天平、胶头滴管、 烧杯、量筒外,还需要的仪器有(填仪器名称)_______、________。
(2)准确量取 25mL 该液体于锥形瓶中,用 0.1000mol/L ![]() 标准溶液滴定,则滴定终点的判断方法是______________________________________________。
标准溶液滴定,则滴定终点的判断方法是______________________________________________。
(3)若定容时俯视读数,则测量结果会____________(填“偏大”或“偏小”“无影响”)。
22、(12分)(I)SO2气体为无色气体,有强烈刺激性气味,大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2,可以使用的药品和装置如下图所示:

(1)若要从FeCl3溶液中提取晶体,在必须进行的实验操作步骤中,没有用到的玻璃仪器有________________(填字母)。
a.酒精灯 b.烧瓶 c.漏斗 d.烧杯 e.玻璃棒
(2) 装置A中的现象是__________________________,写出B中发生反应的离子
方程式:______________________________。
(3)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,取A中的溶液,分成两份,并设计了如下试验
方案①:向第一份溶液中加入少量酸性KMnO4溶液,紫红色褪去。
方案②:向第二份溶液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
上述方案中不合理的是_______________(填序号)。
(Ⅱ)SO2溶于水生成亚硫酸,亚硫酸的酸性强于次氯酸。选择下面的装置和药品来探究亚硫酸与次氯酸的酸性强弱。


(4)装置正确的连接顺序为A、__________、D、F,其中装置B的作用是_________。证明亚硫酸的酸性强于次氯酸的现象为_________________________。
(Ⅲ)某同学对SO2与漂粉精的反应进行了实验探究。
| 操作 | 现象 |
| 取4 g漂粉精固体,加入100 mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
 | ①溶液出现浑浊,并变为黄绿色 ②稍后,产生大量白色沉淀,黄绿色褪去 |
(5)C12和Ca(OH)2反应制取漂粉精的化学方程式是__________________________________。
(6)pH试纸颜色的变化说明漂粉精溶液具有的性质是________________________________。
(7)现象①中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分ClO-和Cl-发生反应。写出漂粉精在酸性条件下发生反应的离子方程式:_______________________。
23、(9分)氮化镁(Mg3N2)在工业上具有非常广泛的应用。某化学兴趣小组用镁与氮气反应制备Mg3N2并进行有关实验。实验装置如下所示:

已知:①氮化镁常温下为浅黄色粉末,极易与水反应。
②亚硝酸钠和氯化铵制取氮气的反应剧烈放热,产生氮气的速度较快。
③温度较高时,亚硝酸钠会分解产生O2等。
回答下列问题:
(1)仪器b的名称是________,写出装置A中发生反应的化学方程式___________________。
(2)某同学检验装置A部分的气密性,关闭止水夹c后,开启活塞a,水不断往下滴,直至全部流入烧瓶。试判断:A部分装置是否漏气?________(填“漏气”、“不漏气”或“无法确定”),判断理由:_____________________ ________。
(3)装置C中为饱和硫酸亚铁溶液,作用是___________,F装置的作用是_______________。
(4)加热至反应开始发生,需移走A处酒精灯,原因是________________________________。
(5)反应结束后,取m g E中样品于试管中,加足量蒸馏水,得V mL气体(换算为标准状况),则样品中氮化镁的质量分数为__________________。
24、(11分)二氧化氯(ClO2)气体是一种常用高效的自来水消毒剂.
(1)KC1O3和浓盐酸在一定温度下反应会生成ClO2,反应方程为2KClO3十4HCl(浓)═2KCl+2ClO2↑+Cl2↑+2H2O,浓盐酸在该反应中表现出的性质是 .
(2)实验室常用KClO3.草酸(H2C2O4)和稀硫酸制备C1O2.该反应中氧化产物与还原产物物质的量之比为
(3)将ClO2通入到硫化氢溶液中,然后加入少量的稀盐酸酸化的氯化钡溶液,发现有白色沉淀生成.写出二氧化氯与硫化氢溶液反应的离子方程式
(4)C1O2和Cl2在消毒时自身均被还原为Cl﹣,则常温常压下,等体积的C1O2的消毒能力是Cl2的 倍.
(5)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1﹣0.8mg.L﹣1之间.碘量法可
以检测水中ClO2的浓度(不同pH环境中粒子种类如图所示),步骤如下:
 Ⅰ.取一定体积的水样,加入一定量的碘化钾,再将反应后溶液调至中性,并加入淀粉溶液,溶液变蓝.
Ⅰ.取一定体积的水样,加入一定量的碘化钾,再将反应后溶液调至中性,并加入淀粉溶液,溶液变蓝.
Ⅱ.加入一定量的Na2S2O3溶液(己知:2S2O32﹣+I2═SO+2I﹣)
Ⅲ.加硫酸调节水样pH至1﹣3.
请问答:
①作I中反应的离子方程式是
②在操作III过程中,溶液又呈蓝色,反应的离子方程式是
③若水样的体积为1.0L,在操作II时消耗了
1.0× 10﹣3mol•L一1,的Na2S2O3溶液10mL.则水样中ClO2的浓度是 mg•L一1.
 25、(7分)东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
25、(7分)东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1). 镍元素基态原子的电子排布式为 ,3![]() 能级上的未成
能级上的未成
对的电子数为 。
(2). 硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是 。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为 ,
提供孤电子对的成键原子是 。
(3). 某镍白铜合金的立方晶胞结构如图所示。
若合金的密度为![]() ,晶胞参数________。(只写计算式)。
,晶胞参数________。(只写计算式)。