
湖南省醴陵二中、醴陵四中2016-2017学年高二下学期期中联考化学试卷
03月05日
广西钦州市钦州港经济技术开发区中学2018届高三化学开学考试
(本试卷满分100分,考试时间90分钟。)
一、选择题
1.列除杂操作可行的是
A、通过浓硫酸除去HCl中的H2O B、通过灼热的CuO除去H2中的CO
C、通过灼热的镁粉除去N2中的O2 D、通过水除去CO中的CO2
2.化学与人类生活、能源开发、资源利用等密切相关。下列说法正确的是 ( )
A.塑料奶瓶比玻璃奶瓶更有利于健康,且更加经久耐用
B.硅燃烧放出的热量多,且燃烧产物对环境污染程度低,可做“未来石油”
C.用K2FeO4取代Cl2处理饮用水,可杀菌消毒,但不能沉降水中的悬浮物
D.研发使用高效催化剂,可提高反应中原料的转化率
3、在氯水中存在多种分子和离子,它们在不同的反应中表现出各自的性质。下列实验现象
和结论一定正确的是 ( )
A.溶液呈黄绿色,且有刺激性气味,说明有Cl2分子存在
B.加入有色布条,一会儿有色布条褪色。说明溶液中有Cl2分子存在
C.加入盐酸酸化,再加入硝酸银溶液产生白色沉淀,说明氯水中有Cl-存在
D.加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在
4.实验室制备下列气体时,所用方法正确的是
A.制氧气时,用Na2O2或H2O2作反应物可选择相同的气体发生装置
B.制氯气时,用饱和NaHCO3溶液和浓硫酸净化气体
C.制乙烯时,用排水法或向上排空气法收集气体
D.制二氧化氮时,用水或NaOH溶液吸收尾气
5.下列叙述正确的是 ( )
A.稀硝酸、稀硫酸均能将木炭氧化成二氧化碳
B.Na2O2与水反应、红热的Fe与水蒸气反应均生成碱
C.Li、C、P分别在足量氧气中燃烧均生成一种相应氧化物
D.CO2、HCl、NH3的水溶液都能导电,它们均属于电解质
6、将二氧化硫通到显红色的酚酞试液中,发现红色消失,主要原因是SO2有 ( )
A.漂白性 B.溶于水显酸性 C.氧化性 D.还原性
7.等质量的下列物质与足量稀硝酸反应,放出NO物质的量最多的是
A.FeO B. Fe2O3 C. FeSO4 D、Fe3O4
8、下列各组原子中,彼此化学性质一定相似的是 ( )
A.原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子
B.原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子
C.最外层都只有一个电子的X、Y原子
D.2p轨道上有一个空轨道的X原子与3p轨道上有一个空轨道的Y原子
9.常温下,下列各组离子在指定溶液中可能大量共存的是 ( )
A.滴入甲基橙显红色的溶液中: Na+、NO3-、I-、SO42-
B.水电离出的c(H+) =10-12mol/L中:K+、AlO2-、CH3COO-、SiO32-
C.c(OH-)/c(H+)=1012的水溶液中:K+、ClO-、S2-、Cl-
D.加入铝粉能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3-
10.下列有关溶液组成的描述合理的是
A.无色溶液中可能大量存在Al3+、NH4+、Cl‾、S2-
B.酸性溶液中可能大量存在Na+、ClO‾、SO42‾、I-
C.弱碱性溶液中可能大量存在Na+、K+、Cl‾、HCO3
D.中性溶液中可能大量存在Fe3+、K+、Cl‾、SO42-
11、将等物质的量的镁和铝混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是 ( )
A.4 mol·L-1 HNO3 B.3 mol·L-1 HCl C.8 mol·L-1 NaOH D.18 mol·L-1 H2SO4
12.下列实验操作合理或能达到实验目的的是 ( )
A.用激光笔检验某KI溶液中是否溶有淀粉
B.配制一定物质的量浓度溶液时,容量瓶用蒸馏水洗涤后再用待装溶液润洗
C.向AgCl沉淀中滴加少量KI溶液,可说明Ksp(AgCl)<Ksp (AgI)
D.配制硫酸亚铁溶液,是将绿矾晶体溶于蒸馏水再加入一定量的铁粉
13.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A.常温常压下,56 g乙烯和丙烯的混合气中含有的碳原子数为4NA
B.1.2 g NaHSO4晶体中含有的阳离子和阴离子的总数为0.03NA
C.12 g金刚石中含有的共价键数为4NA
D.1 mol Fe2+与足量的H2O2溶液反应,转移2NA个电子
14.下列指定反应的离子方程式正确的是
A.Cu溶于稀硝酸HNO3:Cu+2H++NO3-=Cu2++NO2↑+H2O
B.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-=Fe(OH)2↓
C.用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑
D.向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-
15、常温下,下列有关电解质溶液的叙述正确的是 ( )
A.等浓度等体积的强酸与强碱溶液混合后,溶液的pH=7
B.pH=2的盐酸与pH=12的氨水等体积混合后所得溶液显中性
C.pH=10的Ba(OH)2溶液和pH=13的NaOH溶液等体积混合后溶液的pH=10.7(已知lg 2=0.3)
D.将10 mL pH=a的盐酸与100 mL pH=b的Ba(OH)2溶液混合后恰好中和,则a+b=13
第Ⅱ卷 填空题
16.氮化铝(AlN)陶瓷是一种类金刚石氮化物的新型无机非金属材料,最
高可稳定到2200℃.导热性好,热膨胀系数小,是良好的耐热冲击材料.抗熔融金属侵蚀的能力强,是熔铸纯铁、铝或铝合金理想的坩埚材料.制取原理为:Al2O3 + 3C + N2![]() 2AlN + 3CO
2AlN + 3CO
(1)氮化铝的晶体类型为___________。
(2)制取氮化铝要用较为纯净的N2,N2的电子式为____________。实验室中制备少量氮气
的基本原理是:NH4Cl + NaNO2 =NaCl + 2H2O + N2↑。为了得到较纯净的N2,最好的收集方法是____________。
(3)氮化铝抗酸能力极强,但抗碱蚀能力差,它能与氢氧化钠溶液反应生成NaAlO2和能使湿润红色石蕊试纸变蓝的气体,其化学反应方程式为:___________________
(4)工业上制得的AlN中含有Al2O3 、C杂质,取含杂质的粗氮化铝10.00g于某容器,加入足量浓硫酸,加热,收集到672mL气体(已折算成标准状况)。则该粗氮化铝中碳的质量分数为___________
17.CaCO3广泛存在于自然界,是一种重要的化工原料。大理石主要成分为CaCO3,另外有少量的含硫化合物。实验室用大理石和稀盐酸反应制备CO2气体。下列装置可用于CO2气体的提纯和干燥。完成下列填空:
(1)用浓盐酸配制1:1(体积比)的稀盐酸(约6 mol·L-1),需要的玻璃仪器有 ▲
(2)上述装置中,A是 ▲ 溶液,其作用是 ▲ 。
 (3)上述装置中,B物质是 ▲ 。
(3)上述装置中,B物质是 ▲ 。
(4)一次性饭盒中石蜡和CaCO3在食物中的溶出量是评价饭盒质量的指标之一,测定溶出量的主要实验步骤设计如下:剪碎、称重→浸泡溶解→过滤→残渣烘干→冷却、称重→恒重
①从物质分类的角度分析,石蜡属于有机物中的 ▲ 类,为了将石蜡从饭盒中溶出,应选用下列试剂中的 ▲ 。
a.氯化钠溶液 b.稀醋酸 c.稀硫酸 d 正已烷
②饭盒中的碳酸钙常用稀醋酸将其溶出,试写出其反应的离子方程式 ▲ 。
18.某研究小组探究SO2和Fe(NO3)3溶液的反应,其反应装置如下图所示:

已知:1.0 mol·L-1的Fe(NO3)3溶液的pH=1,请回答下列问题:
(1)装置A中反应的化学方程式是
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是
(3)装置B中产生了白色沉淀,其成分是,说明SO2具有 性。
(4)分析B中产生白色沉淀的原因:
猜想1: ;
猜想2:SO2与Fe3+反应;
猜想3:在酸性条件下SO2与NO3—反应;
①按猜想2,装置B中反应的离子方程式是。
②按猜想3,只需将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验。应选择的试剂是 (填字母)。
a.0.1 mol·L-1硝酸钠溶液 b.1.5 mol·L-1Fe(NO3)2溶液
c.6.0 mol·L-1 NaNO3和0.2 mol·L-1盐酸等体积混合的溶液
19.在精制饱和食盐水中加入碳酸氢铵可制备小苏打(NaHCO3),并提取氯化铵作为肥料或进一步提纯为工业氯化铵。完成下列填空:
(1)写出上述制备小苏打的化学方程式 ▲
(2)滤出小苏打后,母液提取氯化铵有两种方法:
①通入氨,冷却、加食盐,过滤 ②不通氨,冷却、加食盐,过滤
对两种方法的评价正确的是▲(选填编号)
a.①析出的氯化铵纯度更高 b.②析出的氯化铵纯度更高
c.①的滤液可直接循环使用 d.②的滤液可直接循环使用
(3)提取的NH4Cl中含少量Fe2+、SO42-。将产品溶解,加入H2O2,加热至沸,再加入BaCl2溶液,过滤,蒸发结晶,得到工业氯化铵。
加热至沸的目的是___________▲_____;滤渣的主要成分是__________▲______ _。
(4)称取1.840g小苏打样品(含少量NaCl),配成250ml溶液,取出25.00ml用0.1000mol/L盐酸滴定,消耗盐酸21.50ml。选甲基橙而不选酚酞作为指示剂的原因是_____ ▲ _____。
(5)将一定质量小苏打样品(含少量NaCl)溶于足量盐酸,蒸干后称量固体质量,也可测定小苏打的含量。若蒸发过程中有少量液体溅出,则测定结果___▲____。(选填“偏高”、“偏低”或“无影响”)
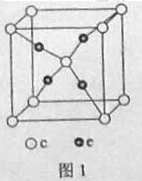
20.周期表前四周期的元素a、b、c、d、e,原子序数依次增大。A的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子。回答下列问题:
(1)b、c、d中第一电离能最大的是 (填元素符号),e的价层电子排布图为 。
(2)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为 ;分子中既含有极性共价键、又含有非极性共价键的化合物是 (填化学式,写出两种)。
(3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是 ;酸根呈三角锥结构的酸是 。(填化学式)
(4)e和c形成的一种离子化合物的晶体结构如图1,则e离子的电荷为 。
(5)这5种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构;阳离子呈轴向狭长的八面体结构(如图2所示)。

该化合物中阴离子为 ,阳离子中存在的化学键类型有 ;该化合物加热时首先失去的组分是 ,判断理由是 。
1.【答案】A 2. 【答案】B 3、【答案】A 4. 【答案】A
5.【答案】C 6、【答案】B
7.【答案】A 8、【答案】D
9.【答案】B 10. 【答案】C
11、【答案】B 12.【答案】A
13.【答案】A 14.【答案】D
15、 【答案】D
16.【答案】(1)原子晶体 (2)略 排水法收集 (3)AlN+NaOH+H2O=NaAlO2+NH3↑ (4)1.2%
解析(1)由氮化铝的性质可以得到其属于原子晶体;(2)氮气难溶于水,密度和空气相差不大,故最好用排水法收集;(3)由题目信息可知,由于AlN跟氢氧化钠溶液反应生成NaAlO2、并放出NH3,据此生成方程式.
(4)有反应 C+2H2SO4=CO2+2SO2+2H2O 可得生成的气体中CO2和SO2的物质的量之比为1:2 ,故CO2的体积为224mL,物质的量为0.01mol,根据碳元素守恒,样品中的碳的物质的量为0.01mol,质量为0.12g,质量分数为1.2%。
17. 【答案】(1)烧杯、玻璃棒、量筒;(2)饱和NaHCO3;吸收HCl气体或吸收酸性气体;
(3)无水CaCl2 或硅胶或P2O5固体;(4)①烃 , d
② CaCO3+2CH3COOH=2CH3COO-+Ca2++H2O+CO2↑
18.【答案】(1)Na2SO3+H2SO4(浓)= Na2SO4+SO2↑+H2O
(2)打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹 (3)BaSO4 ; 还原
(4)猜想1:SO2与Fe3+、酸性条件下NO都反应
①SO2+2Fe3++Ba2++2H2O=BaSO4↓+2Fe2++4H+
(可分两步写SO2+2Fe3++2H2O=2Fe2++SO+4H+、SO+Ba2+=BaSO4↓);
②c
19.
【答案】(1)NH4HCO3+NaCl=NaHCO3↓+NH4Cl (2)ad
(3)使Fe3+完全水解为Fe(OH)3;Fe(OH)3、BaSO4
(4)选用酚酞作为指示剂,不能确定滴定终点 (5)偏高
20.
【答案】(1) N ![]() ( 2) sp3 H2O2 N2H4
( 2) sp3 H2O2 N2H4
(3)HNO2 HNO3 、H2SO3 (4)+1
(5)SO42- 共价键和配位键 H2O H2O与Cu2+的配位键比NH3与Cu2+的弱