
湖南省醴陵二中、醴陵四中2016-2017学年高二下学期期中联考化学试卷
03月05日
大名一中2017年10月月考
高三化学
一、选择题(共20个,每题3分)
1 .地壳中含量最多的金属元素是( )
A.铁B.氧C.硅D.铝
2.下列叙述正确的是( )
A.含1 mol溶质的任何溶液,物质的量浓度一定相等
B.配制1 mol·L-1 NaCl溶液1 L,其方法是将58.5 g NaCl溶于1 L水中即可
C.体积相同、物质的量浓度相同的同种溶液所含溶质的粒子数一定相同
D.1 L 0.5 mol·L-1CaCl2溶液中,Ca2+与Cl-的物质的量浓度都是0.5 mol·L-1
3.如图两瓶体积相等的气体,在同温同压时瓶内气体的关系一定正确的是( )
A.所含原子数相等B.气体密度相等
C.气体质量相等D.摩尔质量相等
4.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.6.8 g熔融的KHSO4中含有0.05NA个阴离子
B.1.0 L 2 mol/L的NaOH水溶液中含有的氧原子数目为2NA
C.25 ℃时,pH=13的氢氧化钡溶液中含有0.1NA个OH-
D. 5.6 g铁与一定量稀硝酸完全反应,电子转移数目一定为0.3NA
5.第一块在加热下与足量氧气充分反应,第二块在常温下与足量氧气充分反应。则下列说法正确的是( )
A.第一块钠失去电子数多B.两块钠失去电子数相同
C.两块钠的反应产物的颜色相同D.两块钠所得反应产物的质量相等
6.镁、铝在空气中稳定存在的原因是( )
A.性质不活泼,不与空气中的成分反应
B.镁、铝与氧气的反应速率极慢
C.经过了特殊工艺处理
D.与氧气反应形成了氧化物保护膜
7.下列物质中,既能与盐酸反应又能与氢氧化钠溶液反应的是( )
①![]() ②Al ③
②Al ③![]() ④
④![]() ⑤
⑤![]() ⑥CuO
⑥CuO
A.②③④⑤ B.①③④⑥C.①②③④D.全部
8.要用![]() 制备
制备![]() ,下列最合适的试剂是( )
,下列最合适的试剂是( )
A.NaOH溶B.氨水C.KOH溶液![]() 溶液
溶液
9.标准状况下有以下四种气体:①6.72 L CH4;②3.01×1023个HCl分子;③13.6 g H2S;④0.2 mol NH3。下列关系不正确的是( )
A.体积:④<①<③<②
B.质量:④<①<③<②
C.物质的量:①<②<③<④
D.氢原子数:②<④<③<①
10. 下列溶液中,溶质的物质的量浓度不是1 mol·L-1的是( )
A.10 g NaOH固体溶解在水中配成250 mL溶液
B.将80 g SO3溶于水并配成1 L的溶液
C.将0.5 mol·L-1的NaNO3溶液100 mL加热蒸发掉50 g水的溶液
D.标准状况下,将22.4 L氯化氢气体溶于水配成1 L溶液
11. 实验室用碳酸钠晶体配制1.00 mol·L-1的Na2CO3溶液100 mL,造成所配溶液浓度偏低的原因是( )
A.暴露在空气中称量碳酸钠晶体(Na2CO3·10H2O)的时间太长
B.向容量瓶转移液体时,容量瓶事先用蒸馏水洗涤
C.定容时俯视刻度线
D.洗涤液移至容量瓶中时,洒出一部分
12. 下列说法或计算正确的是( )
A.采用加热蒸发溶剂的方法可以使浓度为4 mol·L-1的盐酸的浓度变为8 mol·L-1
B.把100 g 20%的NaCl溶液与100 g H2O混合后,NaCl溶液的质量分数变为10%
C.将2.3 g Na投入97.7 g水中充分反应,所得溶液的溶质质量分数为4.0%
D.已知某温度下KNO3的溶解度是31.6 g,该温度下将20 g KNO3固体溶解于50 g水中,充分溶解,所得溶液的溶质质量分数是28.6%
13. 用光洁的铂丝蘸取某无色溶液在无色火焰上灼烧,直接观察时看到火焰呈黄色,下列判断正确的是( )
A.只含Na+B.一定含Na+,可能含有K+
C.既含有Na+,又含有K+D.可能含有Na+,可能还含有K+
14.分类是科学研究的重要方法,下列物质分类不正确的是( )
A.化合物:干冰、冰水混合物、烧碱、小苏打
B.同素异形体:活性炭、C60、C80、金刚石
C.非电解质:乙醇、四氯化碳、氯气、葡萄糖
D.混合物:漂白粉、纯净矿泉水、盐酸、石灰石
15.下列叙述正确的是( )
A.胶体区别于其他分散系的根本原因是胶体有丁达尔现象
B.分散系中分散质粒子直径由小到大的正确顺序是:溶液<胶体<浊液
C.光束通过胶体和浊液时都可以看到一条光亮的通路,而溶液不能
D.胶体的分散质可以通过过滤从分散剂中分离出来
16.实验室利用以下反应制取少量氮气:NaNO2+NH4Cl===NaCl+N2↑+2H2O,关于该反应的下列说法正确的是( )
A.NaNO2是氧化剂
B.每生成1 mol N2转移电子的物质的量为6 mol
C.NH4Cl中的氮元素被还原
D.N2既是氧化剂,又是还原剂
17. 下列各项中,与元素化学性质关系最密切的是原子的( )
A.核外电子层数B.最外层电子数C.核内中子数D.相对原子质量
18. 某元素原子核外第二层是其他层电子数之和的2倍,则该元素的核电荷数为( )
A.4B.8C.12D.16
19. 下列原子中,最难形成离子的是( )
A.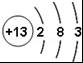 B.
B.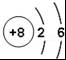 C.
C.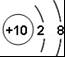 D.
D.
20. 下列化学方程式书写错误的是( )
A.Al2O3粉末溶于NaOH溶液中:Al2O3+2NaOH2NaAlO2+H2O
B.NaAlO2溶液中通入足量的CO2:2NaAlO2+CO2+3H2O2Al(OH)3↓+Na2CO3
C.灼烧氢氧化铝固体:2Al(OH)3![]() Al2O3+3H2O
Al2O3+3H2O
D.电解熔融的氧化铝:2Al2O3(熔融)![]() 4Al+3O2↑
4Al+3O2↑
二、非选择题
21. (10分)A、B、C、D、F五种物质的焰色反应均为黄色,A、B、C、D与盐酸反应均生成E,此外B还生成一种可燃性气体。而C、D还生成一种无色无味气体H,该气体能使澄清石灰水变浑浊。D和A可反应生成C,F和H也可反应生成C和另一种无色无味气体。请回答下列问题:
①D+盐酸____________________________________________________________;
②B+水______________________________________________________________。【来源:全,品…中&高*考+网】22.(12分)实验室需要0.1 mol·L-1 NaOH溶液450 mL和0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
①所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为________mL(计算结果保留一位小数);
②如果实验室有15 mL、20 mL、50 mL量筒,应选用________mL量筒最好;
③配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是_________________________________________________________________。
23.(8分)有4种含有铝元素的化合物A、B、C、D,且能发生下列反应:①A+NaOH![]() D+H2O;②B
D+H2O;②B![]() A+H2O;③C+NaOH
A+H2O;③C+NaOH![]() B+NaCl;④在①溶液中滴入盐酸后有沉淀生成,盐酸过量沉淀又溶解生成C。则A、B、C、D的化学式分别是A 、B 、C 、D 。
B+NaCl;④在①溶液中滴入盐酸后有沉淀生成,盐酸过量沉淀又溶解生成C。则A、B、C、D的化学式分别是A 、B 、C 、D 。
24.(10分)标准状况下15 g CO与CO2的混合气体,体积为11.2 L。则:
答案1-5DCAAB 6-10DCBCC 11-15DBBCB 16-20ABCCB
21.
解析:由焰色反应为黄色,且A、B、C、D均与盐酸反应生成E,知E为NaCl,B还生成一种可燃性气体知B为Na,C、D还生成气体H使澄清石灰水变浑浊,知C、D为Na2CO3或NaHCO3,F和H(CO2)反应生成C和另一种气体,则F为Na2O2、C为Na2CO3,因而D为NaHCO3,D和A反应可生成Na2CO3,则A为NaOH。
答案:(1)NaOH Na2CO3 Na2O2
(2)2Na2O2+2CO2===2Na2CO3+O2
(3)①HCO+H+===H2O+CO2↑
②2Na+2H2O===2Na++2OH-+H2↑
22.答案:(1)AC 烧杯、玻璃棒 (2)①2.0 ②<
③> (3)①13.6 ②15 ③将浓硫酸沿器壁缓缓倒入水中,并用玻璃棒不断搅拌
解析:(1)配制溶液需要五种玻璃仪器:量筒、烧杯、玻璃棒、胶头滴管、容量瓶。
(2)①因无450 mL的容量瓶,配制NaOH溶液要用500 mL 的容量瓶,m(NaOH)=c·V·M=0.1 mol·L-1×0.5 L×40 g·mol-1=2.0 g;③NaOH溶于水放出大量热,应把它冷却至室温后再移入容量瓶中,否则定容后,溶液冷却到室温后,体积减小,浓度偏高。
(3)①c(浓)·V(浓)=c(稀)·V(稀),即 mol·L-1×V(浓)=0.5 mol·L-1×0.5 L,得V(浓)≈0.013 6 L=13.6 mL;②选用15 mL量筒最好,误差小;③注意三点:酸入水、沿器壁、棒搅拌。
23.解析:含有铝元素的化合物加热能分解的只有Al(OH)3,根据②B![]() A+H2O推出B为Al(OH)3,A为Al2O3,再由①A+NaOH
A+H2O推出B为Al(OH)3,A为Al2O3,再由①A+NaOH![]() D+H2O推出D为NaAlO2,由③C+NaOH
D+H2O推出D为NaAlO2,由③C+NaOH![]() B+NaCl推出C为AlCl3。
B+NaCl推出C为AlCl3。
答案:Al2O3 Al(OH)3 AlCl3 NaAlO2
答案:(1)1.339 g·L-1 (2)30 g·mol-1
(3)1∶7 (4)87.5% (5)11∶49 (6)81.7%
(7)0.562 5 mol (8)0.5 mol
解析:(1)密度=质量/体积=15 g/11.2 L≈
1.339 g·L-1。
(2)解法一:n==0.5 mol,
M=m/n=15 g/0.5 mol=30 g·mol-1。
解法二:M=ρ·Vm=1.339 g·L-1×22.4 L·mol-1≈30 g·mol-1。
(3)根据阿伏加德罗定律:体积之比=物质的量之比,最简单的方法是用十字交叉法计算:
CO2 44 2
30
CO 28 14
n(CO2)/n(CO)=1/7。
(4)CO的体积分数=×100%=87.5%。
(5)===11∶49。
(6)CO的质量分数=×100%≈81.7%。
(7)n(O)=2n(CO2)+n(CO)=2×0.5 mol×1/8+0.5 mol×7/8=0.562 5 mol。
(8)n(C)=n(CO2)+n(CO)=0.5 mol。