
湖南省醴陵二中、醴陵四中2016-2017学年高二下学期期中联考化学试卷
03月05日
2014-2015学年度第二学期
高三年级化学科段考试题
注意事项:
1、本卷分第Ⅰ卷和第Ⅱ卷两部分,请将答案写在答题卷上。
2、本卷满分100分,考试时间90分钟。
3、可能用到的相对原子质量:H—1 C—12N—14O—16Cl—35.5S—32
Cu—64B—10.8
第Ⅰ卷(选择题,共36分)
一、选择题:本题包括6小题,每小题2分,共计12分。每小题只有一个选项符合题意。
1.下列反应中生成物总能量高于反应物总能量的是
A.Na2O2放入水中B.电解饱和食盐水
C.甲烷的燃烧D.盐酸滴定氢氧化钠溶液
2.下列有关说法中正确的是
A.CO2或SO2都会导致酸雨的形成
B.苯与溴水在铁催化下可发生取代反应
C.生铁中含有碳,抗腐蚀能力比纯铁弱
D.电解水生成H2和O2的实验中,可加入少量盐酸增强导电性
3.下列物质的化学用语表达正确的是
A.F-的结构示意图:![]() B.蓝矾的化学式:FeSO4·7H2O
B.蓝矾的化学式:FeSO4·7H2O
![]() C.四氯化碳的电子式:D.核内含有18个中子的氯原子:
C.四氯化碳的电子式:D.核内含有18个中子的氯原子:![]()
4.已知甲苯的一氯代物有4种,则甲苯与氢气完全加成后产物的一氯代物的种类数是
A.2种B.4种C.5种D.7种
5.下列各项关系中正确的是
A.原子半径:Al>Mg>FB.结合质子能力:OH->CH3COO->Cl-
C.热稳定性:HF>H2S>H2OD.碱性:NaOH>KOH>Mg(OH)2
6.利用下列装置(部分仪器已省略),能顺利完成对应实验的是
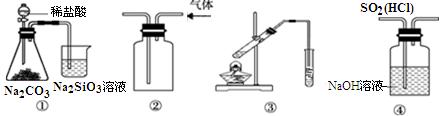
A.图①所示实验可比较氯、碳、硅三种元素的非金属性强弱
B.用图②所示实验装置排空气法收集CO2气体
C.用图③装置制备少量乙酸乙酯
D.图④装置可以用来除去SO2中的HCl
二、选择题:本题包括6小题,每小题4分,共计24分。每题有一个或两个选项符合题意。
7.室温下,下列各组离子一定能大量共存的是
B.滴加甲基橙试剂显红色的溶液中:Na+、Fe2+、Cl—、NO3—
C.在c(H+)=10—13mol·L-1的溶液中:NO3—、K+、AlO2—、CO32—
D.在与铝反应能够产生氢气的溶液中:K+、Fe2+、Cl—、NH4+
8.设NA为阿伏加德罗常数的值,下列叙述正确的是
A.标准状况下,22.4L的CCl4中含有的CCl4分子数为NA
B.常温常压下,22 g CO2中所含的共用电子对数为2NA
C.25℃时,pH=2的醋酸冲稀10倍后,溶液中H+数目大于0.001NA
D.密闭容器中加入一定量的H2和N2,反应生成1mol NH3时转移电子数小于3NA
9.下列实验能够达到目的的是
A.用金属钠除去乙醇中混有的少量水
B.用湿润的蓝色石蕊试纸检验NH3
C.用燃烧法鉴别乙醇、苯和四氯化碳
D.滴加数滴硫酸锌来加快铁与稀硫酸的反应
10.甲、乙两烧杯中分别装有相同体积、相同物质的量浓度的氨水和NaOH溶液,各加入10mL 0.1 mol·L-1AlCl3溶液,两烧杯中都有沉淀生成。下列判断正确的是
A.甲中和乙中的沉淀可能一样多B.甲中沉淀可能比乙中的多
C.甲中沉淀一定比乙中的少D.甲中沉淀一定比乙中的多
11.对于反应A2(g)+2B2(g)![]() 2AB2(g)(正反应为放热反应),下列各图所表示的变化符合勒夏特列原理的是
2AB2(g)(正反应为放热反应),下列各图所表示的变化符合勒夏特列原理的是
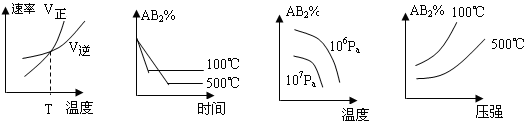
ABCD
12.氯化碘(ICl)的化学性质与氯气相似,下列有关叙述正确的是
A.ICl属于离子化合物,具有较强的氧化性
B.等物质的量的Cl2与ICl可氧化等物质的量的SO2
C.ICl与水反应不属于氧化还原反应
D.ICl与氢氧化钠溶液反应可生成NaI和NaClO
第Ⅱ卷(非选择题,共64分)
13.(10分)A、B、C、D四种短周期元素,原子序数依次增大;A和C能形成一种+1价阳离子Y;B元素的原子最外层电子数是次外层电子数的2倍;C、D在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体。试回答下列问题:
(1)D的元素名称为。元素B位于周期表中第_______周期_______族。
(2)写出一种由A、B、C、D四种元素组成的常见无机化合物的化学式,其中所含的化学键类型为_______________________________________。
(3)写出Y水解的离子方程式_____________________________________。
(4)在25℃,101 kPa时,1 g A单质在O2中充分燃烧,放出143 kJ的热量。则表示A单质燃烧热的热化学方程式为。
14.(9分)氮及其化合物在工农业生产、生活中有着重要作用。
(1)实验室制氨气的化学方程式为。
(2)氨水常作沉淀剂,25℃时,Ksp=4.0×10-38,Ksp=1.1×10-33,向浓度均为0.1 mol·L-1的FeCl3和AlCl3混合溶液中加入氨水,首先生成的沉淀是(填化学式)。
(3)若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)= a mol/l,则c(SO42-)=。
(4)氨气是一种富氢燃料,可以直接用于燃料电池,下图是供氨水式燃料电池工作原理:
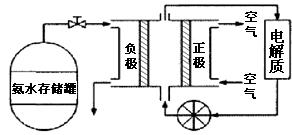
①氨气燃料电池的电解质溶液最好选择(填“酸性”、“碱性”或“中性”)溶液。
②空气在进入电池装置前需要通过过滤器除去的气体是。
③氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池正极的电极反应式是。
15.(9分)一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)![]() FeO(s)+CO(g),已知该反应的平衡常数(K)与温度(T)的关系如图甲所示:
FeO(s)+CO(g),已知该反应的平衡常数(K)与温度(T)的关系如图甲所示:
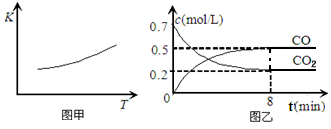
(1)该反应为反应(填“吸热”或“放热”)。
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图乙所示,8分钟内,CO的平均反应速率v(CO)=。计算该反应的平衡常数K=。
(3)下列措施中能使平衡时c(CO)/c(CO2)增大的是(填序号)。
A.升高温度 B.增大压强
C.充入一定量CO D.再加入一些铁粉
(4)铁的重要化合物高铁酸钠是一种饮用水消毒剂,具有氧化能力强、安全性好等优点。
①高铁酸钠生产方法之一是电解法,其原理为Fe+2NaOH+2H2ONa2FeO4+3H2↑,
则电解时阳极的电极反应式是。
②高铁酸钠生产方法之二是在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和水,该反应的离子方程式为。
S=C=O
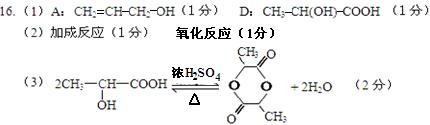
16.(6分)由A和其他无机原料合成环状化合物E,其合成过程如下(水及其他无机产物均已省略):
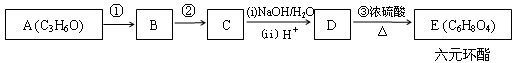
已知:RCH2ClRCH2OH,A分子中不含甲基,且能使溴水褪色。回答下列问题:
(1)写出结构简式:A__________________,D__________________。
(2)图中①的反应类型是_____________,②的反应类型是_____________。
(3)写出反应③的化学方程式:________________________________________。
17.(10分)为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。
实验I:反应产物的定性探究
按如图装置(固定装置已略去)进行实验:
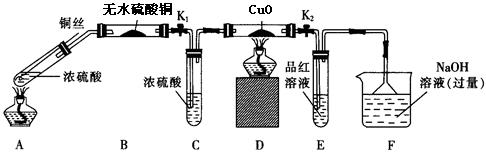
(1)F装置的烧杯中发生反应的离子方程式是;B装置中的现象是。
(2)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是。
(3)实验结束时,撤去所有酒精灯之前必须完成的实验操作是。
(4)实验结束后,证明A装置试管中所得产物中含有Cu2+的操作方法是。
实验Ⅱ:反应产物的定量探究
(5)为测定硫酸铜的产率,将该反应所得溶液中和后配制成250.00 mL溶液,取该溶液25.00 mL加入足量KI溶液中振荡,以淀粉溶液为指示剂,用0.36 mol/L的Na2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液25.00 mL。若反应消耗铜的质量为6.4 g,则硫酸铜的产率为。(已知2Cu2++4I—=2CuI↓+I2,2S2O32—+I2=S4O62—+2I—)
选考部分(20分)
选考题(请考生在第18、19、20三题中任选一题做答,如果多做,则按所做的第一题计分。答题前,请用2B铅笔在答题卡上把所选模块对应的标号涂黑。注意所做模块题必须与所涂模块相同。)
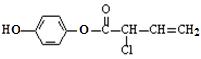 《有机化学基础》
《有机化学基础》
18-Ⅰ(双项选择题,6分)有机物M的结构简式为:
有关M的下列叙述中正确的是
A.分子式为C10H11O3Cl
B.一定条件下可以发生取代反应、加成反应、氧化反应
C.可与NaOH溶液反应,1 mol M最多消耗4mol NaOH
D.既能与FeCl3发生显色反应,也能和 Na2CO3溶液反应放出CO2
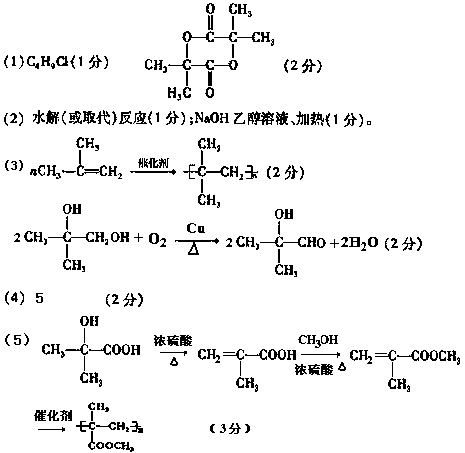
18-Ⅱ(14分)已知A是氯代烃,C是高分子化合物,H是一种环状酯且核磁共振氢谱仅有1个吸收峰。转化关系如下图所示:
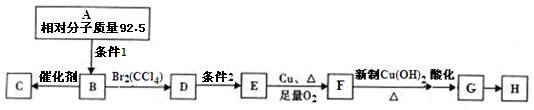
回答下列问题:
(3)写出下列反应的化学方程式:
B→C:;
E→F:。
(4)满足下列条件的G的同分异构体有种。
①属于酯类;②能发生银镜反应;③能与金属钠反应放出气体。
(5)由甲醇和G为原料制备有机玻璃(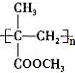 )的合成路线为。
)的合成路线为。
《物质结构与性质》
19-I(双项选择题,6分)如图为NaCl晶胞,下列说法中正确的是
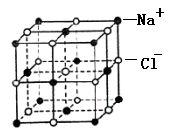 A.每个晶胞中含14个Na+
A.每个晶胞中含14个Na+
B.Na+的配位数为6,Cl-的配位数也为6
C.与Cl-距离最近的Cl-有12个
D.与Cl-距离最近的Na+形成的几何图形为三角双锥
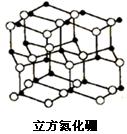 19-II(14分)氮化硼是由氮原子和硼原子所构成的晶体,其组成为43.6%的硼和56.4%的氮(质量分数),有多种不同的变体,立方氮化硼是其中一种。立方氮化硼的硬度仅次于金刚石而远远高于其它材料,常用作磨料和刀具材料,其结构与金刚石类似(如图)。
19-II(14分)氮化硼是由氮原子和硼原子所构成的晶体,其组成为43.6%的硼和56.4%的氮(质量分数),有多种不同的变体,立方氮化硼是其中一种。立方氮化硼的硬度仅次于金刚石而远远高于其它材料,常用作磨料和刀具材料,其结构与金刚石类似(如图)。
(1)电负性大小:硼原子_______氮原子;第一电离能:氮原子
_______氧原子(填大于、小于或等于)。
(2)氮化硼的化学式为:_____________。
(3)预测立方氮化硼的晶体类型为_____________,晶体内的作
用力是_____________,氮原子的杂化类型为__________。
(4)立方氮化硼具有广泛的应用前景,其合成方法多样。其中水溶剂热合成法是在一定条件下溴化硼和氮化锂反应,再分离、洗涤、干燥得到氮化硼。
①溴化硼为_________化合物(填“离子”或“共价”),其空间构型为___________。
②请写出上述方法生成氮化硼的化学方程式:_______________________。
《化学与技术》
20-I(双项选择题,6分)下列有关化工生产的说法中,不正确的是
A.工业上用热还原法冶炼铁:Fe2O3+3CO![]() 3CO2+2Fe
3CO2+2Fe
B.硫酸工业、合成氨工业和氯碱工业均采用了循环操作提高原料的利用率
C.利用反应:NaCl(饱和)+CO2+NH3+H2O=NaHCO3↓+NH4Cl制取NaHCO3时,应先通入过量的NH3,再通入过量的CO2
D.硫酸生产中常采用高压条件提高SO2的转化率
20-II(14分)工业上对海水资源综合开发利用的部分工艺流程如下图所示。
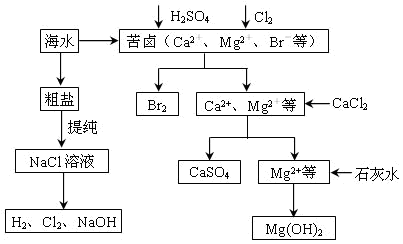
(1)为有效除去粗盐中的Ca2+、Mg2+、SO![]() 等杂质,加入试剂的合理顺序为________。
等杂质,加入试剂的合理顺序为________。
A.先加NaOH,后加Na2CO3,再加BaCl2
B.先加NaOH,后加BaCl2,再加Na2CO3
C.先加BaCl2,后加NaOH,再加Na2CO3
(2)在隔膜法电解食盐水时,电解槽阳极区的电极反应式为________________________;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为___________________________________________。
(3)氯碱工业制得的氯气可用于生产半导体材料硅,其流程如下:
①石英砂的主要成分是___________,在制备粗硅时,焦炭的作用是______________。
②粗硅与氯气反应后得到的液态四氯化硅中常混有一些杂质,必须进行分离提纯。其提纯方法为_______________________。
③由四氯化硅得到高纯硅的化学方程式是__________________________________
(4)本工艺流程中先后制得Br2、CaSO4和Mg(OH)2,能否按Br2、Mg(OH)2、CaSO4的顺序制备?原因是__________________________________________________。
(5)工业上采用电解MgCl2的方法制得金属镁,电解槽中阴极的电极反应式为________,从MgCl2溶液得到MgCl2固体的方法是______________________;有同学认为可加热Mg(OH)2得到MgO,再电解熔融MgO制金属镁,你同意该同学的想法吗?为什么?。
2014—2015学年度第二学期
高三年级化学科段考试题参考答案及评分标准
第Ⅰ卷(选择题,共36分)
本卷前6小题每个2分,后6小题每个4分
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| B | C | A | C | B | C | AC | B | C | AB | D | BC |
第Ⅱ卷(非选择题,共64分)
(3) NH4++H2O![]() NH3•H2O + H+(2分)
NH3•H2O + H+(2分)
(4)H2(g)+1/2O2(g)=H2O(l);△H=-286kJ/mol(2分)
14.(1)2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O(2分)
CaCl2+2NH3↑+2H2O(2分)
(2)Fe(OH)3(1分)(3)![]() (2分)
(2分)
(4)①碱性②CO2(各1分)③O2 + 4e-+ 2H2O = 4OH-(2分)
15.(1)吸热(1分)(2)0.0625mol/(L·min)(1分) 2.5(1分)(3)A(2分)
(4)①Fe-6e-+8OH-=FeO42-+4H2O(2分)
②2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O(2分)
17.(1)SO2+2OH—=SO32—+H2O(2分); 白色粉末变蓝色(1分)
(2)D装置中黑色固体颜色无变化,E中溶液的红色褪去(2分)
(3)拉起铜丝,关闭K1、K2(1分)
(4)将A装置中试管内冷却后的混合物沿杯壁(或玻璃棒)缓缓倒入盛有水的烧杯中,并不断搅拌,若溶液变蓝,证明含有Cu2+(2分)
(5)90%(2分)
18-ⅠBC (6分)
18-Ⅱ(14分)
19-I BC(6分)
19-II(1)小于 大于(各1分)(2)BN(2分)
(3)原子晶体(1分)共价键(1分)sp3(2分)
(4)① 共价 平面三角形 ②BBr3+Li3N==3LiBr+BN(各2分)
20-IBD(6分)
20-II(14分)
(1)BC (2分)
(2)2Cl--2e- = Cl2↑(1分) NaCl+H2O![]() NaClO+H2↑(1分)
NaClO+H2↑(1分)
(3)①SiO2(1分)还原剂(1分) ②分馏(1分)
③SiCl4+ 2H2![]() Si + 4HCl(1分)
Si + 4HCl(1分)
(4)否(1分)。如果先沉淀Mg(OH)2,则沉淀中会夹杂有CaSO4沉淀,产品不纯(1分)。
(5)Mg2++2e-=Mg(1分),在氯化氢气流中加热蒸发(1分)。
不同意(1分),因为MgO熔点很高,熔融时耗费大量的能量而增加生产成本(1分)。