
湖南省醴陵二中、醴陵四中2016-2017学年高二下学期期中联考化学试卷
03月05日
福州市2018届高三上学期期末考试
化学试题
温馨提示:
1、本试题分第Ⅰ卷选择题和第Ⅱ卷非选择题,满分100,考试时间90分钟。
2、所有试题均在答题卷上作答,否则答题无效。
3、解题可能用到的相对原子质量:H—1 C—12 N—14 O—16 Na—23 Al—27
Cl—35.5 Fe—56 Cu—64 Ba—137
第Ⅰ卷 选择题(共48分,每小题3分,每小题只有一个正确答案。)
(一)造纸术、指南针、火药及印刷术四大发明是中国古代科技对世界文明发展的积极贡献。
1、东汉蔡伦总结前人经验,用树皮、破渔网、破布、麻头等作为原料,制造成较低成本的书写纸,史称“蔡侯纸”。“蔡侯纸”的主要成分可能是( )
A、淀粉 B、天然纤维 C、聚氯乙烯 D、二氧化硅
2、北宋沈括的《梦溪笔谈》对指南针已有详细记载:“方家以磁石磨针缝,则能指南。”磁石的主要成分是( )
A、FeO B、Fe2O3C、Fe3O4D、CuFeS2
3、黑火药着火爆炸,发生如下反应:2KNO3 + S + 3C = K2S + N2↑ + 3CO2↑,该反应的还原剂是( )
A、KNO3 B、S C、C D、S、C
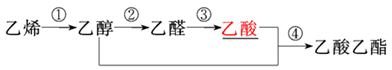
(二)石油裂解获得的乙烯可以用于生产许多常见的有机物。下图是合成乙酸乙酯的一种路线图:
4、以下标示适合贴在无水乙醇试剂瓶上的是( )



A B C D
5、以上合成路线中通过加成反应实现的转化是( )
A、① B、② C、③ D、④
6、若100吨乙烯经上述过程最终获得100吨乙酸乙酯。则此过程产率( )
A、达100% B、等于70% C、小于70% D、无法判断
7、实验室可用下图所示的装置实现“路线图”中的部分转化:

以下叙述错误的是( )
A、铜网表面乙醇发生氧化反应
B、甲、乙烧杯中的水均起冷却作用
C、试管a收集到的液体中至少有两种有机物
D、实验开始后熄灭酒精灯,铜网仍能红热,说明发生的是放热反应
8、下列四种有机物,同分异构体最多的是( )
A、乙烯 B、乙醇 C、乙醛 D、乙酸
(三)
9、NA为阿伏伽德罗常数的值,下列说法正确的是( )
A、含1mol碳原子的金刚石中,共价键数为4NA
B、58.5gNaCl晶体中含2NA个离子
C、标准状况下,11.2L乙烯包含NA个碳碳双键
D、100ml 0.5mol·L-1Na2SO4溶液含有0.2NA个钠离子
10、下列化学用语正确的是( )
A、S2-结构示意图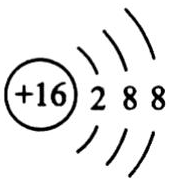 B、N2电子式
B、N2电子式![]()
C、CO2的结构式O—C—O D、纤维素的结构简式(C6H10O5)n
11、根据FeCl3溶液滴入不同试剂中的实验现象,所的结论不正确的是( )
| 试剂 | 现象 | 结论 | |
| A | H2S溶液 | 溶液变浑浊 | Fe3+有氧化性 |
| B | NH4SCN溶液 | 溶液变红色 | NH4+抑制了 Fe3+水解 |
| C | AgNO3溶液 | 产生白色沉淀 | 发生复分解反应 |
| D | 沸水 | 沸水变红褐色 | 有氢氧化铁胶体生成 |
12、下列实验中,所选装置或实验设计合理的是( )
 |  |  |  |
| 分离碘单质和四氯化碳 | 分离乙醇和水 | 氯化铝溶液制取无水氯化铝 | 用饱和食盐水除去氯气中的氯化氢 |
| A | B | C | D |
13、电解法处理酸性含铬废水(主要含有C2O72-)过程,溶液中发生反应:
Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O之后Cr3+以Cr(OH)3形式除去,下列说法不正确的是( )
A、阳极反应为Fe – 2e- = F2+
B、可用铁板作阴、阳极
C、电解过程中可能有F(OH)3沉淀生成
D、每有1mol C2O72-被还原,电路中转移6mol电子
14、室温下,0.1mol·L-1HF溶液PH=2,则下列有关描述不正确的是( )
A、该溶液c(OH-)>c(HF) B、该温度时HF电离常数K=1.1×10-3
C、氢氟酸酸性比盐酸弱 D、若加热,溶液PH<2
15、H2O2分解反应过程能量变化如右图所示,以下相关叙述正确的是( )
A、1molH2O2(l)键能总和比1molH2O(l) +0.5molO2键能总和大(E2-E1)
B、该反应是吸热过程
C、使用MnO2催化剂,E3将降低
D、2H2O2(l) = 2H2O(l) + O2(g) ∆H=E1-E2
16、25℃时,往HA溶液中滴加NaOH溶液,溶液中HA和A-二者中各自所占的物质的量分数(α)随溶液PH变化的关系如图所示。下列说法正确的是( )
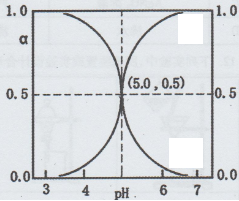
A、在PH=5.0的溶液中,c(A-)=c(HA),c(OH-)= c(H+)
B、PH=7的溶液中,α(HA)=0,α(A-)=1.0
C、25℃时,Ka(HA)=1×10-5
D、PH=5.0时,溶液中水电离产生的c(H+)=1×10-5mol·L-1
第Ⅱ卷 非选择题(共52分)
17、短周期主族元素V、W、X、Y、Z的原子序数依次增大。由这五种元素组成的九种物质中,A、B、C是气体单质,其余均为化合物;A是黄绿色气体,甲是能使湿润的红色石蕊试纸变蓝的无色气体,乙是人体中 含量最大的化合物,丙是淡黄色固体。它们的转化关系如图所示。
回答下列问题:
18、碱式碳酸铜可用作有机催化剂、杀虫剂及饲料中铜的添加剂,还可以用于烟火和颜料制造。CuSO4溶液与Na2CO3溶液反应能否得到碱式碳酸铜?某兴趣小组进行相关探究。
【沉淀制备】
称取12.5g胆矾溶于一定量的水中配成8%的CuSO4溶液。向其中加入适量Na2CO3溶液,将所得蓝绿色悬浊液过滤,用蒸馏水洗涤,再用无水乙醇洗涤。
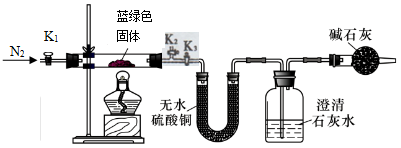
19、金属钴是一种非常稀缺的战略资源。工业上通过电解法从废旧硬质合金刀具[含碳化钨(WC)、金属钴(Co)及少量杂质铁]中回收钴。工艺流程简图如下:
已知:
| 金属离子 | 开始沉淀PH | 沉淀完全PH |
| Co2+ | 5.6 | 9.5 |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
请回答下列问题:
20、CO2是一种常用的化工原料。
Ⅰ、以CO2与NH3为原料可以合成尿素[CO(NH)2]。合成尿素的反应为2NH3(g) + CO2(g) ⇌ CO(NH)2(s) + H2O(g)。
质子交换膜(只有质子能够通过)左右两侧的溶液均为1L 2mol·L-1H2SO4溶液。电极A上发生的电极反应式为 ,当电池中有1mole-发生转移时左右两侧溶液的质量之差为 g(假设反应物耗尽,忽略气体的溶解)。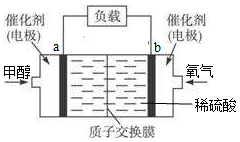
参考答案
第Ⅰ卷 选择题
(共48分, 每小题3分,每小题只有一个正确答案。)
| 题 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答 | B | C | C | A | A | C | B | D | B | A | B | D | D | A | C | C |
第Ⅱ卷 非选择题(52分)
说明:1.非选择题每空2分。考生写出其它合理答案酌情给分。
2.化学方程式书写若化学式错漏以零分计,仅其它错漏得1分;热化学方程式若焓变数据有误也以零分计。
17.(12分)
(1)NH3
(2)第三周期ⅦA族
(3)![]()
(4)NaH(或氢化钠)
(5)c(Cl-)>c(NH4+)>c(H+)>c(OH-)
(6)2NH3·H2O+3H2O2=N2↑+8H2O (2NH3+3H2O2=N2↑+6H2O 也给2分)
18. (14分)
(1)87.5 100mL量筒
(2)关闭 K1、k2,打开k3
(3)NO2-+NH4+![]() N2↑+2H2O
N2↑+2H2O
(4)B中白色固体变蓝,C中溶液变浑浊
(5)bd
(6)2CuCO3•3Cu(OH)2或3Cu(OH)2•2CuCO3或Cu5(OH)6(CO3)2
19. (12分)
20.(14分)
(1)< ; > ; <
(2)减小
(3)CO2(g)+ 3H2(g)= CH3OH(l)+H2O(l);ΔH=-130.9 kJ·mol-1
(4)CH3OH - 6e-+ H2O = CO2+ 6H+; 12