2016~2017学年度第一学期高一期中考试化学试卷
命题人:
考试时间:90分钟 满分:100分
注意事项:
选择题答案必须用2B铅笔涂在答题卡中相应的位置,否则该大题不予计分;非选择题用黑色签字笔在答题卷相应位置作答。
相对原子量:H-1 O-16 Na-23 Zn-65 Fe-56 N-14 C-12 Cl-35.5 S-32 Al-27
一、选择题(每题只有一个选项符合题意)(54分)
1.下列做法不能体现低碳生活的是
A .注意节约用水 B .减少食品加工过程 C .发展氢能和太阳能 D .大量使用化石燃料
2.物质的体积一定是22.4 L的是( )。
- 1 mol氯气 B.44 g二氧化碳 C. 标准状况下17 g氨气 D. 0℃、2×105 Pa时2 g氢气
3.下列叙述正确的是
- 48 g O3气体含有6.02×1023个分子B. 常温常压下,2.8 g NO气体含有1.81×1023个原子
C.1L 0.5 mol·L-1HCl溶液中含有3.01×1023个分子
D. 标准状况下,33.6 L H2O含有9.03×1023个分子
4.实验中需要2 mol·L-1的Na2CO3溶液950 mL,配制时,你认为应该选用的容量瓶的规格和称取的碳酸钠质量分别是
A.. 950 mL, 201.4 g B 1000 mL, 212 g C. 500 mL, 106 g D. 任意规格, 572 g
5.下列物质分类的说法正确的是
- O2、O3都属于单质 B. 液氯、漂白粉都属于混合物 C.NaCl、HClO都属于强电解质
D. 乙醇、乙酸都属于非电解质
- 下列有关说法正确的是
A.化合反应均为氧化还原反应 B. 置换反应均为氧化还原反应
C.金属氧化物均为碱性氧化物 D.酸性氧化物均为非金属氧化物 - 下列应用中利用了物质氧化性的是
A.天然气作为燃料气 B.食醋除去水垢 C.干冰可以人工降雨 D.漂白粉漂白纺织物
8.. 下列实验操作中各装置能达到实验目的的是
A、当装置广口瓶中充满饱和NaCl溶液,从a进气可以收集Cl2气体
B、该装置用于Fe与浓硝酸制取氢气气体的发生装置
C、该装置可以用于分离氢氧化铁胶体中NaCl
D、配制1mol•L-1NaOH溶液100mL
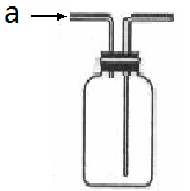

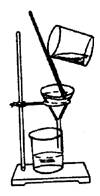
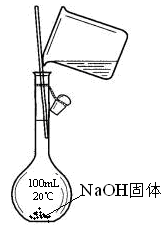 ;
;
A B C D
9.下列溶液中,一定能大量共存的离子组是
- K+、Ba2+、SO42-、HCO3-B.Al3+、Fe2+、Cl-、MnO4-
C.Na+、NH4+、NO3-、Cl-D. K+、Mg2+、NO3-、OH-
- 在200mL某硫酸盐溶液中含有1.5NA个SO42-(NA表示阿伏伽德罗常数的值),同时含有NA个金属离子。则该硫酸盐的物质的量浓度为
- 1mol•L-1 B. 2.5mol•L-1C . 3 mol•L-1D 5 mol•L-1
11.下列物质中为硝酸的酸性氧化物(酸酐)的是
- NO B . N2O3 C. NO2 D . N2O5
12.下列变化中,需要加入还原剂才能实现的是
A.Cl2→ HCl B .CO → CO2 C .S O2→ SO3 D. FeCl3 → FeCl2
13.下列物质的水溶液能导电,但属于非电解质的是
- Cl2 B. 乙醇 C. NH3 D. 乙酸
14.下列实验操作中发生化学反应用离子反应式表达合理的是
A.Na加入CuSO4溶液中: 2Na + Cu2+ = 2Na++Cu
B.Cl2通入冷的NaOH溶液中: Cl2 + 2OH- = Cl-+ClO-+ H2O
C.用稀盐酸洗涤试管内壁的CaCO3: CO32-+2H+ = CO2 ↑+ H2O
资*源%库 D.在醋酸溶液加入几滴澄清石灰水: H++OH- = H2O
15.下列物质的性质描述正确的是
- Fe在Cl2中燃烧生成FeCl2和FeCl3
- Na2O2与H2O反应中,Na2O2只作氧化剂
- FeCl3溶液能与Cu反应,可用蚀刻印刷电路
D.汽车尾气中CO与NO反应生成NO2和CO2
16.下列做法不正确的是
- 金属钠着火时,用细沙覆盖灭火
- 在100mL量筒中配制0.1000 mol·L-1Na2CO3溶液
- 易燃试剂与强氧化剂试剂分开放置并远离火源
- 浓硫酸和P2O5可以干燥Cl2
17.下列实验原理、方法和结论都正确的是
- 向饱和FeCl3溶液中滴加NaOH溶液可制得Fe(OH)3胶体
- 向某X溶液中加入适量的新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中含有Fe2+
- 将Cl2和HCl混合气体通过饱和食盐水可得到纯净的Cl2
- 检验某溶液中是否含有SO42-时,应取少量该溶液依次加入过量稀盐酸和BaCl2溶液
- 二氧化氯(ClO2) 是一种高效安全消毒剂。NaClO3与盐酸反应生成二氧化氯和氯气等,反应式为:2NaClO3+ 4HCl=2NaCl+ 2ClO2↑+ Cl2↑+2H2O, 上述反应中产生1 mol Cl2转移电子的物质的量为
A.2 mol B .3 mol C .4mo l D . 5mol
.第Ⅱ卷(非选择题,共46分)
- 填空题(共40分,每空2分)
- (10分)
(1)实验室配制500mL 0.2mol·L-1FeSO4溶液,需要称量FeSO4·7H2O__________g,
若实验遇到下列情况,对FeSO4溶液的物质的量浓度有何影响?(填“偏高”“偏低”或“不变”)①用以溶解FeSO4·7H2O烧杯未洗涤,_______________。
②摇匀后发现液面低于刻度线再加水,_________________。 - 把少量Na2O2投入含有HCO3-、CO32-、S2-、Na+的溶液中,上述溶液中离子数目增加的是____________,离子数目减少的是____________.
- (16分)铁、铁的化合物应用广泛。(1)在实验室中,FeCl3可以用铁粉与______反应制备,保存FeCl2溶液加入少量铁屑,其目的原理是____________________(用离子反应方程式表示)。
(2)高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾、次氯酸等还强。高铁酸钠的电离方程式是________________________,高铁酸钠是水处理过程中使用的一种新型净水剂原因铁元素转化为Fe(OH)3胶体,使水中悬浮物沉聚, Fe(OH)3胶体微粒直径的范围是____________nm,
(3)某班同学实验探究Fe2+、Fe3+的化学性质(已知I2在CCl4层中显紫色,Fe2+与K3[Fe(CN)6)]溶液反应生成Fe3[Fe(CN)6)]2蓝色沉淀 )
甲组同学在2mLFeCl2溶液中加入0.5mL煤油,再于液面下依次加入几滴氯水和一滴KSCN溶液,溶液变红。
乙组同学取10mL 0.1 mol·L-1KI溶液,加入6mL 0.1 mol·L-1FeCl3溶液充分混合。分别取2mL 此溶液于3只试管中进行如下实验:
第一支试管中加入1mLCCl4充分振荡、静置,CCl4层中显紫色,
第二支试管中加入1滴K3[Fe(CN)6)]溶液,生成蓝色沉淀
甲、乙的实验说明Fe3+、Cl2、I2氧化性强弱顺序为______________.写出生成蓝色沉淀的离子反应方程式__________________________________。检验第三支试管溶液中Fe2+是否可以加入酸性高锰酸钾试剂理由是_________________________________________。
丙组同学在2mLFeCl2溶液中加入足量Zn粉,如何设计简单实验方法证明Fe2+具有氧化性__________________________________. - NaClO2是一种重要的杀菌消毒剂。其一种生产工艺原理如下:
2NaClO3 + SO2 + H2SO4== 2ClO2 + 2NaHSO4
回答下列问题:(1) NaClO2中的Cl 的化合价__________.
- 将反应 改为离子反应方程式_______________________.
- 标出反应 的电子转移的方向和数目_________________________
- 用于电解的食盐水需先除去其中Ca2+、Mg2+、SO42-等杂质,除杂操作时,依次加入的试剂顺序为NaOH、_________、_________充分反应后,将沉淀一并过滤除去。
- 电解产生的尾气中有少量ClO2,(二氧化氯具有强氧化性)可以用H2O2碱性溶液吸收除去,该反应中的氧化产物为_________.
- KClO2和Cl2均能将电镀废水中CN-氧化为无毒的物质,自身被还原为Cl-.处理含CN-相同量电镀废水所需Cl2的物质的量是KClO2__________倍。
三.计算题(6分)
22.将一定量的锌粉加入浓硫酸中,反应过程中产生混合气体SO2和H2在标准状况下体积为4.48L.( 已知:Zn +2H2SO4(浓) = ZnSO4+SO2↑+ 2H2O )
- 需要 锌粉的质量至少多少克?
- 若生成H2标准状况下体积为1.12L,消耗硫酸物质的量为多少mol?
答题卷
- (10分)
- __________________ g ,________________________ ,_____________________.
- ________________ _________________,________________________________.
- (16分)
- _______________ ,_______________________________________.
- _____________________________________,_________________________
________________________,______________________________
___________________________________________________________.
丙组_______________________________________________
21.(14分)
- _________________ (2)____________________________________________
- ___________________________________________
(4) __________________、_____________________.
(5)_________________________ (6)____________________
三.计算题(6分)
高一化学
答案
- 选择题(54分,每题3分)
- D 2.C 3 .A 4 .B 5. A 6.B 7.D 8.A 9 .C 10.B.11. D 12.D 13.C 14.B 15.C 16.B
- D 18 .A
二.填空题(共40分,每空2分)
19. (10分)(1)27.8 g 偏低 偏低 (2)CO32-、Na+。 HCO3-、S2-
20.(16分)(1)Cl2 Fe +2Fe3+ = 3Fe2+ (2) Na2FeO4 = 2Na++FeO42-
1--100 (3) Cl2>Fe3+ >I2 3 Fe2++ 2[Fe(CN)6)]3-= Fe3[Fe(CN)6)]2↓
不可以,过量的I-也能使酸性高锰酸钾褪色。 用磁铁检验是否有铁生成。
21.(14分)(1)+3 (2)2ClO3-+ SO2 = 2 ClO2 + SO42-
(3)
- BaCl2、 Na2CO3(5)O2 (6) 2
三.计算题(6分)
- 13 g (2) 0.35 mol

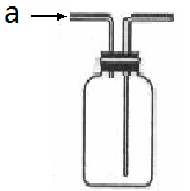


 ;
;