
湖南省醴陵二中、醴陵四中2016-2017学年高二下学期期中联考化学试卷
03月05日
南安一中2016~2017学年度上学期第二次阶段考
高一化学科试卷
命题者:杨仲发
考试内容: 《必修1》专题1第一单元 丰富多彩的化学物质 第二单元 研究物质的实验方法(常见物质的检验不考)。 满分100分,考试时间90分钟。
可能用到的相对原子质量:H-1C-12N-14O-16Na-24Al-27S-32Cl-35.5Ca-40
第I卷(选择题 共51分)
一.选择题:本大题共17小题,每小题3分,共51分。在每小题给出的四个选项中,只有一个选项符合题目要求。
1、成语是中华民族灿烂文化中的瑰宝,许多成语中蕴含着丰富的化学原理,下列成语中涉及氧化还原反应的是
A、木已成舟 B、铁杵成针 C、蜡炬成灰 D、滴水成冰
2、下列物质的水溶液能导电,但属于非电解质的是
A.HNO3B.CaOC.NH4NO3D.NH3
3.以下表示的是碳及其化合物的相互转化关系:
CCO2H2CO3CaCO3CO2
其中涉及的基本反应类型依次为
A.置换、化合、分解、复分解B.置换、化合、复分解、分解
C.化合、置换、分解、复分解D.化合、置换、复分解、分解
点燃
4.氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于阴影部分的是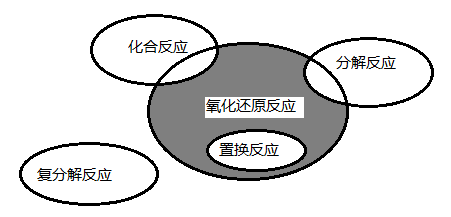 A.CO2+2Mg === C+2MgO
A.CO2+2Mg === C+2MgO
B.2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
C.2Na2O2+2CO2===2Na2CO3+O2
D.4Fe(OH)2+O2+2H2O===4Fe(OH)3
5.胶体和溶液、浊液的本质区别是
A、分散质粒子的大小 B、是不是一种稳定的体系
C、会不会产生丁达尔效应 D、粒子有没有带电荷
6.现有三组溶液:①汽油和氯化钠溶液;②39%的乙醇溶液;③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液 C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
7.实验室用MnO2催化KClO3分解制取氧气要分离提纯回收其中的MnO2,正确的操作步骤是
A.溶解、过滤、蒸发 B. 溶解、过滤、结晶
C. 溶解、过滤、洗涤、干燥 D.溶解、结晶、干燥
8. 下列实验操作中正确的是
| A | B | C | D | |
| 实验 | 分离植物油和氯化钠溶液 | 除去氯化钠晶体中混有的氯化钾晶体 | 分离CCl4中的Br2 | 除去CO2气体中的HCl气体 |
| 装置 或 仪器 | 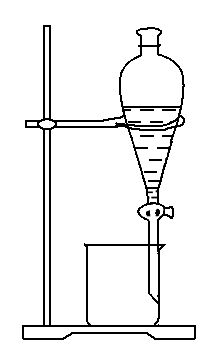 | 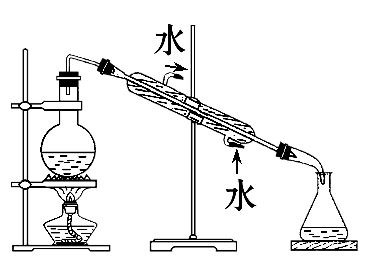 | 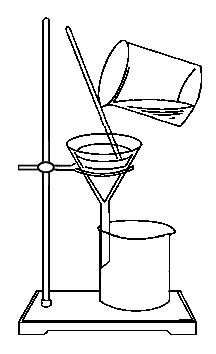 | 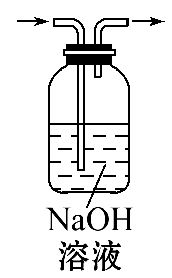 |
C.在常温常压下,11.2LCl2含有的分子数为0.5NA
D.标准状况下,11.2LH2O含有的分子数为0.5NA
11.在标准状况下,由CO和CO2组成的混合气体13.44 L,其质量为24g,此混合气体中CO和CO2的物质的量之比是( )
A.3∶7 B.3∶4 C.4∶7 D.1∶3
12.下列溶液与20mL 1 mol·L—1NaNO3溶液中NO3-物质的量浓度相等的是
A.10 mL 0.5 mol·L—1Cu(NO3)2溶液 B.5 mL 0.8 mol·L—1Al(NO3)3溶液
C.10 mL 2 mol·L—1AgNO3溶液 D.10 mL 1 mol·L—1Mg(NO3)2溶液
13.某溶液中仅含有Na+、Mg2+、SO42—、Cl—四种离子,其物质的量浓度比为
Na+∶Mg2+∶Cl—=3∶5∶5,若Na+的浓度为3 mol·L—1,则SO42—的浓度为
A.2 mol·L—1 B.3 mol·L—1 C.4 mol·L—1 D.8 mol·L—1
14.若20g密度为dg/cm3的硝酸钙溶液里含1gCa2+,则NO3-的物质的量浓度是
15.将标准状况下的aL氨气(NH3)溶于1000g水中,得到氨水的密度为bg·cm-3,则该氨水的物质的量浓度为
A.![]() mol·L-1B.
mol·L-1B.![]() mol·L-1C.
mol·L-1C.![]() mol·L-1D.
mol·L-1D.![]() mol·L-1
mol·L-1
16、同温同压下,等质量的O2和O3相比较,下列结论正确的是
A.它们的分子数目之比是 1∶1 B.它们的氧原子数目之比为 2∶3
C.它们的体积之比是 1∶1 D.它们的密度之比为 2∶3
17.为了除去氯化钾中含有的少量硫酸镁和氯化钙杂质,需进行下列六项操作,先后次序正确的是
①加水溶解 ②加热蒸发得到晶体 ③加入过量的氯化钡溶液
④加入适量的盐酸 ⑤加入过量碳酸钾和氢氧化钾 ⑥过滤
A.①④③⑤⑥② B.①⑤③④⑥② C.①③④⑥⑤② D.①③⑤⑥④②
第II卷(非选择题,共49分)
二.填空题(本大题共5小题,共42分)
18、(10分)科学家在研究化学物质时,常常对物质进行分类,以便对同类物质的组成和性能进行深入的研究。物质分类及转化思想贯穿整个化学科学习的始终。
(1)有下列十种物质:
A.空气 B.O2C.NaHSO4 D.氨水 E.CuSO4F.NaOH
G.CO2H.Fe2O3 I.金刚石 J.H2SO4
其中属于非电解质的有 ;属于盐的有 。(填字母)
(2)有下列六个反应:
资*源%库 高温
MnO2 △
E.H2+ Cl2===2HCl F.2KClO3====2KCl+3O2↑
其中既属于分解反应又属于氧化还原反应的是 (填字母)。
(3)K2FeO4是一种重要的净水剂,可用下列方法制得:
2Fe(OH)3+3Cl2+10KOH![]() 2K2FeO4+6KCl+8H2O
2K2FeO4+6KCl+8H2O
资*源%库在该反应中,还原剂是 (填化学式),当反应中有1mol K2FeO4生成时,
转移电子的数目为 。
19. (6分)物质的量是化学计算的核心。请按要求完成下列填空:
(1)已知3.01×1023个X气体分子的质量为8g,则X气体的摩尔质量是 。
(2)含0.4 mol Al3+的Al2O3的质量是 。
(3)某块光卤石(KCl·MgCl2·6H2O)中含5.3250 g Cl—,则该光卤石的物质的量为 。
20.(10分)(1)标准状况下,22.4 L CH4;②1.5 mol NH3;③1.806×1024个H2O;④标准状况下,73 g HCl。
所含H原子个数由多到少的顺序是(填写编号) 。
(2) 相同质量的SO2、SO3的物质的量之比为__ __;氧原子的个数之比为___ __。
(3)将100mL 0.25 mol ·L-1BaCl2溶液加水稀释至500mL,Cl-物质的量浓度 。
(4)已知6.95mol/L浓硫酸的密度为1.39g/cm3,则该硫酸的质量百分比浓度为 。
21.(8分) 要分离下列四组混合物
①饱和食盐水与沙子 ②从KNO3和NaCl的混合溶液中获得KNO3
③水和汽油的混合物
④CCl4液体与甲苯液体的混合物(已知CCl4与甲苯互溶,沸点分别为76.75 ℃和110.6 ℃)
(1)分离①的操作为____ ____。
(2)分离③时所使用仪器中有一种在其他组分离时无需使用,这种仪器是_____ ___。
(3)上述四组分离时需使用酒精灯的有____ ______和______ ______(填序号)。
22.(8分)(1)容量瓶上含有下列量中的(填写字母) 。
A、压强 B、温度 C、容积 D、密度 E、刻度线
(2)用浓硫酸配制250mL2mol∙L-1硫酸溶液时,所需的玻璃仪器除烧杯、玻璃棒和胶头滴管之外,还需要 (填仪器名称);在下列配制过程示意图中,有错误的是(填写序号) 。
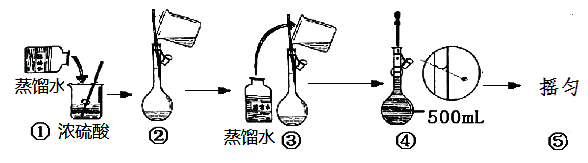
资*源%库(3)下列情况将使配制溶液的物质的量浓度偏低的有 (填序号)
A.容量瓶用蒸馏水洗净后未待干燥便用来配制 B.NaOH溶解后趁热移入容量瓶中
C.定容时,俯视刻度线 D.摇匀后发现液面未到刻度线,继续加水至刻度线
三、计算题(本大题共1小题,共7分)
23、(7分)取8.58 g Na2CO3·xH2O溶于水配成溶液,然后逐滴滴入质量分数为36.5%,密度为1.20g·cm-3的盐酸直至没有气体放出,用去盐酸5.0 mL。试计算:(写出计算过程)
⑴所用盐酸的物质的浓度;
⑵生成标况下CO2气体的体积;
⑶x的值。
南安一中2016~2017学年度上学期第二次阶段考
高一化学科试卷 参考答案
第I卷(选择题 共51分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| C | D | B | C | A | C | C | C | A |
| 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | |
| B | D | A | C | B | C | D | D |
第II卷(非选择题,共49分)
18.(10分)
①G CE ②F③Fe(OH)33×6.02×1023(每空2分)
19.(6分)
①16g/mol②20.4g③0.05mol(每空2分)
20.(10分)
(1)③>②>①>④
(2) 5:4;5:6
(3)0.1mol/L
(4)49%(各2分)
21.(8分)
(1)过滤。
(2)分液漏斗。
(3)②和③
22.(8分)
(1)BCE(2分,全对给2分,少写1个给1分,错写或少写2个不给分)
(2)量筒、250mL容量瓶(每个1分,容量瓶未写、错写规格都不给分)①④(2分)
(3)D(2分)
23.(7分)
(1)12mol/L(2分)
(2)0.672L(2分)
(3)10(3分)