广东实验中学2016—2017学年(下)高一级期中考试
化学
命题:吴玲审定:吴玲校对:方乐欣
注意:1.考试时间为90分钟,满分为100分。
2.试卷分为第Ⅰ卷(选择题)与第Ⅱ卷(非选择题)两部分。
3.选择题答案必须用2B铅笔在答题卡对应题号答题框内填涂,非选择题需在问卷指定位置作答。
可能用到的相对原子质量
H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 Si 28 S 32 Cl 35.5 Fe 56 Cu 64
第Ⅰ卷(选择题共40分)
一、选择题(本题包括20 小题,每小题只有一个选项符合题意,每小题2 分,共 40 分)
- 下列化学用语表示正确的是
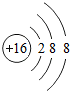 A.硫原子的结构示意图:B.次氯酸的结构式:H -O- Cl
A.硫原子的结构示意图:B.次氯酸的结构式:H -O- Cl
C.中子数为 的碳原子:
的碳原子: D.
D. 的电子式:
的电子式: 
- 下列各组中属于同位素关系的是
A. 与
与 B.T2O与H2O C.
B.T2O与H2O C. 与
与 D.金刚石与石墨
D.金刚石与石墨 - 科学家用含20个质子的钙的一种原子轰击含95个质子的镅原子成功合成第115号元素的原子,但该原子生成数微秒后衰变成第113号元素。下列有关叙述正确的是
A.115号元素在第六周期 B.113号元素在第七周期ⅢA族
C.115号和113号元素都是非金属元素 D.镅元素和115号元素不在同一周期 - 工业上用洗净的废铜屑作原料制备硝酸铜。为了节约原料和防止污染环境,宜采用的方法是
A.Cu+HNO3(浓) → Cu(NO3)2
B.Cu+HNO3(稀) →Cu(NO3)2
C.Cu (加空气) → CuO (加硝酸) →Cu(NO3)2
D.Cu (加浓硫酸)→ CuSO4(加硝酸钡) →Cu(NO3)2 - 下列叙述正确的是
A.Li在氧气中燃烧主要生成Li2O2
B.将SO2通入BaCl2溶液可生成BaSO3沉淀
C.水晶项链、光导纤维、玻璃、瓷器等都是硅酸盐制品
D.将CO2通入次氯酸钙溶液可生成次氯酸 - 下列物质中,含有非极性键的化合物是
A.CaCl2B.H2O2C.NH4Cl D.N2 - 铜粉放入稀硫酸溶液中,加热后无明显变化,但加入某盐一段时间后,发现铜粉质量减少,溶液呈蓝色,该盐可能是
A.NaCl B.Na2CO3C.KNO3D.FeSO4 - 下列五种有色溶液与SO2作用,均能褪色,其实质相同的是
①品红溶液 ②KMnO4酸性溶液 ③溴水 ④滴有酚酞的NaOH溶液 ⑤淀粉碘溶液
A.①④ B.①②③ C.②③⑤ D.②③④ - 向25mL 18.4mo1·L-1H2SO4溶液中加入足量的铜片并加热,充分反应后,被还原的H2SO4的物质的量是
A.小于0.23 mol B.等于0.23 mol $来&源:
C.0.23mol~0.46mol之间 D.等于0.46mol - 下列性质中,可以证明某化合物内一定存在离子键的是
A.可溶于水 B.具有较高的熔点
C.熔融状态能导电 D.水溶液能导电 - 下列物质熔化时,化学键未被破坏的是
A.食盐 B.干冰 C.二氧化硅 D.金属钠 - 下列有关实验事实的解释正确的是
A.实验室的浓硝酸呈现黄色,是因为浓硝酸具有强氧化性
B.铁粉投入同浓度的Cu(NO3)2和AgNO3混合液先析出Ag,说明Ag+氧化性比Cu2+强
C.常温下,将铝片放入浓硫酸中无明显现象,说明铝和冷的浓硫酸不反应
D.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有吸水性  用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的的是
用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的的是
- 下表是部分短周期元素的原子半径及主要化合价,根据表中信息,判断以下叙述正确的是
| 元素代号 | L | M | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | -2 |
A.L2+与R2-的核外电子数相等
B.M与T形成的化合物具有两性
C.R单质在氧气中燃烧生成XO3
D.L和M金属性强弱比较:M> L - 短周期元素的离子aW2+、bX+、cY2-、dZ-都具有相同的电子层结构,下列推断正确的是
A.原子半径:W>X>Z>Y B.热稳定性: H2Y>HZ
C.离子半径:W2+>Y2-D.碱性:XOH>W(OH)2 - 下列分子中所有原子都满足最外层为8电子结构的是
A.BeCl2B.H2O C.CCl4D.PCl5 - 如表所示的四种短周期元素W、X、Y、Z,这四种元素的原子最外层电子数之和为22。下列说法错误的是A.X、Y和氢形成的化合物中可能既有离子键、又有共价键
B.X、Y、Z三种元素最低价氢化物的沸点HZ最高
C.W元素的单质是良好的半导体材料,它与Z元素可形成化合物WZ4
D.物质W3X4中,每个原子最外层均达到8电子稳定结构  碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是
A.洗气瓶中产生的沉淀是碳酸钡
B.从Z导管出来的气体中无二氧化碳
C.洗气瓶中产生的沉淀是亚硫酸钡
D.在Z导管口有红棕色气体出现- 某元素的一种同位素X的原子质量数为A,含N个中子,它与1H原子组成HmX分子,在agHmX中所含质子的物质的量是
A.(A-N+m)molB.(A-N)mol
C.(A-N)molD.(A-N+m)mol - 某金属单质跟一定浓度的硝酸反应,假定只产生单一的还原产物。当参加反应的金属单质与被还原的硝酸的物质的量之比为2∶1时,还原的产物是
A.NO2 B.NO C.N2O D.N2
第II卷(非选择题共60分)
- (19分)下表是元素周期表的一部分,请用表中①~⑨的元素回答下列问题。
| 族周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 二 | | | | ① | ② | ③ | ④ |
| 三 | ⑤ | ⑥ | ⑦ | | | ⑧ | ⑨ |
(1)③、[④、⑤三种元素的简单离子按离子半径由大到小的顺序排列为 。
(用元素的离子符号表示)。
(2)④和⑨的氢化物中沸点较高的是 (填化学式),原因是 。
(3)①—⑨中元素的最高价氧化物对应水化物中碱性最强的是 (填化学式,下同),具有两性的是 ,两者反应的离子方程式为 。
(4)元素⑥与⑨形成的化合物中含有的化学键的类型是 ,用电子式表示形成过程为 。
(5)为证明⑧与⑨两种元素非金属性强弱,简单的实验方法是 ,实验现象是 ,化学方程式为 。
(6)⑨的单质在加热的条件下与浓氢氧化钠溶液反应,氧化产物与还原产物的物质的量之比为1:5则反应的离子方程式 。 - (13分)现有部分短周期的元素的相关信息如下表所示。
| 元素 | 相关信息 |
| X | 常温下单质为双原子分子,其氢化物的水溶液呈碱性 |
| Y | 原子最外层电子数比内层电子数多4 |
| Z | M层比K层少1个电子 |
| W | 其简单离子是第三周期元素的简单离子中半径最小的 |
填写下列空白:(提示:不能用字母X、Y、Z、W作答)
(1) X在周期表中的位置是 , 写出X单质的电子式 。
(2)元素Z与元素W相比,金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是 (填序号)。
a.Z单质的熔点比W单质低 b.Z的化合价比W低
c.Z单质与水反应比W单质剧烈 d.Z最高价氧化物的水化物的碱性比W强
(3)上述元素可形成含有非极性共价键的二元离子化合物,写出该化合物的化学式为 ,该化合物中阳离子与阴离子的个数比为 。
(4)实验室制备X的简单气态氢化物的化学方程式 。
(5)X、Y的氢化物X2H4、H2Y2在一定条件下反应可得到一种单质和常温下为液体的物质,试写出该反应的化学方程式 。 - (16分)如图是实验室制备气体和验证气体性质的装置图。

(1)仪器a的名称是_______________________。
(2)利用上图装置制备纯净、干燥的氯气。
①圆底烧瓶内发生反应的离子方程式为_______________________________。
②装置B中的溶液为____________________;烧杯中溶液的作用为________________。
(3)在上图所示圆底烧瓶内加入碳,a中加入浓硫酸,开始实验,加热产生的气体缓慢通过后续装置完成如下实验:
实验1:证明SO2的部分性质
实验2:证明碳酸的酸性比硅酸的酸性强
B、C、D中分别装有Ba(NO3)2溶液、足量酸性KMnO4溶液、品红溶液。
①写出B中发生反应的离子方程式 。
②D中应加入品红溶液的目的 ,E中应加入__________(填溶液名称),证明碳
酸的酸性比硅酸的酸性强的现象为____________________________,E中发生反应的离子方程式为
____________________________。
③为提高实验2的准确性,必须改进的装置为___________________。(填装置代号) - (12分)现取25.6g Cu与200ml某浓度的浓HNO3反应,当铜完全溶解后,收集到产生的NO和NO2混合气体在标准状况下的体积共11.2L,则:
(1)NO2的体积为 __________ L。
(2)反应中消耗HNO3的物质的量为 ____________mol。
(3)将盛有NO和NO2混合气体的容器倒扣在水中,容器内液面上升, 再通入标准状况下一定体积的O2,恰好使气体完全溶解,则通入O2的 体积是__________L。
(4)向溶液中加入500ml、4mol•L-1NaOH溶液,恰好使溶液中的Cu2+全部转化为沉淀,则原硝酸溶液的浓度为__________mol•L-1。

 用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的的是
用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的的是 碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是