
湖南省醴陵二中、醴陵四中2016-2017学年高二下学期期中联考化学试卷
03月05日
绝密★启用前
浙江省乐清国际外国语学校2014-2015学年高一下学期期末考试化学试题
| 题号 | 一 | 二 | 三 | 四 | 五 | 六 | 总分 |
| 得分 |
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请将答案正确填写在答题卡上
第I卷(选择题)
| 一、选择题(题型注释) |
1.对下列实验现象的解释不正确的是
| 选项 | 实验现象 | 解释 |
| A | C12使鲜艳的红色花瓣褪色 | Cl2具有强还原性 |
| B | NH3与HCl气体接触时有白烟产生 | NH3与HCl反应生成固体小颗粒 |
| C | 新切开的Na表面在空气中很快变暗 | Na容易与空气中的氧气等反应 |
| D | 氯化铝溶液中滴入过量的氢氧化钠溶液,白色沉淀溶解 | 氢氧化铝具有两性 |
2.下列关于稀有气体的说法,不正确的是
A.原子的电子排布最外层不都是以p6结束
B.化学性质非常不活泼
C.原子半径比同周期ⅦA族元素原子的大
D.其原子与同周期ⅠA、ⅡA族阳离子具有相同电子排布式
3.能鉴别CO2和SO2的试剂是
A.紫色石蕊试液B.氯化钡溶液
C.酸性高锰酸钾溶液D.澄清石灰水
4.下列不需要用到二氧化硅的是
A.光导纤维B.计算机芯片 C.石英钟表D普通玻璃
5.用等质量的金属钠进行下列实验,其中生成氢气最多的是()
A.把钠放入足量稀盐酸中B.将钠用铝箔包好并刺些小孔,再放入水中
C.把钠放入硫酸铜溶液中D.把钠放入足量水中
6.下列说法正确的是
A.![]() 和
和![]() 的中子数相同,所以
的中子数相同,所以![]() 和
和![]() 互为同位素。
互为同位素。
B.1molCH4与1molNH![]() 所含质子数相等
所含质子数相等
C.等物质的量的甲基(-CH3)与羟基(-OH)所含电子数相等
D.二氧化硫溶于水所得的溶液可导电,说明二氧化硫是电解质
7.下列关于胶体说法正确的是
A.胶体是纯净物
B.胶体、溶液和浊液的本质区别是能否产生丁达尔现象
C.胶体不带电荷
D.胶体分散质粒子的直径在10-9~10-7μm之间
8.下列有关Na2CO3和NaHCO3的说法,错误的是
A.都易溶于水B.水溶液都显碱性
C.都能与盐酸反应D.加热都能分解
9.下列说法不正确的是( )
A.工艺师可利用氢氟酸刻蚀石英制作艺术品,说明氢氟酸的酸性很强
B.水晶项链和光导纤维的主要成分是相同的
C.粗硅的制备及提纯单晶硅均涉及到氧化还原反应
D.我国自主研发的“龙芯1号”CPU芯片与神舟六号飞船使用的太阳能电池都用到硅
10.在标准状况下,将NO2、NO、O2混合并充满容器,然后把容器倒置于水槽中,充分反应后,水充满容器,则容器内HNO3的物质的量浓度的大小范围是()
A.![]() <c(HNO3)<
<c(HNO3)<![]() B.
B.![]() <c(HNO3)<
<c(HNO3)<![]()
C.![]() <c(HNO3)<
<c(HNO3)<![]() D.
D.![]() <c(HNO3)<
<c(HNO3)<![]()
11.下列离子方程式正确的是( )
A.利用醋酸溶解含碳酸钙的水垢:CaCO3+2H+=Ca2++H2O+CO2↑
B.用铜为电极电解饱和食盐水:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C.在明矾溶液中滴加过量氨水:Al3++4NH3·H2O=AlO2—+4NH4++2H2O
D.在小苏打溶液中加少量Ba(OH)2溶液:2HCO3—+Ba2++2OH-=BaCO3↓+2H2O+CO32—
12.研究表明:多种海产品体内含有+5价的砷(As)元素,对人体无毒,而砒霜的成分是As2O3,有剧毒;青菜中含有维生素C。专家忠告:不要同时大量食用海鲜和青菜,否则容易中毒。下面有关解释正确的是
A.As2O3中As元素为+3价B.维生素C能将+5价砷还原成As2O3
C.致人中毒过程中砷发生氧化反应D.维生素C具有氧化性
13.下列物质中,只含有离子键,不含有共价键的是
A.HClB.KOHC.CaCl2D.CO2
14.一定量的乙醇在氧气不足的情况下燃烧,得到CO、CO2和水的总质量为27.2g,若其中水的质量为10.8g。则CO的质量是
A.2.1g B.2.6g C.3.8g D.5.1g
15.下列各组物质中所含分子数一定相同的是()
A.5.6L N2和11g CO2 B.5g CO和5g H2
C.含1mol H原子的H2O和0.5mol Br2D.质子数相等的NH3和HCl
16.下表是元素周期表主族元素的一部分。
| Z | ||
| W | X | Y |
短周期元素W的最外层电子数是最内层电子数的2倍,Y单质可在空气中燃烧。下列叙述错误的是()
C.![]() D.
D.![]()
23.下列关于CO2与SO2说法不正确的是
A.都是无色气体 B.都是非电解质
C.通入Ba(OH)2溶液中都能产生白色沉淀D.都是形成酸雨的主要原因
24.短周期元素A、B、C的位置如图所示,已知B、C两元素的原子序数之和是A元素的4倍,则A、B、C依次是( )

A.Be、Na、Al B.C、Al、P
C.B、Mg、Si D.O、P、Cl
25.某溶液中含有的离子可能是K+、Ba2+、A13+、Mg2+、AlO2-、CO32-、SiO32-、Cl-中的几种,现进行如下实验:①取少量溶液加氢氧化钠溶液过程中无沉淀生成
②另取少量原溶液,逐滴加入5 mL0.2 mol·L-1盐酸,发生的现象是:开始产生沉淀并逐渐增多,沉淀量基本不变后产生气体,最后沉淀逐渐减少至消失。
③在上述②沉淀消失后的溶液中,再加入足量的硝酸银溶液可得到沉淀0.43 g。
下列说法中正确的是:
A.该溶液中一定不含Ba2+、Mg2+、A13+、SiO32-、Cl-
B.该溶液中一定含有K+、AlO2-、CO32-、Cl-
C.该溶液是否有K+需做焰色反应(透过蓝色钴玻璃片)
D.可能含有Cl-
26.下列判断正确的是:①任何物质在水中都有一定的溶解度②浊液用过滤的方法分离③分散系一定是混合物④丁达尔效应、布朗运动、渗析都是胶体的物理性质⑤同一种溶质的饱和溶液要比不饱和溶液浓些⑥布朗运动不是胶体所特有的运动方式⑦任何溶胶加入可溶性电解质后都能使胶粒发生聚沉⑧相同条件下,相同溶质的溶液,饱和溶液要比不饱和溶液浓些。
A、③⑥⑧B、②④⑥⑧⑦C、①②③④⑤D、全部不正确。
27.设NA为阿伏伽德罗常数,下列叙述正确的是()
A.24g镁的原子最外层电子数为NA
B.1L0.1mol/L乙酸溶液中H+数为0.1NA
C.1mol甲烷分子所含质子数为10NA
D.标准状况下,22.4L乙醇的分子数为NA
28.根据表中信息判断,下列选项不正确的是
| 序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
| ② | Cl2、FeBr2 | FeCl3、FeBr3 |
| ③ | MnO4—… | Cl2、Mn2+… |
A.第①组反应的其余产物为H2O和O2
B.第②组反应中Cl2与FeBr2的物质的量之比为1∶2
C.第③组反应中生成1 mol Cl2,转移电子2 mol
D.氧化性由强到弱顺序为MnO4—>Cl2>Fe3+>Br2
29.X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是
A.元素Y、Z、W形成的离子具有相同电子层结构,其离子半径依次增大
B.39g Z2Y2中含有的离子数约为1.204×1024
C.元素Z、R的氧化物的水化物之间相互反应生成的盐一定是正盐
D.元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR
30.下列各组离子能大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式正确的是

第II卷(非选择题)
| 二、填空题(40分) |
31.(4分)工业上用亚硫酸氢钠(NaHSO3)与碘酸钠(NaIO3)反应制备单质碘。试配平该反应的化学方程式,并标出电子转移的总数及方向。
![]()
32.(14分)短周期的三种元素X、Y、Z,原子序数依次变小,原子核外电子层数之和是5。X元素原子最外电子层上的电子数是Y和Z两元素原子最外电子层上的电子数的总和;Y元素原子的最外电子层上的电子数是它的电子层数的2倍,X和Z可以形成XZ3的化合物。请回答:
(1)X元素是________;Y元素是________;Z元素是:________。
(2)XZ3化合物的分子式是_________,电子式是_________。
(3)分别写出X、Y的含氧酸的分子式_________、_________。
33.(12分)①~⑩十种元素,在元素周期表中的位置如图所示。回答下列问题:
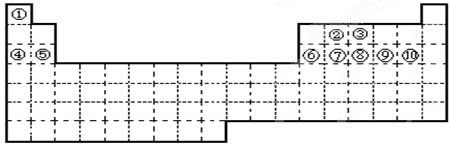
(1)在上述十种元素中,置换酸中氢的能力最强的元素为(填化学符号,下同);最高价氧化物的水化物的酸性最强的化合物的化学式是,碱性最强的化合物的化学式是,显两性的氢氧化物的化学式是;原子半径最大的元素是,半径最小的离子是。
(2)上述十种元素中,金属性最强的元素在周期表中的位置是第周期族,该元素的单质在空气中燃烧的化学方程式为。
(3)试用电子式表示元素①和③形成分子的过程。
34.(10分)O2和O3是氧元素的两种单质,根据其分子式完成下列各题:
(1)等质量的O2和O3所含分子个数比为__________,原子个数比为__________。
(2)等温等压下,等体积的O2和O3所含分子个数比为____,原子个数比为______,质量比为________。
(3)设NA为阿伏加德罗常数的数值,如果a g氧气中含有的分子数为b,则c g氧气在标准状况下的体积约是________(用含NA的式子表示)。
参考答案
1.A
【解析】
试题分析:A不正确,应该是利用氯气和水反应生成次氯酸具有强氧化性导致的,而不是氯气的还原性,其余选项都是正确的,答案选A。
考点:考查氯气、钠、氢氧化铝的性质
点评:该题是高考中的常见考点,试题基础性强。考查的知识点比较分散,但都很基础,学生只要熟练记住物质的化学性质,就不难得分。该题有助于培养学生分析问题、解决问题的能力。
2.D
【解析】
试题分析:A正确,例如He是1s2;稀有气体都满足稳定结构,化学性质稳定,B正确;C正确;D正确,其原子与下一周期ⅠA、ⅡA族阳离子具有相同电子排布式,答案选D。
考点:考查原子核外电子排布的有关判断
点评:该题是基础性试题的考查,主要是考查学生对原子核外电子排布的熟悉了解程度,旨在培养学生的基础,提高学生的学习能力。
3.C
【解析】
试题分析:A.CO2和SO2溶于水都显酸性,故都能使紫色石蕊试液变红,故A错误;B..CO2和SO2通入到氯化钡溶液中都无现象,故B错误;C.CO2不具有还原性,故不与高锰酸钾反应,但SO2具有还原性,能使高锰酸钾褪色,故C正确;D.CO2和SO2都能使澄清石灰水变浑浊,生成CaCO3和CaSO3沉淀,故D错误,此题选C。
考点:考查CO2和SO2的性质差别相关知识。
4.B
【解析】A正确,光导纤维的主要成分为二氧化硅;B错,计算机芯片的主要成分为硅;C正确,石英的成分为二氧化硅;D正确,玻璃的成分中含有二氧化硅;
5.B
【解析】
6.C
【解析】
试题分析:A、![]() 和
和![]() 的质子数相同,中子数不同,故A错误;B、CH4分子含10个质子,NH4+含11个质子,所以1molCH4与1molNH
的质子数相同,中子数不同,故A错误;B、CH4分子含10个质子,NH4+含11个质子,所以1molCH4与1molNH![]() 所含质子数不相等,故B错误;C、—CH3含有9个电子,—OH含有9个电子,所以等物质的量的甲基(-CH3)与羟基(-OH)所含电子数相等,故C正确;D、二氧化硫溶于水所得的溶液可导电,因为SO2与H2O反应生成电解质H2SO3,不能说明SO2是电解质,故D错误。
所含质子数不相等,故B错误;C、—CH3含有9个电子,—OH含有9个电子,所以等物质的量的甲基(-CH3)与羟基(-OH)所含电子数相等,故C正确;D、二氧化硫溶于水所得的溶液可导电,因为SO2与H2O反应生成电解质H2SO3,不能说明SO2是电解质,故D错误。
考点:本题考查原子结构、物质的量的计算、电解质的判断。
7.C
【解析】
试题分析:胶体是一种分散系,是混合物,故A项错误;分散系按照分散质粒子直径大小分为了胶体、溶液、浊液,故三者的本质区别为分散质粒子直径大小,故B项错误;某些胶体粒子为多分子聚集体,在形成过程中会包裹某些带电离子,故使胶体粒子带某种电荷,但胶体体系不带点,故C项正确;.胶体分散质粒子的直径在1nm~100nm之间,即10-3~10-1μm,故D项错误。
考点:胶体的性质考查。
8.D
【解析】所有钠盐都易溶于水,A对;B.碳酸根离子和碳酸氢根离子都会发生水解水溶液都显碱性,B对;C.都能与盐酸反应,生成CO2NaHCO3产生气体速度大于Na2CO3产生气体速度,C对;D.NaHCO3不稳定,加热易分解:2NaHCO3=(加热)Na2CO3+CO2↑+H20,Na2CO3加热不分解,D错误。选D.
9.A
【解析】A.错氢氟酸的酸性是弱酸,能与二氧化硅反应
B.对水晶项链和光导纤维的主要成分都是二氧化硅
C.对粗硅的制备及提纯单晶硅都有单质参加或单质生成,都是涉及到氧化还原反应
D.太阳能电池都用到硅
10.C
【解析】用极差法计算。若该气体由NO2和O2组成,按下式计算:
4NO2+O2+2H2O====4HNO3
4 4
![]() V/22.4
V/22.4![]() V/22.4
V/22.4
c(HNO3)=![]() =
=![]() mol·L-1
mol·L-1
若该气体由NO和O2组成,则按下式计算:
4NO+3O2+2H2O====4HNO3
4 3 4
![]() V/22.4
V/22.4![]() V/22.4
V/22.4
c(HNO3)=![]() =
=![]() mol·L-1
mol·L-1
由于是NO2、NO、O2三者的混合气体,故c(HNO3)的大小范围应是:![]() <c(HNO3)<
<c(HNO3)<![]() 。
。
11.D
【解析】 A项中醋酸应写为化学式;B项中铜为电极电解时铜参与反应;C项中Al(OH)3不能溶解在氨水中。
12.AB
【解析】
试题分析:维生素C具有还原性,+5价的砷能被维生素C还原为+3价。
考点:本题考查氧化还原反应。
13.C
【解析】
试题分析:离子键一般含金属元素或铵根离子,因此先排除A,D选项,而B选项中除含有离子键之外,还含有极性共价键。因此答案选C
考点:考查化学键的相关知识
14.A
【解析】
试题分析:根据题意,水的物质的量是10.8g/18g/mol=0.6mol,H元素的物质的量是1.2mol,乙醇的分子式为C2H6O,则C元素的物质的量是1.2mol/3=0.4mol,完全燃烧生成0.4mol的二氧化碳,质量为0.4mol×44g/mol=17.6g,现在二氧化碳和CO的总质量为27.2g-10.8g=16.4g,少生成17.6g-16.4g=1.2g,比较二氧化碳与CO的化学式可知,每生成1molCO,则少生成16g气体,所以CO的物质的量是1.2g/16g/mol=0.075mol,所以CO的质量是0.075mol×28g/mol=2.1g,答案选A。
考点:考查混合气体的计算
15.C
【解析】A、体积没有说明状态,B、摩尔质量不同,物质的量不等;C、相等;D、NH3中10个质子,HCl中有18个质子。
16.C
【解析】
做题思路:利用周期表的有限性做题,周期表的框架是死的,每个周期和族上的元素是有限的,满足题干框图的只能是周期表的第二第三周期,其次注意审清题,W在第三周期三个电子层最内层2个最外层是4个第二层8个所以是硅元素,则Z是碳元素,X是磷元素,Y是硫元素。选项A.Y的最高价氧化物的水化物是强酸为硫酸;选项B.W的最高价氧化物能溶于烧碱溶液为二氧化硅;选项C.Z的氧化物只有一种是错的,Z的氧化物可以是一氧化碳和二氧化碳;选项D.X的最高正价是+5价磷
17.D
【解析】
试题分析:SiO2不溶于水,不能和水化合生成硅酸。SiO2可以与HF反应。Na2SiO3的水溶液叫水玻璃,不是SiO2。答案选D。
考点:SiO2的性质
点评:本题比较简单,基础性强。
18.D
【解析】
试题分析:A.Y、Z是同一周期的元素。元素的原子序数越大,元素的非金属性就越强,其最高价氧化物对应水化物的酸性就越强。因此元素Z的最高价氧化物对应水化物的酸性比Y的强。错误。B.具有如图所示关系的元素情况比较多,可以是B、Al、Si、P;C、Si、P、S;也可以是N、P、S、Cl.因此该说法不准确。错误。C.同一周期的元素,原子序数越大,原子半径就越小。故原子半径的大小顺序为rW >rY>rX。错误。D.根据选项B的分析可知元素X可能为硼或碳或氮。正确。
考点:考查元素的推断及元素的原子半径的大小、形成的化合物的酸碱性的强弱的比较的知识。
19.D
【解析】在Cl2+2NaOH![]() NaCl+NaClO+H2O的反应中,1 mol Cl2参加反应转移电子数为NA,则A项错;在反应KIO3+6HI
NaCl+NaClO+H2O的反应中,1 mol Cl2参加反应转移电子数为NA,则A项错;在反应KIO3+6HI![]() KI+3I2+3H2O中,每生成3 mol I2转移的电子数为5NA,B项错误;不能根据还原产物的价态确定氧化剂氧化性的强弱,实际上氧化性:HNO3(浓)>HNO3(稀),C项错误;NO3—+H+具有强氧化性,能氧化Fe2+,D项正确。
KI+3I2+3H2O中,每生成3 mol I2转移的电子数为5NA,B项错误;不能根据还原产物的价态确定氧化剂氧化性的强弱,实际上氧化性:HNO3(浓)>HNO3(稀),C项错误;NO3—+H+具有强氧化性,能氧化Fe2+,D项正确。
20.A
【解析】硅胶的成分为硅酸。其他主要成分都为二氧化硅。
21.B
【解析】
试题分析:离子反应是有离子参加或生成的反应,发生反应的条件是电解质(必须是化合物和纯净物)在一定的条件下必须电离出能反应的离子,故③和⑤正确。复分解反应无单质参与,①错误。酸碱盐之间的离子反应没有氧化物参加,②错误。酸性氧化物或碱性氧化物与水反应生成相应的酸或碱,其离子反应中没有盐参与,④错误。
考点:离子反应
22.A
【解析】碳酸氢钠式弱酸的酸式盐,B不正确,应该是HCO3-+H+=CO2↑+H2O。氢氧化铝不溶于水,C不正确,应该是是Al(OH)3+3H+=Al3++3H2O。D中质量不守恒,应该是CaCO3+2H+=Ca2++CO2↑+H2O,所以答案选A。
23.D
【解析】二氧化碳并非酸雨的形成主要原因。所以D错误,应该选D。
24.D
【解析】
试题分析:根据短周期元素在周期表中的相对位置可知,A是第二周期元素。设A的原子序数是x,则B和C的原子序数分别为x+7、x+9,则x+7+x+9=4x,解得x=8,因此A、B、C分别为O、P、Cl三种元素,答案选D。
考点:考查元素周期表的结构、元素推断
25.B
【解析】
试题解析:①向溶液中加氢氧化钠溶液过程中无沉淀生成,说明溶液中一定不存在与氢氧化钠生成沉淀的离子:A13+、Mg2+;②向原溶液中逐滴加入5mL0.2mol•L-1盐酸,开始产生沉淀并逐渐增多,沉淀量基本不变后产生气体,最后沉淀逐渐减少至消失;滴加盐酸产生和溶解的沉淀为氢氧化铝,气体为二氧化碳,说明原溶液中存在AlO2-和CO32-,所以一定不存在不溶于盐酸的SiO32-和与CO32-反应的Ba2+,再根据溶液电中性可知:溶液中一定存在唯一的阳离子:K+;③在②沉淀消失后的溶液中,再加入足量的硝酸银溶液可得到沉淀0.43g,沉淀为AgCl,物质的量为:![]() ≈0.003mol;②中加入的氯离子的物质的量为:n(HCl)=0.2mol/L×0.005L=0.001mol<n(AgCl),所以原溶液中一定存在0.02mol Cl-,A、根据以上分析可知,溶液中一定不存在Ba2+、Mg2+、A13+、SiO32-,一定存在Cl-,故A错误;B、由分析可知:该溶液中一定含有K+、AlO2-、CO32-、Cl-,故B正确;C、根据溶液的电中性可以判断,溶液中一定存在钾离子,不需要通过焰色反应判断钾离子是否存在,故C错误;D、根据生成氯化银沉淀的物质的量可知,原溶液中一定存在氯离子,故D错误。
≈0.003mol;②中加入的氯离子的物质的量为:n(HCl)=0.2mol/L×0.005L=0.001mol<n(AgCl),所以原溶液中一定存在0.02mol Cl-,A、根据以上分析可知,溶液中一定不存在Ba2+、Mg2+、A13+、SiO32-,一定存在Cl-,故A错误;B、由分析可知:该溶液中一定含有K+、AlO2-、CO32-、Cl-,故B正确;C、根据溶液的电中性可以判断,溶液中一定存在钾离子,不需要通过焰色反应判断钾离子是否存在,故C错误;D、根据生成氯化银沉淀的物质的量可知,原溶液中一定存在氯离子,故D错误。
考点:离子的检验
【答案】A
【解析】酒精、H2SO4、HNO3能以任意比互溶①错;对乳浊液应通过分液的方法进行分离②错;渗析是一种分离方法,不属于胶体的物理性质,不能透过半透膜是胶体的物理性质④错;饱和溶液与不饱和溶液忽略了“一定温度”这一前提条件没有可比性⑤错;只有在相同条件下,相同溶质的溶液,饱和的要比不饱和的要浓⑧对;对不带电胶粒,如淀粉胶体,加入可溶性电解质后不聚沉⑦错。
27.C
【解析】
试题分析:A、24g镁为1mol,最外层电子为2NA,错误;B、乙酸为弱酸,所以1L0.1mol/L乙酸溶液中H+数小于0.1NA,错误;C、CH4分子含有10个质子,所以1mol甲烷分子所含质子数为10NA ,正确;D、标准状况下,乙醇为液体,22.4L乙醇的分子数不是NA,错误。
考点:本题考查阿伏伽德罗常数的综合应用。
28.D
【解析】
试题分析:A、根据所给反应物可知,高锰酸钾作氧化剂,过氧化氢作还原剂,所以过氧化氢被氧化为氧气,高锰酸钾被还原为锰离子,结合元素守恒,所以还有水生成,正确;B、由元素化合价可知,反应中只有亚铁离子被氧化,根据得失守恒2n(C12)=n(FeBr2),即n(C12):n(FeBr2)=1:2,正确;C、根据生成物可知反应物中含有Cl-,所以生成1mol氯气转移电子的物质的量是2mol,正确;D、根据氧化剂氧化性强于氧化产物氧化性,由③可知氧化性MnO4->Cl2,由②可知氧化性Cl2>Fe3+,由②可知Fe3+不能氧化Br-,氧化性Br2>Fe3+,错误,答案选D。
考点:考查氧化还原反应的分析,反应物、产物的判断,电子转移的计算,氧化性的比较
29.D
【解析】
试题分析:由题意知X为H元素,Y为O元素,R与Y处于同一族,R为S元素,Z、W、R处于同一周期,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等,所以Z、W分别为Na、Al。A、元素Y、Z、W形成的离子具有相同电子层结构,其离子半径应依次减小,错误;B、39g Na2O2的物质的量是0.5mol,阴离子为0.5mol,阳离子为1mol,所以含有的离子数约为1.5×6.02×1023=9.03×1023,错误;C、S与Na的氧化物的水化物之间相互反应生成的盐可能是正盐,也可能是酸式盐,错误;D、O的非金属性强于S的非金属性,所以H2O的热稳定性大于H2S的热稳定性,正确,答案选D。
考点:考查元素原子结构与元素周期律的关系
30.A
【解析】
试题分析:A.Fe2+能被硝酸氧化成Fe3+,正确;B.根据以少定多的原子,离子方程式为Ca2++HCO3-+OH-=CaCO3↓+CO2↑+H2O,错误;C.离子方程式为:2AlO2-+CO2+2H2O=2Al(OH)3↓+CO32-,错误;D.离子方程式为:3Al3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓错误;选A。
考点:考查离子共存,离子方程式的正误判断。
31.(4分)2 5 === 3 2 1 1

【解析】根据化合价可知亚硫酸氢钠中硫元素的化合价从+4价升高到+6价,作还原剂,失去2个电子。碘酸钠中碘元素化合价从+5降价降低到0价,是氧化剂,得到5个电子,所以根据电子得失守恒可知,方程式为2NaIO3+5NaHSO3=3NaHSO4+2Na2SO4+I2+H2O
32.(14分)(1)氮 N , 碳C,氢H
(2) NH3,![]() (3)HNO3;H2CO3
(3)HNO3;H2CO3
【解析】根据元素的电子层结构可知,X、Y、Z分别是N、C、H。氨气是还原极性键的共价化合物,电子式为![]() 。N和C对应含氧酸分别是HNO3、H2CO3。
。N和C对应含氧酸分别是HNO3、H2CO3。
33.(1)Na HClO4NaOH Al(OH)3 Na H+
(2)第三周期第IA;2Na+O2![]() Na2O2
Na2O2
(3)![]()
【解析】考查元素周期表的结构和元素周期律的应用。根据元素在周期表中的位置可知①~⑩分别是H、C、N、Na、Mg、Al、Si、P、S、Cl。同周期自左向右原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强。同主族自上而下原子半径逐渐增大,金属性逐渐增强,非金属性逐渐减弱。金属性越强最高价氧化物的水化物的碱性越强。非金属性越强,最高价氧化物的水化物的酸性越强,氢化物的稳定性越强。钠的燃烧产物是过氧化钠,氨气是由极性键构成的共价化合物。
34.(1)3:2 1:1 (2)1:1 2:3 2:3 (3)![]() L
L
【解析】
试题分析:(1)设其质量为m,等质量的O2和O3所含分子个数比=![]() NA:
NA:![]() NA=3:2,一个氧气分子中含有2个氧原子,一个臭氧分子中含有3个氧原子,所以其氧原子个数=(3×2):(2×3)=1:1;
NA=3:2,一个氧气分子中含有2个氧原子,一个臭氧分子中含有3个氧原子,所以其氧原子个数=(3×2):(2×3)=1:1;
(2)温同压下,气体摩尔体积相同,根据N=![]() NA知,等体积的O2和O3所含分子个数比是1:1,一个氧气分子中含有2个氧原子,一个臭氧分子中含有3个氧原子,所以原子个数之比是2:3,根据m=
NA知,等体积的O2和O3所含分子个数比是1:1,一个氧气分子中含有2个氧原子,一个臭氧分子中含有3个氧原子,所以原子个数之比是2:3,根据m=![]() M知,其质量之比等于其摩尔质量之比=32g/mol:48g/mol=2:3;
M知,其质量之比等于其摩尔质量之比=32g/mol:48g/mol=2:3;
(3)氧气的摩尔质量为M=m÷n= g/mol,则c g O2在标准状况下体积为:V=
g/mol,则c g O2在标准状况下体积为:V=![]() •Vm=
•Vm=![]() L。
L。
考点:考查常用化学计量数计算、阿伏伽德罗定律及推论