
湖南省醴陵二中、醴陵四中2016-2017学年高二下学期期中联考化学试卷
03月05日
上理工附中2015学年第一学期高二年级化学期中试卷
(I卷)命题:徐艳
可能用到的相对原子质量:H-1 O-16 C-12 Al-27 Fe-56 N-14
一、选择题(每小题2分,共80分,每小题只有一个正确选项)
1、在元素周期表中,金属元素和非金属元素分界线附近能找到:
A.制半导体元素 B.制农药元素
C.制催化剂元素 D.制耐高温合金的元素
2、某古玩爱好者收藏的“商代铝碗”在“鉴宝”时被专家当场否定,其理由是( )
A.铝的导热性较强,不易做碗
B.铝的质地较软,易变形,不易做碗
C.铝元素易导致老年痴呆,不易盛放食物
D.铝的性质较活泼,难提炼,商代不可能有铝制品
3、某元素的离子带2个单位正电荷,它的核外电子排布为 ,此元素在周期表中的
位置是:
A.第二周期零族 B.第三周期ⅡA族
C.第二周期ⅥA族 D.第三周期IIIA
4、下列化合物中,不能由两种单质直接化合制得的是:
A.FeS B.Al2S3C.Fe3O4D.FeCl2
5、下列各操作中,适宜用来制备氢氧化铝的是:
A.将氧化铝放入水中共热 B.将金属钠投入氯化铝溶液中
C.将足量氨水滴入氯化铝溶液中 D.将足量氢氧化钠溶液滴入氯化铝溶液中
6、把钠放入滴有酚酞试液的水中,下列现象不会出现的是( )
A.钠浮在水面上 B.钠熔化成小球
C.溶液中产生较多的气泡 D.水溶液变成红色
7、下列说法中,正确的是
A.第ⅠA族元素都是金属元素
B.第ⅣA族非金属元素的单质只能形成原子晶体
C.第ⅥA族元素形成的单质,常温下有气、液、固三种状态
D.元素性质呈现周期性变化的根本原因是元素原子最外层电子数呈现周期性变化
8、铝能用于冶炼难熔的金属,这是因为铝具有
A、两性 B、优良的导电性 C、低的熔点 D、还原性,且在冶炼反应中放出大量热
9、不能比较氮和氧非金属性相对强弱的是
A.氨气在氧气中燃烧生成氮气 B. NO中N为+2价,氧为-2价
C.沸点:H2O>NH3D.热稳定性:H2O>NH3
10.常温下,下列各组物质中,Y既能与X反应又能与Z反应的是
| X | Y | Z | |
| ① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
| ② | KOH溶液 | SiO2 | 浓盐酸 |
| ③ | O2 | N2 | H2 |
| ④ | FeCl3溶液 | Cu | 浓硝酸 |
A.①②④ B.①③④ C.①④ D. ②③
11.下列除杂方案错误的是
| 选项 | 被提纯的物质 | 杂质 | 除杂试剂 |
| A. | FeCl3(aq) | Al3+(aq) | NaOH溶液、盐酸 |
| B. | AlCl3(aq) | Cu2+ | Al粉 |
| C. | NaHCO3(aq) | Na2CO3(aq) | CO2气体 |
| D. | FeCl3(aq) | Cu2+ | Fe粉 |
12.三种非金属元素X、Y、Z,它们的原子半径由小到大的顺序为X
A.非金属性X
B.气态氢化物的热稳定性按X、Y、 Z顺序减弱
C.X、Y、Z的最高价氧化物对应水化物酸性由弱到强
D.X、Y、Z最外层电子数依次增大
13、主族元素R的最高价氧化物的化学式为R2O5,则它的气态氢化物的化学式是:
A.RH4B.RH3C.H2R D.HR
14、人体正常的血红蛋白应含Fe2+。若误食外表与食盐相近的亚硝酸盐,则导致血红蛋白中的Fe2+转化成Fe3+而中毒,服用维生素C可解除亚硝酸盐中毒,下列叙述中正确的是:
A.亚硝酸盐是还原剂 B.维生素C是还原剂
C.维生素C是氧化剂 D.亚硝酸盐被氧化
15、由下列反应:Cu+2FeCl3→2FeCl2+CuCl2,CuCl2+Fe→FeCl2+Cu,确定Fe2+、Fe3+、Cu2+的氧化性强弱顺序为
A、Fe2+>Cu2+>Fe3+B、Fe3+>CU2+>Fe2+
C、Fe3+>Fe2+>Cu2+D、Fe2+>Fe3+>Cu2+
16、下列关于铝热剂的有关叙述中正确的是:
A.利用铝热剂的反应,常用于冶炼高熔点的金属
B.氧化铝和铁的混合物是铝热剂
C.铝热剂发生的铝热反应需要用镁带和氯酸钾引燃,所以铝热反应是吸热反应
D.工业上常用铝热反应来大量冶炼金属铁
17、已知质量数为A的某阳离子Rn+, 核外有X个电子,则核内中子数为:
A.A-X B.A-X- n C.A-X+n D.A+X-n
18、某500 mL溶液中含01 mol Fe2+、02 mol Fe3+,加入02 mol铁粉,待Fe3+完全还原后,溶液中Fe2+的物质的量浓度为假设反应前后体积不变:
A.04 mol / L B.0.6 mol / L C.0.8 mol / L D.1.0 mol / L
19、下列离子方程式正确的是( )
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
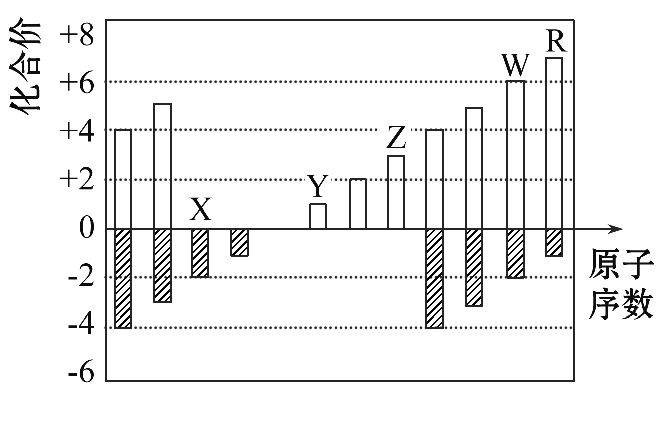 B.气态氢化物的稳定性: W>R
B.气态氢化物的稳定性: W>R| 元素代号 | 相关信息 |
| 甲 | n为电子层数,甲原子最外层电子数为(2n2-1) |
| 乙 | 在周期表中它的周期数为k,主族序数为(2k+1) |
| 丙 | 电子层数大于最外层电子数 |
C.Cu2+、Na+、SO42-、Cl- D.Ba2+、Na+、NO3-、Cl-
31.常温下,向下列各溶液中分别投入铁片,溶液质量变化最小的是( )
A.浓HNO3B.HClC.CuSO4D.AgNO3
32.只用一种试剂即可鉴别氯化镁、氯化铁、氯化亚铁、氯化铵、氯化钠这五种溶液,该试剂是( )
A. KSCN B.BaCl2 C. HCl D.NaOH
33.下列各组物质中,化学键类型相同,晶体类型也相同的是( )
A. NaCl和Mg B. NH4Cl和NH3 C. Cu和Hg D. CO2和SiO2
34. 浅绿色的Fe(NO3)2溶液中存在如下平衡:Fe2++2H2O![]() Fe(OH)2+2H+,若向该溶液中滴加足量盐酸,则溶液的颜色( )
Fe(OH)2+2H+,若向该溶液中滴加足量盐酸,则溶液的颜色( )
A. 变黄 B. 绿色更深 C. 绿色更浅 D. 无变化
35、铁和下列物质反应,能生成+3价铁元素的是( )
①O2 ②S ③HCl ④CuCl2⑤HNO3 ⑥溴 ⑦H2O
A.①②⑤ B.①⑥ C.①⑤⑥⑦ D.①⑤⑥
36.把铁与铜的混合物放入稀HNO3中,反应后过滤,滤出的固体物质投入盐酸中无气体放出,则滤液里一定含有的金属盐是( )
A.Cu(NO3)2B.Fe(NO3)3C.Fe(NO3)2D.Fe(NO3)2和Cu(NO3)2
37.a、b、c、d、e分别是Cu、Ag、Fe、Al、Mg五种金属中的一种。已知:①a、c均能与稀硫酸反应放出气体;②b与d 的硝酸盐反应,置换出单质d;③c与强碱反应放出气体;④c、e在冷浓硝酸中发生钝化。由此判断a、b、c、d、e分别是 ( )
A Fe、Cu、Al、Ag、Mg B Al、Cu、Mg、Ag、Fe
C Mg、Ag、Al、Cu、Fe D Mg、Cu、Al、Ag、Fe
38、准确称取6 g铝土矿样品(含Al2O3、Fe2O3、SiO2)放入盛有100 mL某浓度硫酸溶液的烧杯中,充分反应后过滤,向滤液中加入10 mol·L-l的NaOH溶液,产生的沉淀质量m与加入的NaOH溶液的体积V的关系如图所示,则所用硫酸溶液的物质的量浓度为( )

A.3.50mol/L B.1.75mol/L C.0.85mol/L D.无法计算
39.向一定量的Fe、FeO、Fe2O3的混合物中,加入100mL 1mol/L的盐酸,恰好使混合物完全溶解,放出224mL(标准状况)的气体,所得溶液中,加入KSCN溶液无血红色出现。若用足量的CO在高温下还原相同质量的混合物,能得到铁的质量为( )
A.2.8gB.5.6gC.11.2gD.无法计算
40.已知:2NaAlO2+ 3H2O +CO2→2Al(OH)3↓+Na2CO3。向含2molNaOH、 1 mol Ba(OH)2、2 mol
NaAlO2的混合溶液中慢慢通入CO2,则通入CO2的量和生成沉淀的量关系正确的是
| 选项 | A | B | C | D |
| n(CO2)mol | 2 | 3 | 4 | 6 |
| n(沉淀) mol | 2 | 2 | 3 | 3 |
上理工附中2015学年第一学期高二年级化学期中试卷
(II卷)
| I卷 | II卷 | 总分 |
温馨提示:本卷选择题全部写在答题卡上,以下是非选择题部分,本页兼答题纸。
二、填空题(本题共20分)
41、A、B、C、D、E、F六种短周期主族元素,原子序数依次增大,A、B、F三者原子序数之和为25,且知B、F同主族,1.8g E与足量的盐酸反应生成ECl3和2.24L氢气(标准状况下),D+和E的离子具有相同的电子层结构,工业上用电解元素B和E能形成离子化合物的方法冶炼E单质,试判断:
(1)、六种元素中非金属性最强的是 (填代号),该元素位于周期表中第 周期第 族;
由A、B、D三种元素形成化合物的电子式
(2)、下列能够说明B、F非金属性强弱的方法有
a.最高价氧化物对应水化物酸性 b.气态氢化物的热稳定性
c.气态氢化物的沸点B比F高 d.向F的气态氢化物溶液中通入B单质,有浑浊
(3)、写出下列反应的化学方程式
①E与足量的盐酸反应的化学方程式
②写出足量D的最高价氧化物对应水化物与ECl3相互反应的离子方程式
42、黑色粉末A,黄色粉末B,它们都是单质,按下图进行实验:
A D E H
(2)写出C+盐酸 D+F的离子方程式:
(3)写出D E的化学方程式:
(4)写出G H的化学方程式:_______________________________________
一、选择题(每小题2分,共80分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| A | D | B | D | C | C | D | D | C | C |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| D | B | B | B | B | A | B | C | D | D |
| 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
| C | D | B | D | A | B | D | A | B | D |
| 31 | 32 | 33 | 34 | 35 | 36 | 37 | 38 | 39 | 40 |
| A | D | C | A | C | C | D | B | A | C |
二、填空题(共20分)
41、(1)C(2分) 第二周期ⅦA(1分) ![]() (1分)
(1分)
(2)、bd(2分)
(3)、①2Al+6HCl→ 2AlCl3+3 H2↑(2分)
②4OH—+ Al3+→ AlO2—+ 2H2O(2分)
42、(1) Fe H2S SO2Fe(OH)3
(2) FeS+2H+→Fe2++H2S↑
(3) 2H2S+3O2→2SO2+2H2O(条件:点燃)
(4) 4Fe(OH)2+O2+2H2O→4Fe(OH)3