
湖南省醴陵二中、醴陵四中2016-2017学年高二下学期期中联考化学试卷
03月05日
宁波诺丁汉大学附属中学
2016-2017学年度第一学期期中考试
[高二]年级 [化学]试题卷
答卷时间:[90min] 满分:[100分] 命题人:[滕瑛巧] 校对人:[陈建如]
可能用到的相对原子质量:H-1 O-16 N-14 Na-23 Al-27 Fe-56 S-32 Cu-64
选择题部分
一、选择题(本大题共25小题,每小题2分,共50分。每小题列出的四个备选项中只有一个符合要求,不选、多选、错选均不得分)
1.下列属于碱性氧化物的是
A.SO2 B.CaO C.CO D.NaOH
2.配制一定物质的量浓度的溶液不需要用到的仪器是

3.下列属于电解质并能导电的物质是
A.淀粉 B.KNO3溶液 C.FeCl3晶体 D.熔融的Na2O
4.下列反应中,水作氧化剂的是
A.C+H2OCO+H2B.H2+CuOCu+H2O
C.Cl2+H2O![]() HCl+HClOD.SO3+H2O====H2SO4
HCl+HClOD.SO3+H2O====H2SO4
5.下列物质的水溶液不发生水解的是
A.NH4Cl B.NaClO C.KHCO3D.KI
6.下列物质的保存方法中,不正确的是
A.液氯储存在钢瓶中
B.金属钠保存在石蜡油或煤油中
C.硫酸亚铁溶液存放在加有少量铁粉的细口瓶中
D.氢氧化钠溶液盛装在玻璃塞的试剂瓶中
7.下列说法不正确的是
A.钠是一种强还原剂,可用于制取钛、铌等金属
B.镁燃烧发出耀眼的白光,常用于制造信号弹和焰火
C.可用丁达尔效应区分氢氧化铁胶体和氯化铁溶液
D.石英玻璃、水晶、分子筛的主要成分都是二氧化硅
8.下列化学用语表示正确的是
A.37Cl原子结构示意图 B.NaCl的电子式
B.NaCl的电子式![]()
C.CO2分子的结构式O—C—O D.CH4分子的比例模型:![]()
9.下列说法不正确的是
A.溴单质是深红棕色、密度比水大的液体,易挥发
B.工业上以氯气和石灰乳为原料制取漂白粉
C.海水中碘的总储藏量很大,目前工业上直接由海水提取碘
D.工业炼铁的原料有铁矿石、焦炭、空气和生石灰
10.下列说法正确的是
A.蒸馏操作时,应使温度计水银球插入蒸馏烧瓶的液体中
B.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
C.用铂丝蘸取某溶液置于酒精灯火焰上灼烧,直接观察火焰颜色,检验K+的存在
D.检验NH4+时,往试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气体
11.下列说法不正确的是
A.11H2和21H2互为同位素 B.红磷和白磷互为同素异形体
D.14CO2的摩尔质量为46g·mol-1C.C5H12的同分异构体有3种
12.下列说法正确的是
A.煤的干馏是化学变化,而煤的气化与液化是物理变化
B.豆浆中富含大豆蛋白,煮沸后蛋白质水解成了氨基酸
C.油脂是人体中热值最高的营养物质,在工业上可用于制肥皂和油漆
D.若化学反应中反应物总能量大于生成物总能量则反应为吸热反应
13.在一定温度下,将2 mol SO2和1 mol O2充入一定容积的密闭容器中,在催化剂作用下发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-197 kJ·mol-1,当达到化学平衡时,下列说法中正确的是
2SO3(g) ΔH=-197 kJ·mol-1,当达到化学平衡时,下列说法中正确的是
A.正逆反应速率相等,且都为零 B.SO2和SO3共2 mol
C.放出197 kJ热量 D.生成SO3 2 mol
14.下列离子方程式正确的是
A.碳酸钙与醋酸反应:CO32-+2CH3COOH=CO2↑+H2O+2CH3COO-
B.用氢氧化钠溶液吸收少量二氧化硫气体:SO2+2OH- === SO+H2O
C.硫酸铝溶液与氨水反应:Al3++3OH- = Al(OH)3
D.向NH4HCO3溶液中加过量的NaOH溶液:2NH4++ OH- === NH3↑+ 2H2O
15.![]() 右图为元素周期表中短周期元素的一部分,下列关于X、Y、Z、W的说法正确的是
右图为元素周期表中短周期元素的一部分,下列关于X、Y、Z、W的说法正确的是
A.离子半径大小:W->Z2->Y2-
B.由X元素形成的单质一定是原子晶体,其熔沸点很高
C.X、Z、W三种元素形成的气态氢化物中最稳定的是W的气态氢化物
D.Y、Z的最高价氧化物的水化物的酸性为:Y>Z
16.下列关于苯的说法不正确性的是
A.苯分子中所有原子都在同一平面
B.苯在空气中不易完全燃烧,燃烧时冒浓烟
C.煤干馏得到的煤焦油中可以分离出苯,苯是无色无味的液态烃
D.苯不能使溴水和酸性高锰酸钾溶液褪色,说明苯分子中不存在碳碳双键
17.下列说法正确的是
A.埃博拉病毒对化学药品敏感,乙醇、次氯酸钠溶液、双氧水均可以将病毒氧化而达到消毒的目的
B.植物秸杆的主要成分是纤维素,纤维素在催化剂作用下经水解可得葡萄糖,葡萄糖在酒化酶的作用下能转化为酒精
C.往含硫酸的淀粉水解液中加入银氨溶液,水浴加热后无银镜产生,说明淀粉未水解
D.皂化反应结束后的混合液中加入饱和食盐水,再通过分液操作分离出硬脂酸钠
18.为充分利用海洋资源,研究人员发明海水电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列说法错误的是
A.负极反应式:Ag+Cl-﹣e-=AgCl
B.Cl—不断向电池的正极移动
C.每生成1mol Na2Mn5O10转移2mol电子
D.电子由负极流出经外电路流入正极
19.反应4NH3(g)+ 5O2(g)==4 NO(g)+ 6H2O(g)在5 L的密闭容器中进行,半分钟后,NO的物质的量增加了0.3 mol,则此反应的平均速率v(X)为
A.v(O2)=0.01mol·L-1·s-1B.v(NO)=0.008 mol·L-1·s-1
 C.v(H2O)=0.003 mol·L-1·s-1D.v(NH3)=0.0025 mol·L-1·s-1
C.v(H2O)=0.003 mol·L-1·s-1D.v(NH3)=0.0025 mol·L-1·s-1
20.下列说法正确的是
$来&源:A.碘升华时需要克服分子间作用力和共价键
B.某物质在熔融态能导电,则该物质中一定含有离子键
C.N2和Cl2两种分子中,每个原子的最外层都具有8电子稳定结构
D.NaCl和HCl溶于水都电离出Cl-,故它们都存在离子键
21.常温下,现有体积相同、pH均为2的盐酸和醋酸溶液,下列说法不正确的是
A.盐酸中的c(Cl-)与醋酸溶液中的c(CH3COO-)相等
B.分别与足量CaCO3反应,放出的CO2一样多
C.分别用水稀释相同倍数,n(Cl-)<n(CH3COO-)
D.分别将两溶液升温至80℃,醋酸溶液的pH变小,盐酸的pH不变(不考虑挥发)
22.下列各图中,表示Ba(OH)2(s)+2NH4Cl(s)==BaCl2(s)+2NH3(g)+2H2O(l)能量变化的是

23.NA代表阿伏加德罗常数,下列说法正确的是
A.常温常压下,14g N2含有NA个原子
B.标准状况下,11.2L乙醇所含的分子数为0.5NA
资*源%库 C.1mol Na被完全氧化生成Na2O,失去2NA个电子
D.1L 1mol·L-1CH3COONa溶液中含有CH3COO—的数目为NA
资*源%库 24.已知氧化性Br2>Fe3+。向含溶质a mol的FeBr2溶液中通入b mol Cl2,充分反应。下列说法不正确的是
A.离子的还原性强弱:Fe2+>Br->Cl-
B.当a≥2b时,发生的离子反应:2Fe2++Cl2=2Fe3++2Cl-
C.当a=b时,反应后的离子浓度:c(Fe3+)︰c(Br-)︰c(Cl-)=1︰2︰2
D.当3a≤2b时,发生的离子反应:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
25.已知:Ag2SO4微溶于水,可溶于硝酸。溶液X中可能含有Na+、Ca2+、Fe2+、Cl-、Br-、CO、SiO、SO中的几种离子。为了确定其组成,某同学进行了如下实验:

下列说法正确的是
A.溶液X中一定含有Na+、Cl-和SiO
B.溶液X中一定不含Ca2+、Br-
资*源%库 C.为确定溶液X中是否含有SO,可取溶液2,加入BaCl2溶液
D.在溶液X中依次滴入盐酸、双氧水和硫氰化钾溶液后,溶液将变为红色
非选择题部分
二、非选择题(本大题共5小题,共50分)
$来&源:26.(10分)
(1)能源是人类生活和社会发展的基础,地球上最基本的能源是▲。
氢气被人们看作理想的绿色能源,己知氢气的热值是143kJ·g-1(热值指的是在一定条件下单位质量的物质完全燃烧所放出的热量,氢气转化为液态水。)请写出氢气燃烧的热化学方程式▲。
(2)在298 K、100 kPa时,已知:
2H2O(g)===O2(g)+2H2(g) ΔH1
Cl2(g)+H2(g)===2HCl(g) ΔH2
2Cl2(g)+2H2O(g)===4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2间的关系是_____▲_______。
(3)电化学是研究化学能与电能相互转化的装置、过程和效率的科学。
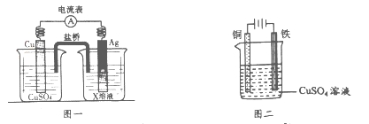
①根据氧化还原反应:2Ag+(aq)+Cu(s)===2Ag(s)+Cu2+(aq),设计的原电池如图一所示,
X溶液时______▲____溶液(填“CuSO4”或“AgNO3”);
②图二装置在铁件上镀铜,铁作阴极,则铜极上的电极反应是________▲_________。
H2O/催化剂
A
C2H6O
B
③
浓硫酸/△
C
①

KMnO4(H+)

②
己知有机物的性质主要由所含的官能团决定,请回答:
资*源%库 (1)B中官能团的名称是___▲_____。
(2)①的反应类型是____▲___。
(3)写出反应③的化学方程式________▲__________。
(4)下列说法正确的是___▲____。
A.A物质可通过石油分馏得到的石油气中获取
B.相同条件下B与钠反应比水与钠反应更剧烈
C.酸性高锰酸钾溶液能与A发生氧化反应而褪色
D.常温下,C难溶于水
28(8分)有关物质的转化关系如下图所示(部分物质和条件已略去)。A是海水中含量最多的盐,B、E、F是气体单质,C是金属单质,X是能使湿润红色石蕊试纸变蓝的气体,Y是最常见的无色液体。

请回答下列问题:
(1)X的化学式为▲。
(2)E的电子式为▲。
(3)写出C与Y反应的化学方程式:▲。
(4)写出D溶液与G溶液反应的离子方程式:▲。
29.(10分)某化学兴趣小组利用工厂的铁和铜混合屑末,进行如下实验:

(1)操作X的名称是▲;用到的玻璃仪器有▲;
(2)A与Cl2混合光照可能发生爆炸,A在该反应中作__▲__(填“氧化剂”或“还原剂”)。
(3)写出反应②的化学方程式________▲_______
(4)检验溶液B中阳离子的实验步骤、现象及结论▲。
30.(共14分)乳酸亚铁([CH3CH(OH)COO]2Fe·3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:
CH3CH(OH)COOH+FeCO3+2H2O→[CH3CH(OH)COO]2Fe·3H2O+CO2↑。
已知FeCO3易被氧化:4FeCO3+6H2O+O2=4Fe(OH)3+4CO2
某兴趣小组用FeCl2(用铁粉和稀盐酸制得)和NH4HCO3制备FeCO3的装置示意图如下:

回答下列问题:
(1)NH4HCO3盛放在装置▲中(填字母),该装置中涉及的主要反应的离子方程式▲。
(2)将生成的FeCl2溶液和NH4HCO3溶液混合时的操作是▲。
(3)将制得的FeCO3加入到足量乳酸溶液中,再加入少量铁粉,75℃下搅拌反应。铁粉的作用是▲。反应结束后,无需过滤,除去过量铁粉的方法是▲。
(4)该兴趣小组用KMnO4法测定样品中亚铁含量进而计算产品中乳酸亚铁的质量分数,发现产品的质量分数总是大于100%,其原因可能是▲。
经查阅文献后,该兴趣小组改用铈(Ce)量法测定产品中Fe2+的含量。取2.880g产品配成100mL溶液,每次取20.00mL,进行必要处理,用0.1000mol·L-1Ce(SO4)2标准溶液滴定至终点,平均消耗Ce(SO4)219.70mL。滴定反应如下:
Ce4++Fe2+=Ce3++Fe3+
则产品中乳酸亚铁的质量分数为▲2016-2017学年度第一学期期中考试
[高二][化学]参考答案
一、单选题(本题包括25小题,每小题2分,共50分。每小题中只有一个选项符合题意)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 选项 | B | A | D | A | D | D | D | A | C | B |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 选项 | A | C | B | B | C | C | B | B | C | C |
| 题号 | 21 | 22 | 23 | 24 | 25 | |||||
| 选项 | B | A | A | C | B |
二、非选择题(共5个小题,共50分,每空两分)
26(10分)
(1)太阳能 2H2(g)+O2(g)= 2H2O(l) △H= -572KJ·mol-1(2)ΔH3=ΔH1+2ΔH2
(3)AgNO3Cu-2e-=Cu2+
27(8分)
(1)羟基(2)加成反应 (3)![]() (条件不写扣1分)
(条件不写扣1分)
(4)CD
28(8分)
(1)NH3(2)![]() (3)2Na+2H2O=2NaOH+H2↑
(3)2Na+2H2O=2NaOH+H2↑
(4)NH4++OH-=△=NH3↑+H2O
29(10分)(1)过滤,漏斗、玻璃棒、烧杯(2)还原剂(3)Cu+2H2SO4(浓) =△=CuSO4+SO2↑+2H2O
(4)取少量溶液B于试管中,先加入KSCN溶液不显红色,再通入Cl2,溶液变红,证明含有Fe2+
30(共14分)
(1)装置C(2分) Fe2+ + 2HCO3-=FeCO3↓+ CO2 ↑ + H2O(2分)
(2)(待D处的气体纯净后)关闭活塞3、打开活塞2(2分)
(3)防止+2价的铁元素被氧化(2分) 加入适量乳酸让铁粉反应完全(2分)
(4)乳酸根离子被酸性KMnO4氧化(2分,或其他合理答案) 98.50%(2分)