
湖南省醴陵二中、醴陵四中2016-2017学年高二下学期期中联考化学试卷
03月05日
东北育才学校高中部高三第三次模拟考试化学科试题
命题校对:高三备课组 总分:100分 时间:90分钟
可能用到的原子量:H:1 C:12 N:14 O:16 Na:23Mg:24 Al:27 Cu:64 Fe:56
第Ⅰ卷选择题(共54分)
一、选择题(本题共18个小题,每题只有一个选项符合题意,每题3分,共54分)
1.化学与生活、社会发展息息相关,下列有关说法不正确的是( )
A.“青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化
B.“霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应
C.“熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应
D.向豆浆中加入盐卤(主要成分为MgCl2)可制作豆腐,利用了胶体聚沉的性质
2.下列有关化学药品的存放说法不正确的是( )
A.液溴易挥发,应用少量的水液封并放在冷暗处保存
B.硝酸见光易分解、易挥发,应用棕色广口试剂瓶玻璃塞密封保存
C.金属钠遇到氧气和水均立即反应,应保存在煤油中或者液体石蜡里
D.碳酸钠虽然属于盐,但是其水溶液呈碱性,应用带橡胶塞的试剂瓶保存
3.下列物质性质与应用对应关系正确的是( )
A.浓硫酸具有吸水性,可用于干燥CO2
B.硅有导电性,可用作光导纤维
C.铝具有高熔点,可用于生产耐火砖
D.氨气具有还原性,可用于检查HCl泄漏
4. 下列各组离子在指定溶液中一定能大量共存的是( )
A.加入金属镁产生H2的溶液中:NH4+、Na+、SO42-、C2O42-
B.甲基橙呈红色的溶液:NH4+、Cu2+、Cl¯、SO42¯
C.无色溶液中:K+、AlO2¯、Cl¯、HCO3¯
D.含有大量MnO4-的溶液中:H+、SO42-、Cl-、CH3CH2OH
5.某研究性学习小组讨论甲、乙、丙、丁四种仪器装置的有关用法,其中不合理的是
A.甲装置:可用来证明碳的非金属性比硅强
B.乙装置:橡皮管的作用是能使水顺利流下
C.丙装置:用图示的方法不能检查此装置的气密性
D.丁装置:先从①口进气集满CO2,再从②口进气,可收集NO
6.三种气体X、Y、Z的相对分子质量关系为Mr(X)
A.原子数目相等的三种气体,质量最大的是Z
B.相同条件下,同质量的二种气体,气体密度最小的是X
C.若一定条件下,三种气体体积均为2. 24 L,则它们的物质的量一定均为0.1mol
D.同温下,体积相同的两容器分别充2gY气体和l g Z气体,则其压强比为2:1
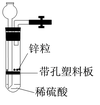 7.有一兴趣小组准备在实验室中制H2,装置如图所示。可是在实验室中发现酸液不足而又无其他酸液可加入。为达到实验目的,可以从长颈漏斗中加入适量的试剂是
7.有一兴趣小组准备在实验室中制H2,装置如图所示。可是在实验室中发现酸液不足而又无其他酸液可加入。为达到实验目的,可以从长颈漏斗中加入适量的试剂是
①NaNO3溶液;②酒精;③CCl4;④苯;⑤Na2CO3溶液;⑥KCl溶液。
A.①②③ B.②④⑤ C.①②④⑥ D.②③⑥
8.下图是部分短周期主族元素原子半径与原子序数的关系图。下列说法正确的是()
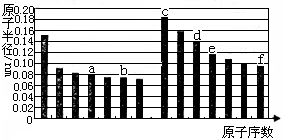
A.b、d两种元素的离子半径相比,前者较大
B.a的单质在高温条件下能置换出e的单质,说明非金属性a C.由b、e两种元素组成的化合物能溶解于强碱溶液,但不能与酸溶液反应 D.由c、d分别与f组成的化合物中的化学键类型相同 9.设NA为阿伏加德罗常数的数值,下列说法正确的是( ) A.23g Na与足量H2O反应完全后可生成NA个H2分子 B.1 mol乙烯分子含有2NA碳碳双键 C.标况下,22.4LN2和H2混合气中含NA个原子 D.标况下,22.4LCl2与足量Fe和Cu混合物点燃,反应后,转移的电子数为2NA个 10.下列反应的离子方程式正确的是() A.用石墨作电极电解AlC13溶液:2Cl-+2H2O B.酸性高锰酸钾溶液与H2O2溶液混合:2MnO4-+ 3H2O2 + 6H+ = 2Mn2+ + 4 O2↑+6H2O C.向NaHSO4溶液中滴加Ba(OH)2溶液至不再产生沉淀: Ba2+ + OH- + H+ + SO42- = BaSO4↓+ H2O D.向Ca(HCO3)2溶液中加入足量Ca(OH)2的溶液: Ca2++2HCO3-+2OH-=2H2O+CaCO3↓+ CO32- 11.某离子反应涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中c(NH4+)随反应进行逐渐减小。下列判断正确的是( ) A.反应的还原产物是N2B.消耗1 mol氧化剂,转移电子3 mol C.氧化剂与还原剂的物质的量之比为2:3 D.反应后溶液的酸性明显增强 12.大功率的镍氢电池使用在油电混合动力车辆中。镍氢电池NiMH电池正极板材料为NiOOH,负极板材料为吸氢合金,下列关于该电池的说法中正确的的是 () A.放电时电池内部H+向负极移动 B.充电时,将电池的负极与外接电源的正极相连 C.充电时阳极反应为Ni(OH)2+ OH-- e-====NiOOH+H2O D.放电时负极的电极反应式为MHn-ne- = M+nH+ 13.下列各组物质之间通过一步就能实现如图所示转化的是 () 资*源%库 A.①② B.②③ C.②④ D.①③ 14.一定温度时,向2.0 L恒容密闭容器中充入2 mol SO2和1 mol O2,发生反应: 2SO2(g)+O2(g) 下列说法正确的是() A.反应在前2 s 的平均速率v(O2) = 0. 4 mol·L-1·s-1 B.保持其他条件不变,体积压缩到1.0 L,平衡常数将增大 C.相同温度下,起始时向容器中充入4 mol SO3,达到平衡时,SO3的转化率小于10% D.保持温度不变,向该容器中再充入2 mol SO2、1 mol O2,反应达到新平衡时n(SO3)/n(O2)减小 15.已知NH4CuSO3与足量的3 mol/L硫酸混合微热,产生下列现象:①有红色金属生成;②产生刺激性气味的气体;③溶液呈现蓝色。据此判断下列说法正确的是 () A.反应中硫酸作氧化剂B.NH4CuSO3中硫元素被氧化 C.刺激性气味的气体是氨气 D.1 mol NH4CuSO3完全反应转移0.5 mol电子 16.某实验小组对一含有Al3+的未知溶液进行了如下分析: ①滴入少量氢氧化钠,无明显变化;②继续滴加NaOH溶液,有白色沉淀; ③滴入过量的氢氧化钠,白色沉淀明显减少。实验小组经定量分析,得出如图所示沉淀与滴入氢氧化钠体积的关系。下列说法错误的是 () B.滴加的NaOH溶液的物质的量浓度为5 mol•L-1 C.若另一种离子为二价阳离子,则a=10 D.若将最终沉淀过滤、洗涤、灼烧,其质量为6 g 17.已知A、B、C、D为短周期内原子半径依次增大的元素,X、Y、M、N分别由这四种元素中的两种组成的常见化合物,甲、乙为其中两种元素对应的单质。若X与Y、甲与乙摩尔质量相同,Y与乙均为淡黄色固体,上述物质之间的转化关系如下图所示(部分反应物或生成物省略),则下列说法中不正确的是 () B.简单离子半径:C2—>B2—>D+>A+ C.A、C、D的常见氧化物相互之间一定能反应 D.D与其他元素均能形成离子化合物 18.将9 g铜和铁的混合物投入到100 mL稀硝酸中,充分反应后得到标准状况下1.12 L NO,剩余4.8 g金属;继续加入100 mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下1.12 L NO。若向反应后的溶液中加入KSCN溶液,溶液不变红,则下列说法正确的是( )。 A.原混合物中铜和铁各0.075 mol B.稀硝酸的物质的量浓度为0.5 mol·L-1 C.第一次剩余4.8 g金属为铜和铁 D.再加入上述100 mL稀硝酸,又得到标准状况下1.12 L NO 第Ⅱ卷非选择题(共46分) 二、填空题(本题共4个小题,共46分) 19.(11分) 氰化钠(NaCN)是重要的化工原料,常用于化学合成、冶金工业等。回答下列问题: ④通过以上实验,乙同学认为,确定某溶液中含有SO42-的实验方案:取待测液,向其中先滴加(填字母序号)。 a. 2 mol·L-1盐酸,再滴加BaCl2溶液,一段时间后出现白色沉淀 b.2 mol·L-1盐酸,再滴加BaCl2溶液,立即出现白色沉淀 c.2 mol·L-1硝酸,再滴加BaCl2溶液,一段时间后出现白色沉淀 d.2 mol·L-1硝酸,再滴加BaCl2溶液,立即出现白色沉淀 22.(11分)综合利用CO2、CO对构建低碳社会有重要意义。 ⑴ Li2O、Na2O、MgO均能吸收CO2。如果寻找吸收CO2的其他物质,下列建议合理的是_______。 a.可在碱性氧化物中寻找 b.可在ⅠA、ⅡA族元素形成的氧化物中寻找 c.可在具有强氧化性的物质中寻找 ⑵ Li4SiO4可用于吸收、释放CO2,原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生。写出CO2与Li4SiO4反应的化学方程式______________;该反应为_______(填“吸”或者“放”)热反应,原因是_____________________。 ⑷在200℃并用钴做催化剂的条件下,CO与H2可合成C5H12(汽油的一种成分),可减少碳排放。反应中能量变化如下图所示,写出该反应的热化学方程式______________。 东北育才学校高中部高三第三次模拟考试化学试题参考答案 二、填空题(共46分) 20.(12分)(1) 2NO +O2=2NO2CO(NH2)2(1分) (2) 2NO+C ====N2+CO2(3)△H2-3△H1 (4)① 2NO2(g) ②N2O4﹣2e-+2HNO3=2N2O5+2H+(写成N2O4﹣2e-+2NO3-=2N2O5给1分) ③ N2O4(也可写成NO2)(1分) Δ![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-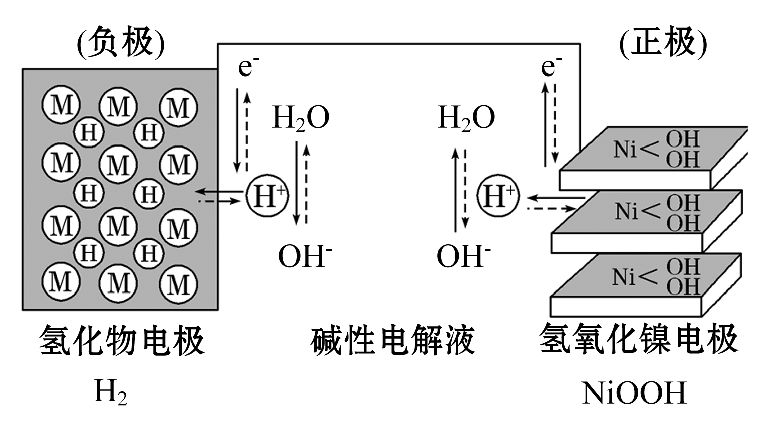
物质编号 物质转化关系 a b c d ① 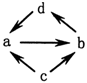
NO NO2 资*源%库N2 HNO3 ② Al2O3 NaAlO2 Al Al(OH)3 ③ SiO2 Na2SiO3 Si H2SiO3 ④ SO2 SO3 S H2SO4 ![]() 2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:t / s 0 2 4 6 8 n(SO3) / mol 0 0. 8 1.8 1.8 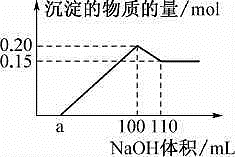 A.该未知溶液中至少含有3种阳离子
A.该未知溶液中至少含有3种阳离子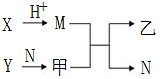 A.相对分子质量M>N,沸点N>M
A.相对分子质量M>N,沸点N>M
(2)写出NaCN的电子式。
(3)可用纯碱、焦炭、氨气反应制取NaCN,写出反应的化学方程式,并用单线桥标明电
子转移的方向和数目。
(4)现代采金技术先以NaCN溶液在自然环境中浸取粉碎的含金(Au)矿石,得到Na[Au(CN)2](二氰合金酸钠)溶液,再用锌还原Na[ Au(CN)2]生成金。“浸取”反应的氧化剂是,消耗的锌与生成的金的物质的量之比为。
(5)工业利用NaCN制备蓝色染料的流程如下: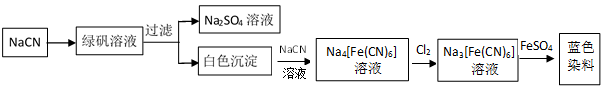
通入Cl2时发生反应的离子方程式为__,该蓝色染料的化学式为。
20.(12分)氮氧化物(NOx)种类很多,造成大气污染的主要是NO和NO2,研究它们的综合利用有重要意义。
(1)NO可通过氧化-还原法转化为N2,转化关系如下:
反应Ⅰ的化学方程式是_______;反应Ⅱ的还原剂是_______。
(2)NO还可与C在一定条件下反应得到无污染的气体。NO与C在一定条件下反应的化学方程式是_______。
(3)NO也可直接用活性铁粉转化为N2。
已知:N2(g)+O2(g)=2NO(g) △H14Fe(s)+3O2(g)=2Fe2O3(s) △H2
则6NO(g)+4Fe(s)=2Fe2O3(s)+3N2(g) △H=_______(用“△H1”、“△H2”表示)。
(4)NO2可电解制备绿色硝化试剂N2O5。下图是其原理示意图。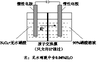
$来&源:
①阳极电解液中的N2O4由NO2降温转化得到,降温的原因是_______。
②阳极区生成N2O5的电极反应式是_______。
③阴极区得到一种可循环利用的物质,其化学式是_______。
21. (12分)
甲乙两同学分别对含+4价硫元素的物质性质进行了探究。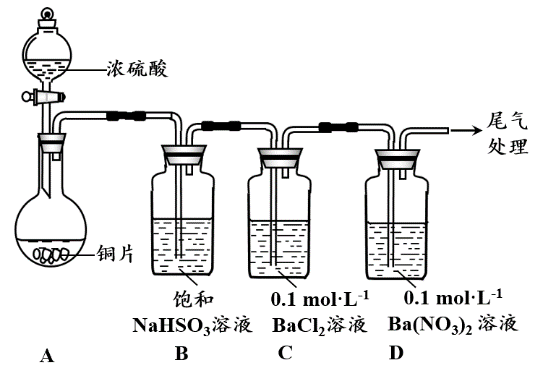 (1)甲用右图装置进行实验(气密性已检验,加
(1)甲用右图装置进行实验(气密性已检验,加
热和夹持装置已略去)。实验进行一段时间
后,C、D中都出现明显的白色沉淀,经检
验均为BaSO4。
①A中反应的化学方程式是。
②为探究SO2在D中所发生的反应,甲
进一步实验发现,出现白色沉淀的过程
中,D溶液中NO3-浓度几乎不变。
甲据此得出结论:D中出现白色沉淀的主要原因是。
(2)乙用如下实验对含+4价硫元素的物质性质继续进行探究。
①结合化学用语解释实验1中产生现象的原因:;。序号 实验操作 实验现象 1 取0.3 g 纯净Na2SO3固体,向其中加入10 mL 2 mol·L-1盐酸,再滴入4滴BaCl2溶液 产生无色气泡;滴入BaCl2溶液后,开始无现象,4 min后,溶液变浑浊 2 取0.3 g 纯净Na2SO3固体,向其中加入10 mL 2 mol·L-1HNO3,再滴入4滴BaCl2溶液 产生无色气泡;滴入BaCl2溶液后,开始无现象,2 h后,溶液变浑浊 3 取0.3 g 纯净Na2SO3固体,向其中加入10 mL 浓HNO3,再滴入4滴BaCl2溶液 产生红棕色气体;滴入BaCl2溶液后,溶液立即产生大量白色沉淀
②由实验1、2、3对比,可以得到推论:。
③乙通过查阅资料发现,Na+对实验1和2中出现浑浊的时间无影响,于是进一步探究Cl-和NO3-对其的影响:序号 实验操作 实验现象 4 取固体混合物,向其中加入10 mL 2 mol·L-1HNO3,再滴入4滴BaCl2溶液 产生无色气泡;滴入BaCl2溶液后,开始无现象,20 min后,溶液变浑浊 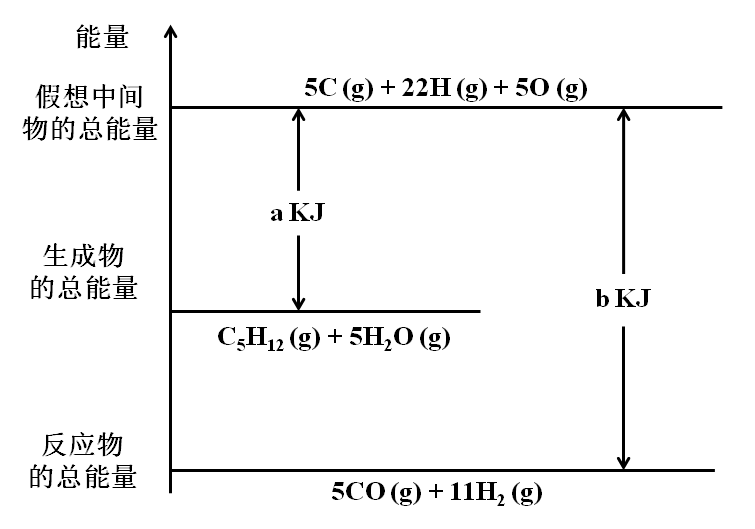 ⑶ CO与H2在催化剂作用下发生如下反应:CO(g)+2H2(g)
⑶ CO与H2在催化剂作用下发生如下反应:CO(g)+2H2(g)![]() CH3OH(g)。对此反应进行如下研究:某温度下在某2 L恒容密闭容器中分别充入1.2 mol CO和 1 mol H2,达到平衡测得有0.4 mol CH3OH(g),则该反应平衡常数值为_______。
CH3OH(g)。对此反应进行如下研究:某温度下在某2 L恒容密闭容器中分别充入1.2 mol CO和 1 mol H2,达到平衡测得有0.4 mol CH3OH(g),则该反应平衡常数值为_______。题号 1 2 3 4 5 6 7 8 9 答案 A B A B C B D A D 题号 10 11 12 13 14 15 16 17 18 答案 C D C B C D D C A 
![]() N2O4(g) △H<0 在其他条件不变时,降温平衡右移,有利于NO2转化为N2O4
N2O4(g) △H<0 在其他条件不变时,降温平衡右移,有利于NO2转化为N2O4
(1)① Cu + 2H2SO4(浓) === CuSO4 + SO2↑ + 2H2O
②酸性条件下,含+4价硫元素物质(SO2或H2SO3)被O2氧化生成SO42-
(2)① 2H+ + SO32- === SO2 + H2O (1分);
2SO2 + O2 + 2Ba2+ + 2H2O === 2BaSO4↓ + 4H+(1分)
(或2H2SO3+O2+2Ba2+ === 2BaSO4↓+ 4H+) (2分)
②含+4价硫元素物质可被O2和浓HNO3氧化(2分)
③ 0.3 g 纯净Na2SO3和 1.17 g NaCl
ii. NO3-的存在可以减慢溶液中+4价硫元素的氧化
④ bd 22.(15分)
△
22.(11分)(除标注外,每空2分)(1)a b(2) 2CO2+Li4SiO4![]() 2Li2CO3+SiO2;放(1分),
2Li2CO3+SiO2;放(1分),
升高温度,平衡向逆向进行,说明逆反应为吸热反应,所以正反应为放热反应。
200℃