2018届高三模拟考试试卷(十三)
化 学 2018.3
 本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分120分,考试时间100分钟。
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分120分,考试时间100分钟。
可能用到的相对原子质量:H—1 Li—7 C—12 N—14 O—16
Al—27 S—32 Fe—56 Sr—88
第Ⅰ卷(选择题 共40分)
单项选择题:本题包括10小题,每小题2分,共20分。每小题只有一个选项符合题意。
- 习近平总书记说:把垃圾资源化,化腐朽为神奇,是一门艺术。下列有关做法合理的是( )
- 回收农田秸秆用于制造纸张 B. 回收废油脂用于提炼氨基酸
C. 回收厨余垃圾用于提取食用油 D. 回收废医用塑料用于制造餐具
2. 下列有关化学用语表示正确的是( )
- 氮气分子的电子式:

- 质子数为53、中子数为78的碘原子:I
- 对硝基苯酚的结构简式:
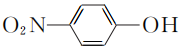
- NaHCO3水解的离子方程式:HCO+H2O
 H3O++CO
H3O++CO
3. 下列有关物质性质与用途具有对应关系的是( )
- H2O2具有强氧化性,可用作消毒剂 B. Fe2(SO4)3易溶于水,可用作净水剂
C. NH3具有还原性,可用作制冷剂 D. C2H4具有可燃性,可用作催熟剂
4. 下列通过制取硫酸铝、氢氧化铝获得氧化铝的装置和原理能达到实验目的的是( )
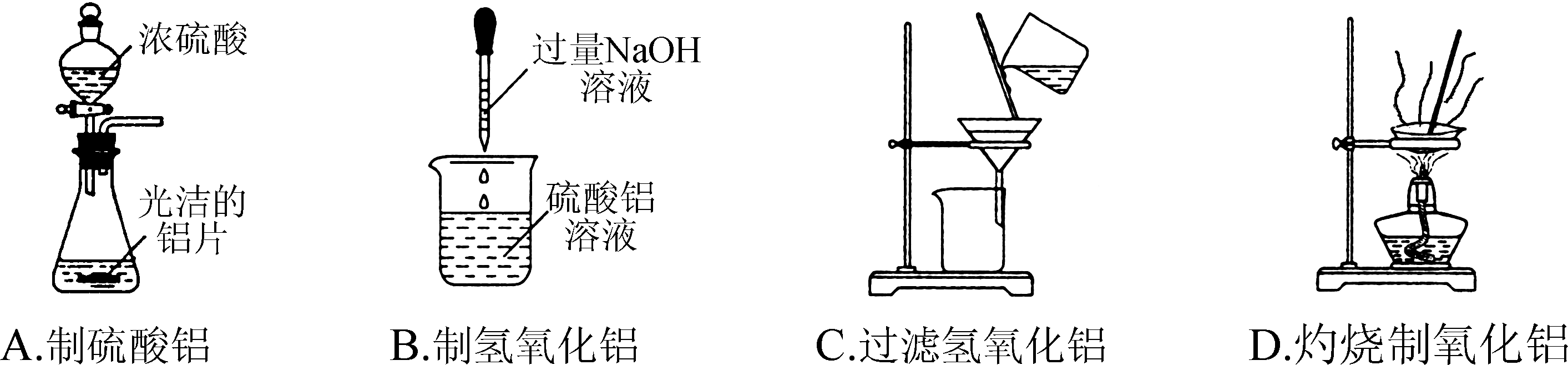
5. 下列指定反应的离子方程式正确的是( )
- 用惰性电极电解CuSO4溶液:2Cu2++4OH-2Cu+O2↑+2H2O
- 在Na2SiO3溶液中加入盐酸:Na2SiO3+2H+===H2SiO3↓+2Na+
- 在稀硝酸中加入过量的铁屑:Fe+4H++NO===Fe3++NO↑+2H2O
- 在NaHCO3溶液中加入过量Ba(OH)2溶液:HCO+Ba2++OH-===BaCO3↓+H2O
6. 四种短周期主族元素W、X、Y、Z原子序数依次增大,它们的原子最外层电子数之和为18。X的核电荷数是Z的核电荷数的一半,W的单质是空气中含量最多的气体。下列说法正确的是( )
- 原子半径:r(Z)
- W的气态氢化物的热稳定性比X的弱
- Y与X形成的化合物中只含有离子键
- 同周期元素中Z的最高价氧化物对应水化物的酸性最强
7. 在给定条件下,下列选项所示的物质间转化均能实现的是( )
- FeFe2O3―→FeCl3(aq)
- N2NH3NO
- SiO2H2SiO3Na2SiO3(aq)
- AgNO3(aq)[Ag(NH3)2]OH(aq)Ag
8. 常温下,下列各组离子在指定溶液中能大量共存的是( )
- 澄清透明溶液中:K+、Cu2+、ClO-、S2-
- 0.1 mol·L-1(NH4)2CO3溶液中:K+、Na+、NO、OH-
- pH=1的溶液中:Na+、Mg2+、AlO、NO
- =10-13mol·L-1的溶液中:Na+、K+、SO、CO
9. 在好氧菌和厌氧菌作用下,废液中NH能转化为N2(g)和H2O (l),示意图如下:
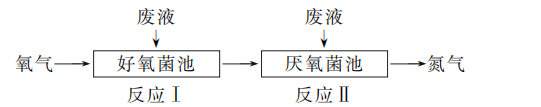 反应Ⅰ: NH(aq)+2O2(g)===NO(aq)+2H+(aq)+H2O (l) ΔH1=a kJ·mol-1
反应Ⅰ: NH(aq)+2O2(g)===NO(aq)+2H+(aq)+H2O (l) ΔH1=a kJ·mol-1
反应Ⅱ: 5NH(aq)+3NO(aq)===4N2(g)+9H2O(l)+2H+(aq) ΔH2=b kJ·mol-1
下列说法正确的是( )
- 两池发生的反应中,氮元素只被氧化
- 两池中投放的废液体积相等时,NH能完全转化为N2
- 常温常压下,反应Ⅱ中生成22.4 L N2转移的电子数为3.75×6.02×1023
- 4NH(aq) +3O2(g)===2N2(g) +4H+(aq)+6H2O(l) ΔH=(3a+b) kJ·mol-1
10. 铝石墨双离子电池是一种全新低成本、高效电池。原理为AlLi+Cx(PF6) Al+xC+Li++PF。电池结构如右图所示。下列说法正确的是( )
Al+xC+Li++PF。电池结构如右图所示。下列说法正确的是( )
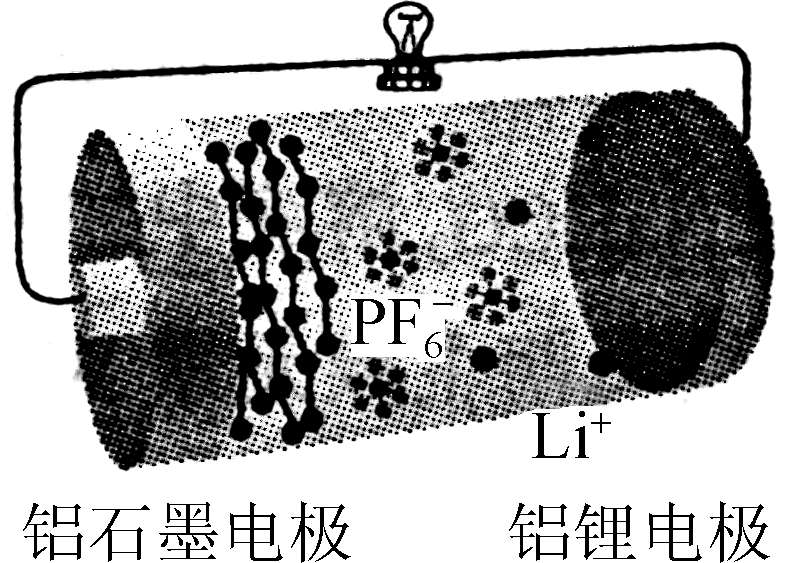
- 放电时,外电路中电子向铝锂电极移动
- 放电时,正极反应为Cx(PF6) +e-===xC+PF
- 充电时,应将铝石墨电极与电源负极相连
- 充电时,若电路中转移1 mol电子,阴极质量增加9 g
不定项选择题:本题包括5小题,每小题4分,共20分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
11. 某有机合成中间体的结构简式如右图所示。下列关于该有机物的叙述正确的是( )
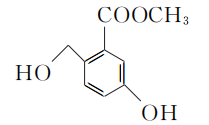 分子式为C9H8O4
分子式为C9H8O4- 在一定条件下,可与HCHO发生缩聚反应
- 在浓硫酸作用下,可发生消去反应
- 1 mol该物质最多能与3 mol Br2发生取代反应
12. 下列有关说法正确的是( )
- 镀铜铁制品镀层受损后,铁制品比受损前更容易生锈
- 等物质的量浓度的CH3COOH溶液和HCl溶液中,水的电离程度相同
- 0.1 mol·L-1NH4Cl溶液加水稀释,的值减小
- 对于2SO2+O2
 2SO3,使用催化剂能加快反应速率并提高SO2的平衡转化率
2SO3,使用催化剂能加快反应速率并提高SO2的平衡转化率
13. 根据下列实验操作和现象所得到的结论正确的是( )
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 向过氧化钠样品中滴加过量的盐酸,将生成的气体通入CaCl2溶液 | 无白色沉淀产生 | 样品未变质 |
| B | 向氯仿(CHCl3)样品中加入AgNO3溶液 | 有白色沉淀产生 | 样品已变质 |
| C | 将漂白粉样品溶于水,加入盐酸和KI溶液,再加入CCl4振荡,静置 | 下层液体呈紫红色 | 样品未变质 |
| D | 将亚硫酸钠样品溶于水,加入盐酸酸化的Ba(NO3)2溶液 | 有白色沉淀产生 | 样品已变质 |
14. 常温下,下列溶液中有关微粒的物质的量浓度关系正确的是( )
- 等物质的量浓度的CuSO4和(NH4)2SO4的混合溶液:
c(NH)>c(SO)>c(Cu2+)>c(H+) - 0.2 mol·L-1NaHCO3溶液和0.1 mol·L-1NaOH溶液等体积混合:
3c(HCO)+6c(H2CO3)-c(Na+)=3c(OH-)-3c(H+) - pH=2的盐酸与pH=12的氨水等体积混合:
c(Cl-)>c(NH)>c(H+)>c(OH-) - 0.1 mol·L-1CH3COONa溶液中通入HCl气体,至pH=7(溶液体积变化忽略不计):
c(Na+)>c(CH3COOH)=c(Cl-)
15. Bodensteins研究反应:H2(g)+I2(g) 2HI(g) ΔH<0,温度T时,在两个体积均为1 L的密闭容器中进行实验,测得气体混合物中碘化氢的物质的量分数w(HI)与反应时间t的关系如下表:
2HI(g) ΔH<0,温度T时,在两个体积均为1 L的密闭容器中进行实验,测得气体混合物中碘化氢的物质的量分数w(HI)与反应时间t的关系如下表:
| 容器编号 | 起始物质 | t/min | 0 | 20 | 40 | 60 | 80 | 100 |
| Ⅰ | 0.5 mol I2、0.5 mol H2 | w(HI)/% | 0 | 50 | 68 | 76 | 80 | 80 |
| Ⅱ | x mol HI | w(HI)/% | 100 | 91 | 84 | 81 | 80 | 80 |
研究发现,上述反应中v正=ka·w(H2)·w(I2),v逆=kb·w2(HI),其中ka、kb为常数。下列说法正确的是( )
- 温度为T时,该反应的=64
- 容器Ⅰ中,前20 min的平均速率v(HI)=0.012 5 mol·L-1·min-1
- 若起始时,向容器Ⅰ中加入物质的量均为0.1 mol的H2、I2和HI,反应逆向进行
- 若两容器中,kaⅠ=kaⅡ且kbⅠ=kbⅡ,则x的值一定为1
第Ⅱ卷(非选择题 共80分)
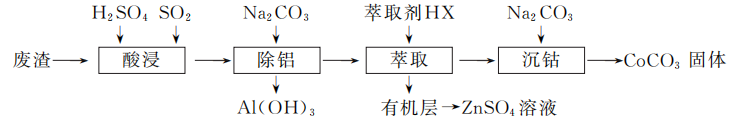
16. (12分)CoCO3是一种制造锂电池电极的原料。以含钴废渣(主要成分CoO、Co2O3,还含有Al2O3、ZnO等杂质)为原料制备CoCO3的一种工艺流程如下:
 下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算):
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算):
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Co2+ | 7.6 | 9.4 |
| Al3+ | 3.0 | 5.0 |
| Zn2+ | 5.4 | 8.0 |
- “酸浸”时通入SO2的目的是________________________________________________________________________。
- “除铝”时调节溶液pH范围为________,该过程中主要反应的离子方程式为________________________________________________________________________。
- “萃取”过程可表示为ZnSO4(水层)+2HX(有机层)
 ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是________________________________________________________________________。
ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是________________________________________________________________________。 - “沉钴”时Na2CO3溶液需缓慢滴加的原因是________________________________________________________________________。
- CoCO3隔绝空气灼烧可以生成Co2O3,该反应的化学方程式为________________________________________________________________________。
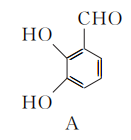
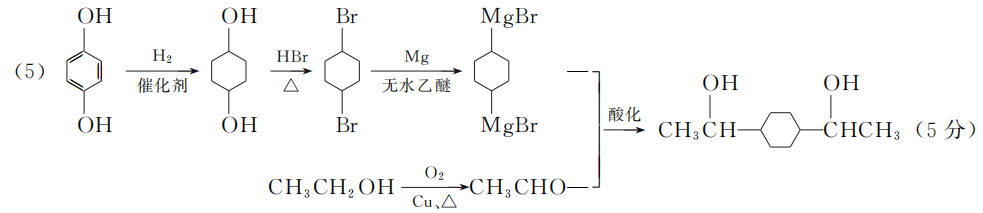
17. (15分)白花丹酸具有镇咳祛痰的作用,其合成路线流程图如下:
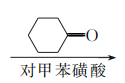
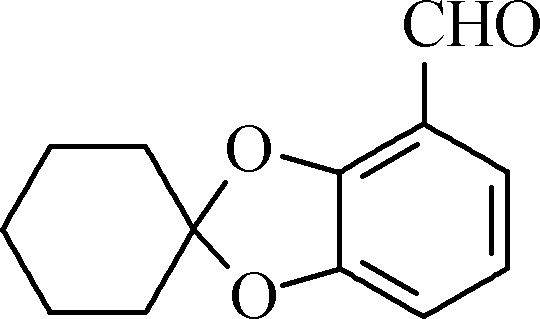 B
B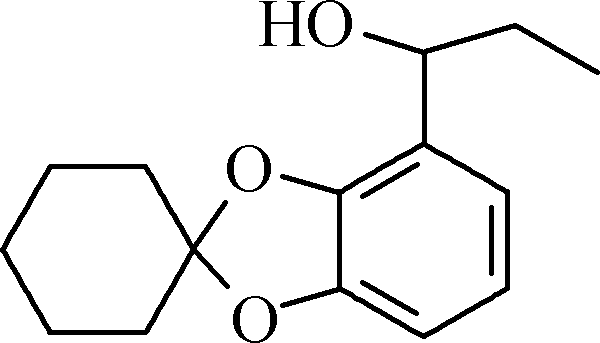 C
C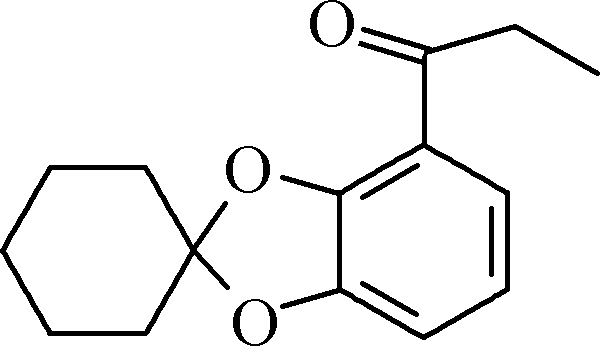 D E
D E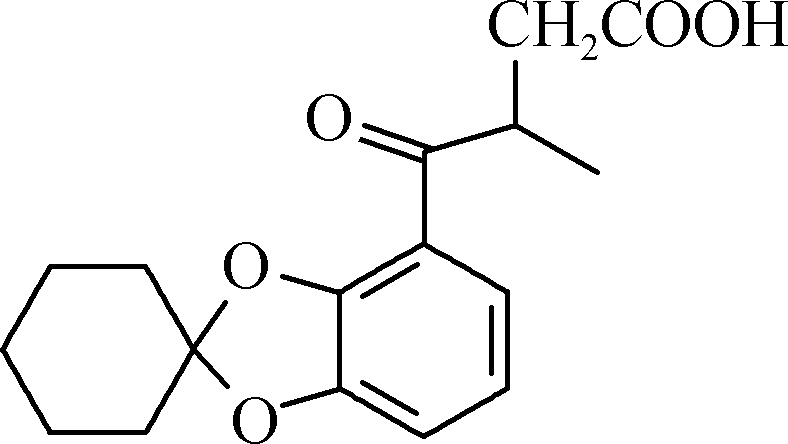 F
F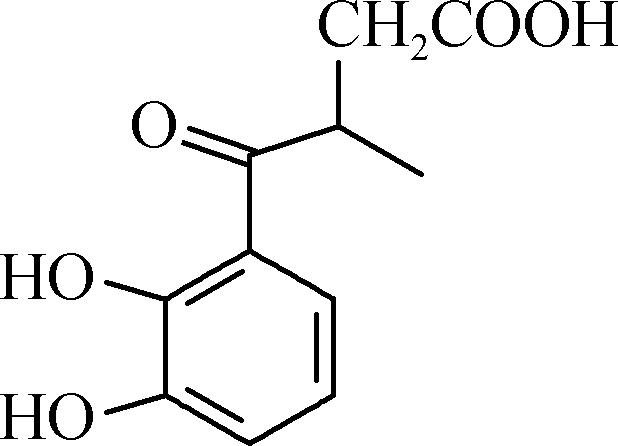 白花丹酸
白花丹酸
- A中的含氧官能团名称为________和________。
- C→D的反应类型为__________________。
- 白花丹酸分子中混有
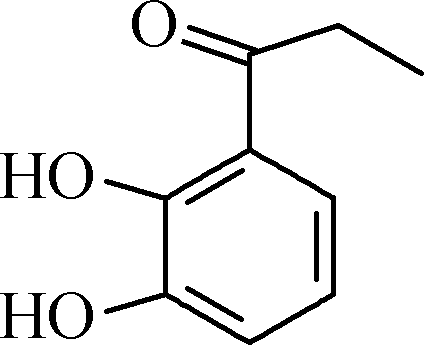 ,写出同时满足下列条件的该有机物的一种同分异构体的结构简式:______________。
,写出同时满足下列条件的该有机物的一种同分异构体的结构简式:______________。
①分子中有四种不同化学环境的氢;
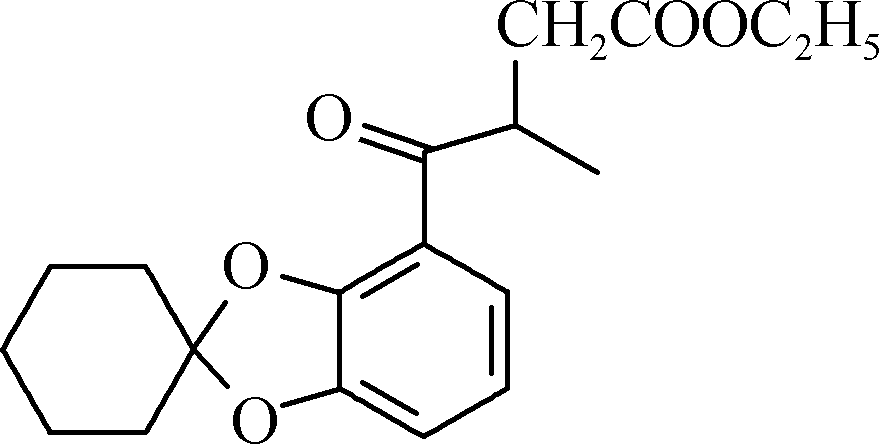
②与FeCl3溶液能发生显色反应,且1 mol该物质最多能与3 mol NaOH反应。 - E的结构简式为________________。
- 已知:R—BrRMgBr。根据已有知识并结合相关信息写出以
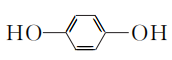 和CH3CH2OH为原料制备
和CH3CH2OH为原料制备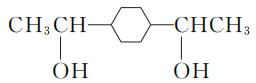 的合成路线流程图(合成路线流程图示例见本题题干)。
的合成路线流程图(合成路线流程图示例见本题题干)。
18. (12分)过氧化锶(SrO2·2H2O)晶体是一种白色粉末,微溶于水,常用作焰火的引火剂。制备流程如下:
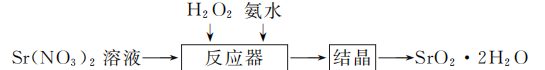
反应原理:Sr(NO3)2+H2O2+2NH3·H2O===SrO2·2H2O↓+2NH4NO3,该反应放热。
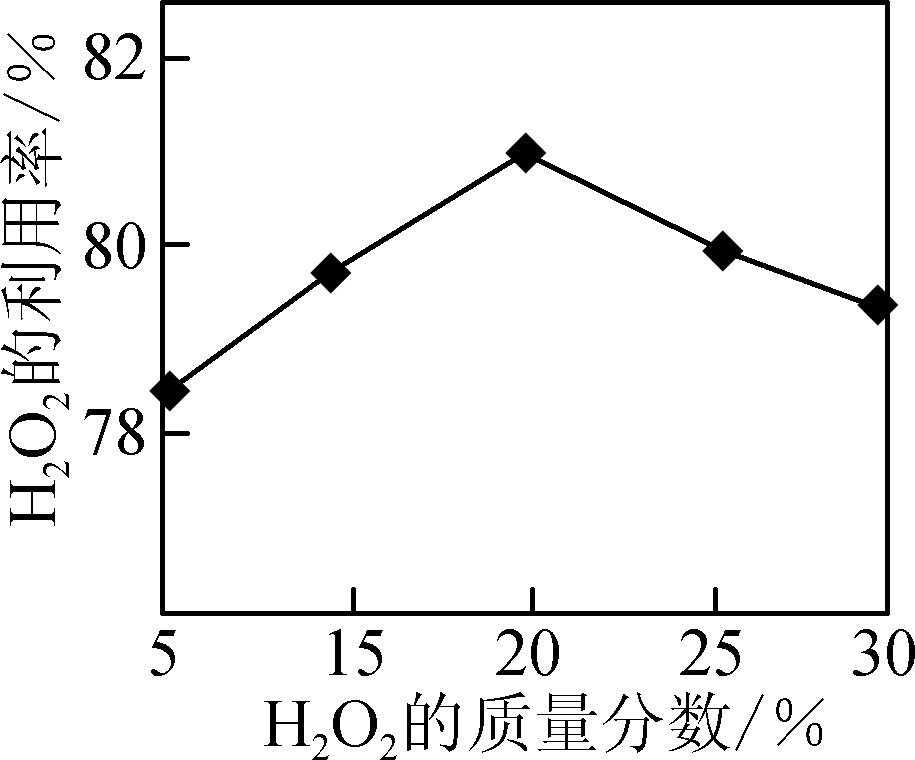
- 选择不同浓度的双氧水在反应器中反应,测得相同时间H2O2的利用率随浓度的变化关系如右图所示。5%的H2O2比20%的H2O2利用率低的原因是________________________________________________________________________。
- SrO2·2H2O遇CO2会反应变质,反应的化学方程式为________________________________________________________________________。
- 25℃时,将Sr(NO3)2溶液滴加到含有F-、CO的溶液中,当混合溶液中c(Sr2+)=0.001 0 mol·L-1时,同时存在SrF2、SrCO3两种沉淀,则此时溶液中c(F-)∶c(CO)=________。
[已知25℃时:Ksp(SrF2)=4.0×10-9,Ksp(SrCO3)=5.0×10-9] - 准确称取1.800 0 g SrO2·2H2O样品置于锥形瓶中,加入适量的盐酸使之充分转化为H2O2,再加入足量KI,摇匀后置于暗处,充分反应后,加入少量淀粉试液,用1.000 0 mol·L-1Na2S2O3标准溶液滴定到蓝色恰好消失时,共消耗标准溶液20.00 mL,计算SrO2·2H2O样品的纯度(写出计算过程)。(已知:S2OS4O)
19. (15分)FePO4是一种难溶于水、易溶于硫酸的固体,可用作金属防腐剂。实验室利用FeSO4·7H2O和H3PO4(第一级电离常数Ka1=7.5×10-3)制备FePO4流程如下:
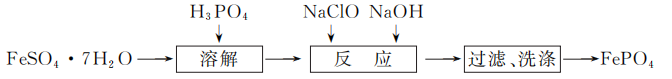 “溶解”时H3PO4不宜过量太多的原因是________________________________________________________________________。
“溶解”时H3PO4不宜过量太多的原因是________________________________________________________________________。- ① 写出“反应”时总反应的离子方程式:________________________________________________________________________。
② 证明“反应”后铁元素沉淀完全的实验方法是________________________________________________________________________。
- ① “过滤”所得产品呈棕黄色,则FePO4可能混有的杂质是________。
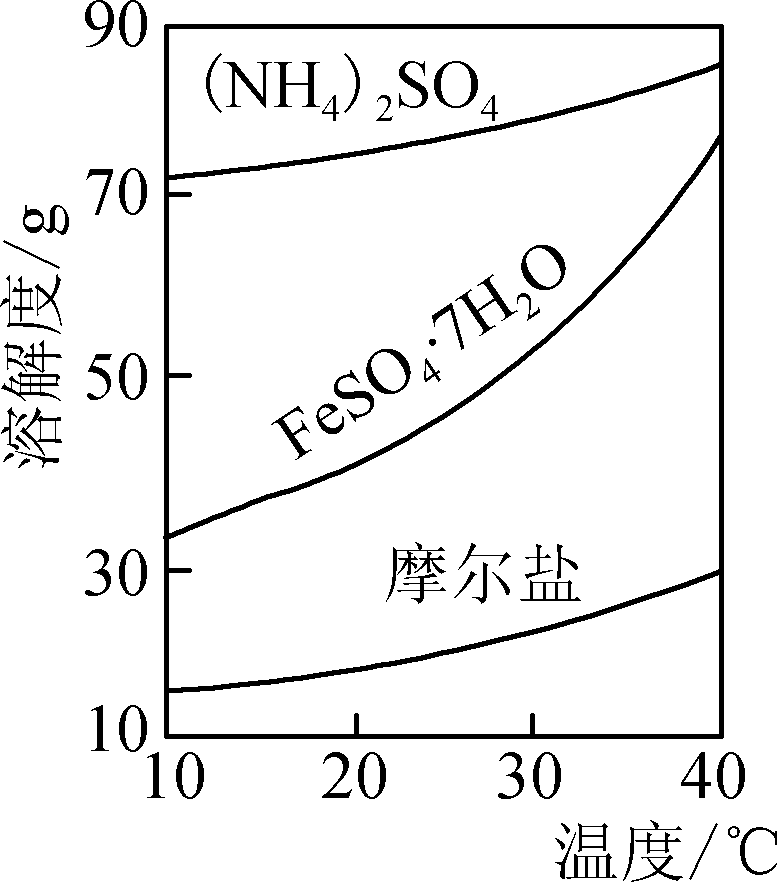
② 洗涤FePO4沉淀的操作是________________________________________________________________________。 - FeSO4与(NH4)2SO4反应可制得摩尔盐[(NH4)2Fe(SO4)2·6H2O]。摩尔盐易溶于水,不溶于乙醇,性质比一般亚铁盐稳定,接近100℃时易失去结晶水。相关物质的溶解度曲线如右图所示。请补充完整由久置于空气中的FeSO4·7H2O样品合成摩尔盐的实验步骤:将样品溶于适量的硫酸溶液中,加热使其溶解,然后向其中加入________________。可选试剂:蒸馏水、饱和硫酸铵溶液、3%H2O2、铜粉、铁粉、无水乙醇。
20. (14分)采用科学技术减少氮氧化物、SO2等物质的排放,可促进社会主义生态文明建设。
- 采用“联合脱硫脱氮技术”处理烟气(含CO2、SO2、NO)可获得含CaCO3、CaSO4、Ca (NO2)2的副产品,工业流程如图1所示。
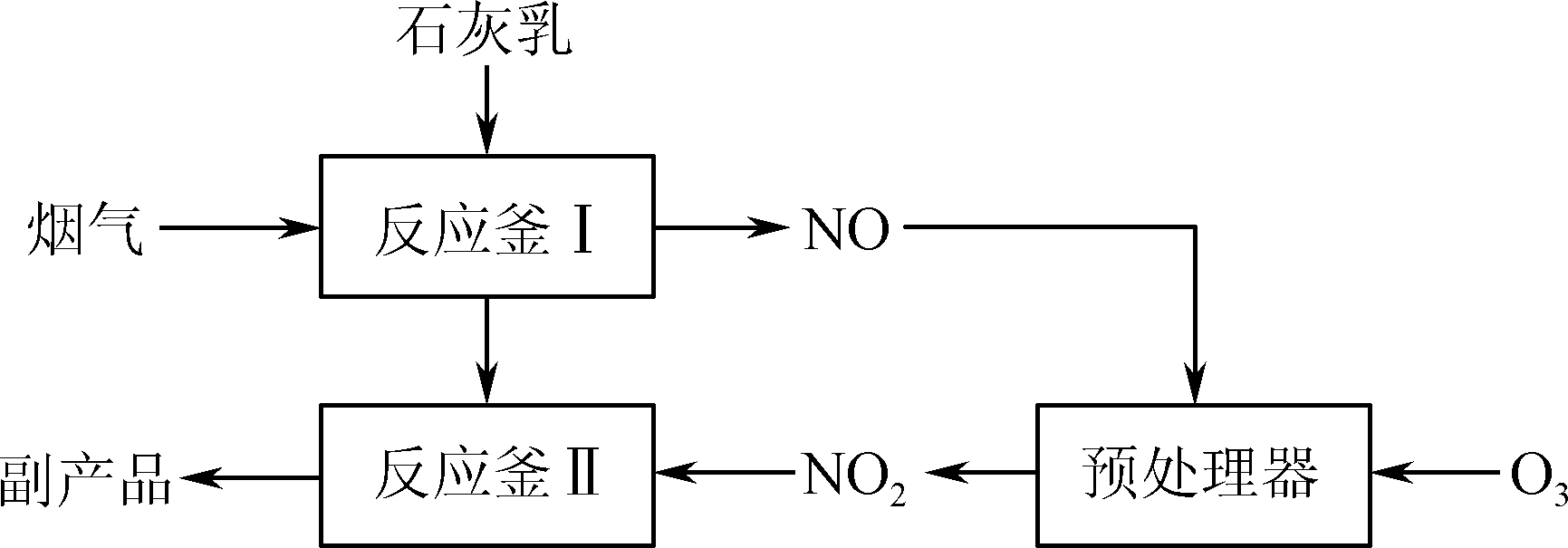 图1
图1
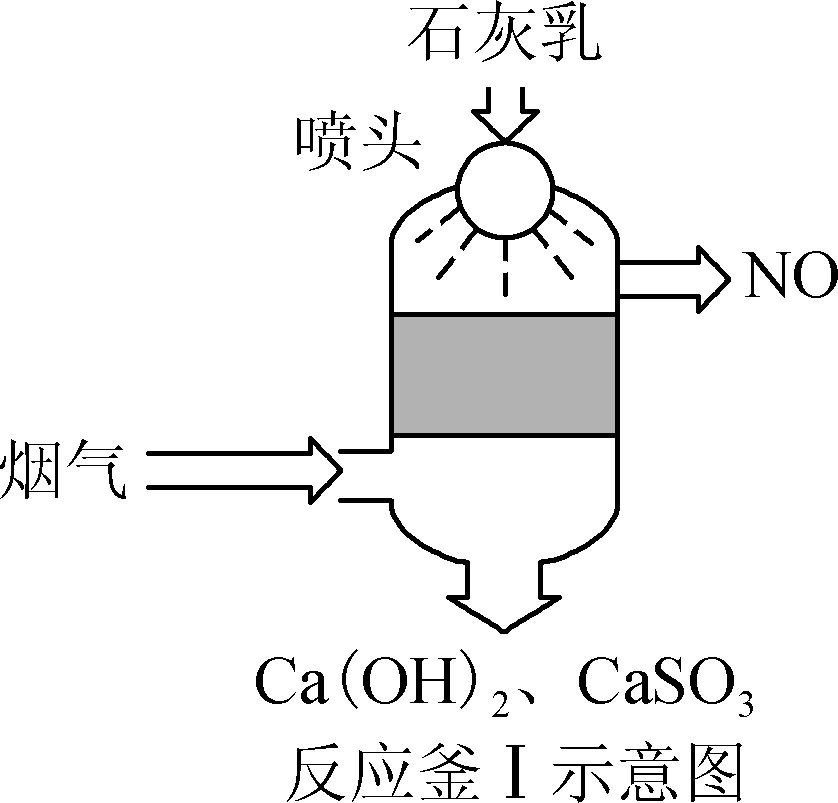 图2
图2
① 反应釜Ⅰ采用“气液逆流”接触吸收法(如图2),其优点是________________________________________________________________________。
② 反应釜Ⅱ中CaSO3转化为CaSO4的化学反应方程式为________________________________________________________________________。
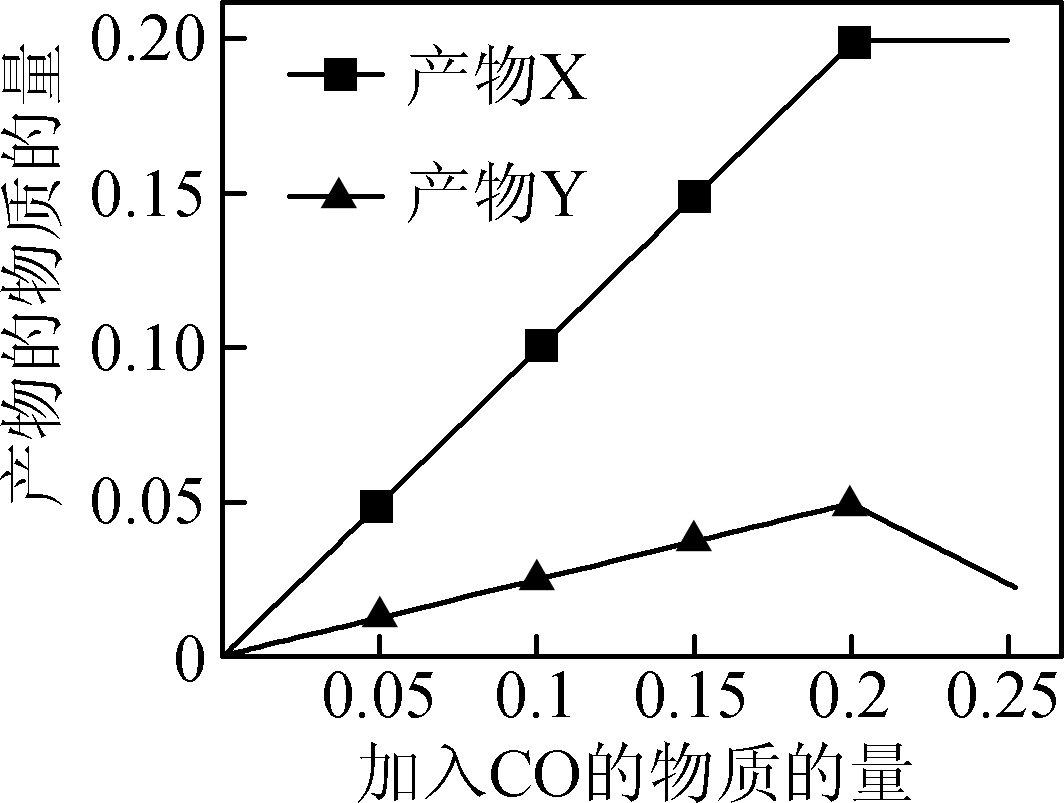
图3 - 为研究“CO还原SO2”的新技术,在反应器中加入0.10 mol SO2,改变加入CO的物质的量,反应后体系中产物随CO的变化如图3所示。其中产物Y的化学式是__________________。
- O2/CO2燃烧技术是指化石燃料在O2和CO2的混合气体中燃烧,通过该燃烧技术可收集到高纯度的CO2。
① 与在空气中燃烧相比,利用O2/CO2燃烧技术时,烟气中NOx的排放量明显降低,其主要原因是________________________________________________________________________。
② 利用太阳能可实现反应:2CO2(g)===2CO(g)+O2(g),该反应能自发进行的原因是____________________________。
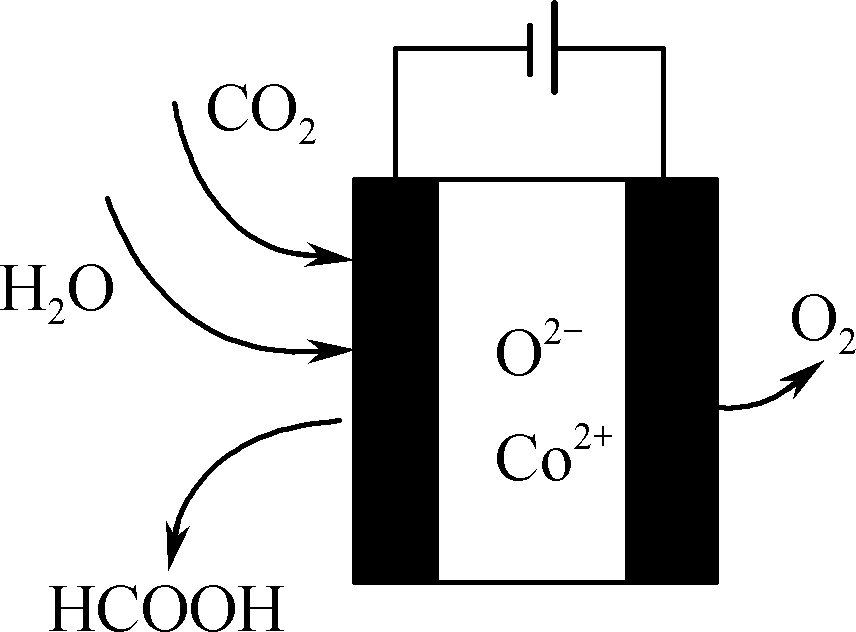
图4
③ 700℃时,以NiMgO/γAl2O3作催化剂,向2 L密闭容器中通入CO2和CH4各3 mol,发生反应:CO2(g)+CH4(g) 2CO(g) +2H2(g)。当反应达平衡时测得CO的体积分数为40%,则CO2的转化率为________。
2CO(g) +2H2(g)。当反应达平衡时测得CO的体积分数为40%,则CO2的转化率为________。
④ CO2在新型钴基电催化剂作用下,转化为清洁燃料—甲酸。其工作原理如图4所示,写出生成甲酸的电极反应式:________________________________________________________________________。
21. (12分)【选做题】本题包括A、B两小题,请选定其中一小题作答。若多做,则按A小题评分。
- 【物质结构与性质】
镍、铂、镧等过渡金属单质及化合物在医疗领域有着广泛的应用。
- 基态原子镍的价电子排布式为____________。
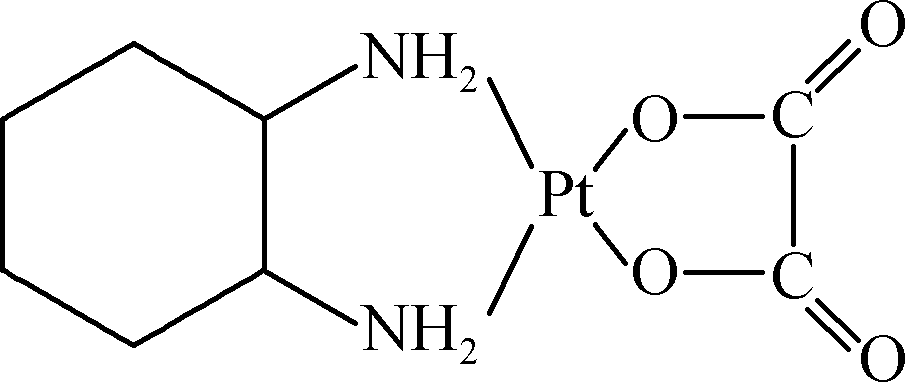
- 抗癌药奥沙利铂(又名乙二酸铂)的结构简式如右图所示。
① 分子中氮原子轨道的杂化类型是________,C、N、O三种元素的第一电离能由大到小的顺序为________。
② 1 mol乙二酸分子中含有σ键的数目为________________________________________________________________________。
- 碳酸镧[La2(CO3)3]可用于治疗高磷血症。写出与CO互为等电子体的一种分子的化学式:____________。
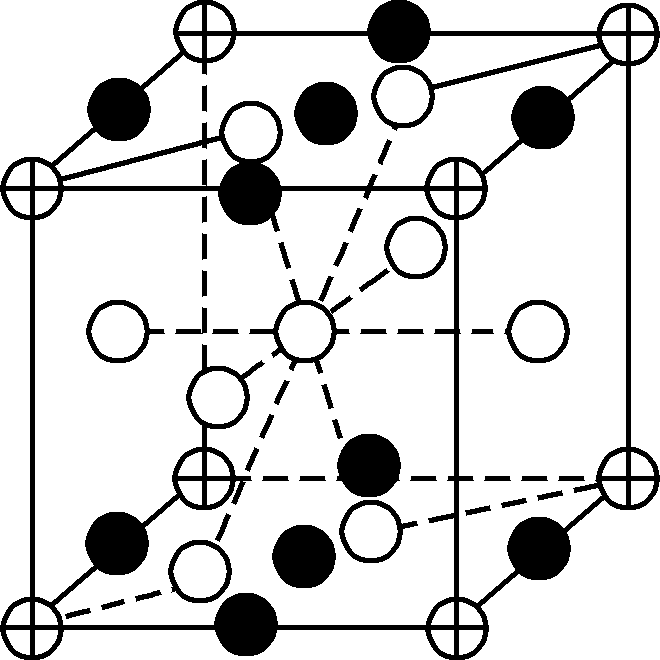
- 镧镍合金可用于储氢,储氢之后所得晶体的化学式为LaNi5(H2)3,其晶体的最小重复结构单元如右图所示(⊕、○、●代表储氢之后晶体中的三种微粒)。图中●代表的微粒是________。
B. 【实验化学】
维生素C又名抗坏血酸,结构简式为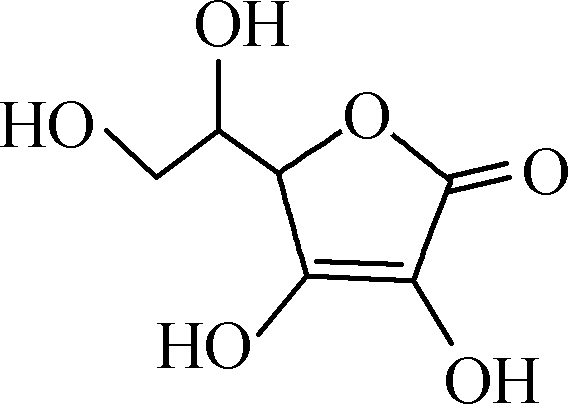 。维生素C在碱性溶液中易被氧化,能被I2定量氧化:
。维生素C在碱性溶液中易被氧化,能被I2定量氧化: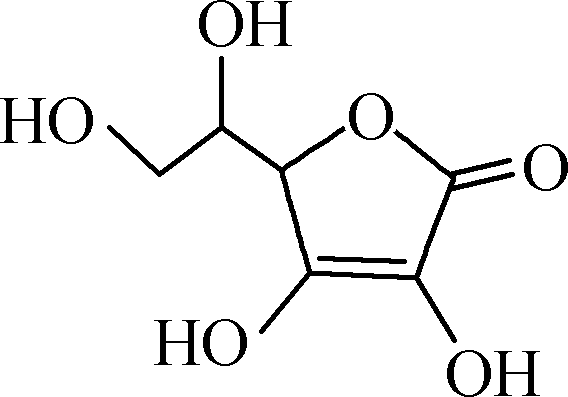 +I2―→
+I2―→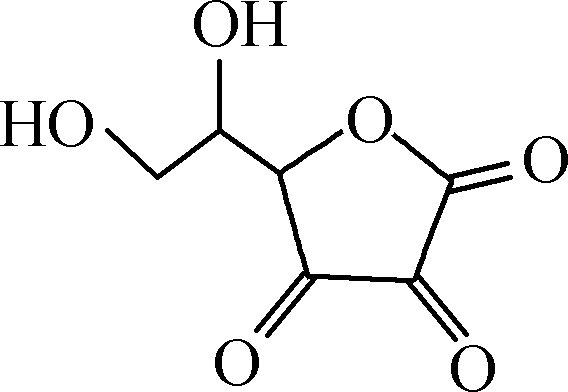 +2HI。测定橙子中维生素C的含量的实验步骤如下(所用蒸馏水均已煮沸冷却):
+2HI。测定橙子中维生素C的含量的实验步骤如下(所用蒸馏水均已煮沸冷却):
步骤一:将1.3 g I2溶于少量KI浓溶液,转入1 000 mL容量瓶中,加入蒸馏水定容后置于棕色瓶避光保存,备用。
步骤二:称取100 g去皮、去核的新鲜橙子和40 mL草酸溶液混合榨汁,后将果汁全部移入锥形瓶,加入适量的活性炭,抽滤,将所得果汁稀释至100 mL密封保存。
 步骤三:准确移取10.00 mL果汁,加入20 mL 1%草酸溶液和1 mL 1%淀粉溶液,用标准碘溶液进行滴定至终点,记录消耗的标准碘溶液的体积。
步骤三:准确移取10.00 mL果汁,加入20 mL 1%草酸溶液和1 mL 1%淀粉溶液,用标准碘溶液进行滴定至终点,记录消耗的标准碘溶液的体积。
步骤四:重复步骤三2~3次。
步骤五:数据处理,计算100 g橙子中维生素C的含量。
- 步骤一中配制标准碘溶液时,将I2加入到KI浓溶液的目的是__________________________,所需要的玻璃仪器有烧杯、1 000 mL容量瓶、______________。
- 步骤二中加入活性炭的作用是________________;抽滤使用的主要仪器是________。
- 在步骤二和步骤三中均加入草酸溶液的目的是________________________________________________________________________。
- 步骤二和步骤三通常需控制在2 min内完成,若超时会导致测定结果________(填“偏大”“偏小”或“无影响”)。
2018届高三模拟考试试卷(十三)(六市联考)
化学参考答案及评分标准
- A 2. C 3. A 4. C 5. D 6. B 7. B 8. D 9. D 10. B 11. B 12. AC 13. B 14. BD 15. AD
16. (12分,每空2分)
- 将Co3+还原为Co2+
- 5.0~5.4 2Al3++3CO+3H2O=2Al(OH)3↓+3CO2↑
- 向有机层中加入适量的硫酸溶液充分振荡,静置,分液
- 防止加入过快后,局部碱性过强而产生Co(OH)2
- 2CoCO3Co2O3+CO↑+CO2↑
17. (15分)
- 羟基(1分) 醛基(1分)
- 氧化反应(2分)
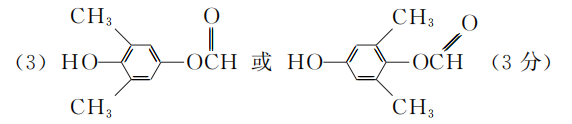 (4)
(4) (3分)
(3分)
18. (12分)
- 浓度低的双氧水反应慢,相同时间内反应的H2O2少(2分)
- 2SrO2·2H2O+2CO2===2SrCO3+O2↑+4H2O(2分)
- 400(2分)
- 先后发生的反应有SrO2·2H2O+2H+===Sr2++H2O2+2H2O
2H++2I-+H2O2===I2+2H2O I2+2S2O===2I-+S4O
SrO2·2H2O~H2O2~I2~2Na2S2O3
n(Na2S2O3)=1.000 0 mol·L-1×20.00×10-3L=2.000×10-2mol(1分)
n(I2)=n(Na2S2O3)=×2.000×10-2mol=1.000×10-2mol(1分)
n(SrO2·2H2O)=n(H2O2)=n(I2)=1.000×10-2mol(1分)
m(SrO2·2H2O)=0.010 00 mol×156 mol·L-1=1.56 g(1分)
w(SrO2·2H2O)=×100%=86.67%(2分)
19. (15分)
- 防止后续反应中加入过多NaOH,浪费原料(2分)
- ① 2Fe2++ClO-+2H3PO4+4OH-===2FePO4↓+Cl-+5H2O(2分)
② 静置,取上层清液少许于试管中,加适量氯水,再滴加KSCN溶液,若溶液不变红,说明铁元素沉淀完全(2分) - ① Fe(OH)3(2分)
② 向过滤器中加入蒸馏水至没过沉淀,待水流尽后重复上述操作两到三次(2分) - 足量的铁粉,趁热过滤,向滤液中加入计算量的饱和硫酸铵溶液,蒸发浓缩,冷却结晶,过滤,用无水乙醇洗涤,低于100℃烘干(5分)
20. (14分,每空2分)
- ① 使气体和石灰乳充分接触,提高气体的吸收效率
② 2NO2+CaSO3+Ca(OH)2===CaSO4+Ca(NO2)2+H2O - S2
- ① CO2代替了N2,减少了N2与O2反应 ② ΔS>0
③ 66.7% ④ CO2+2e-+H2O===HCOOH+O2-
21A. (12分,每空2分)
- 3d84s2
- ① sp3 N>O>C ② 7mol
- SO3
- H2
21B. (12分,每空2分)
- 促进I2的溶解 胶头滴管、玻璃棒
- 吸附果汁中的有色物质,以免干扰步骤三滴定终点的观察 布氏漏斗
- 提供酸性环境防止维生素C被氧化
- 偏小

![]() 本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分120分,考试时间100分钟。
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分120分,考试时间100分钟。
 反应Ⅰ: NH(aq)+2O2(g)===NO(aq)+2H+(aq)+H2O (l) ΔH1=a kJ·mol-1
反应Ⅰ: NH(aq)+2O2(g)===NO(aq)+2H+(aq)+H2O (l) ΔH1=a kJ·mol-1![]() Al+xC+Li++PF。电池结构如右图所示。下列说法正确的是( )
Al+xC+Li++PF。电池结构如右图所示。下列说法正确的是( )
 分子式为C9H8O4
分子式为C9H8O4![]() 2HI(g) ΔH<0,温度T时,在两个体积均为1 L的密闭容器中进行实验,测得气体混合物中碘化氢的物质的量分数w(HI)与反应时间t的关系如下表:
2HI(g) ΔH<0,温度T时,在两个体积均为1 L的密闭容器中进行实验,测得气体混合物中碘化氢的物质的量分数w(HI)与反应时间t的关系如下表: 下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算):
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算):

 B
B C
C D E
D E F
F 白花丹酸
白花丹酸 ,写出同时满足下列条件的该有机物的一种同分异构体的结构简式:______________。
,写出同时满足下列条件的该有机物的一种同分异构体的结构简式:______________。 和CH3CH2OH为原料制备
和CH3CH2OH为原料制备 的合成路线流程图(合成路线流程图示例见本题题干)。
的合成路线流程图(合成路线流程图示例见本题题干)。

 “溶解”时H3PO4不宜过量太多的原因是________________________________________________________________________。
“溶解”时H3PO4不宜过量太多的原因是________________________________________________________________________。
 图1
图1 图2
图2

![]() 2CO(g) +2H2(g)。当反应达平衡时测得CO的体积分数为40%,则CO2的转化率为________。
2CO(g) +2H2(g)。当反应达平衡时测得CO的体积分数为40%,则CO2的转化率为________。

 。维生素C在碱性溶液中易被氧化,能被I2定量氧化:
。维生素C在碱性溶液中易被氧化,能被I2定量氧化: +I2―→
+I2―→ +2HI。测定橙子中维生素C的含量的实验步骤如下(所用蒸馏水均已煮沸冷却):
+2HI。测定橙子中维生素C的含量的实验步骤如下(所用蒸馏水均已煮沸冷却):![]() 步骤三:准确移取10.00 mL果汁,加入20 mL 1%草酸溶液和1 mL 1%淀粉溶液,用标准碘溶液进行滴定至终点,记录消耗的标准碘溶液的体积。
步骤三:准确移取10.00 mL果汁,加入20 mL 1%草酸溶液和1 mL 1%淀粉溶液,用标准碘溶液进行滴定至终点,记录消耗的标准碘溶液的体积。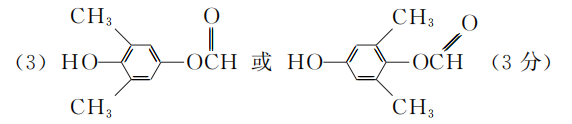 (4)
(4) (3分)
(3分)