
湖南省醴陵二中、醴陵四中2016-2017学年高二下学期期中联考化学试卷
03月05日
本试卷分选择题和非选择题两部分,共120分,考试用时100分钟。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 P 31 Mn 55 Fe 56 Br 80
选择题
单项选择题:本题包括10小题,每小题2分,共计20分。每小题只有一个选项符合题意。
2. 下列有关化学用语表示正确的是( )
3. 下列有关物质性质与用途具有对应关系的是( )
4. 下列装置应用于实验室制NO2并回收硝酸铜,能达到实验目的的是( )
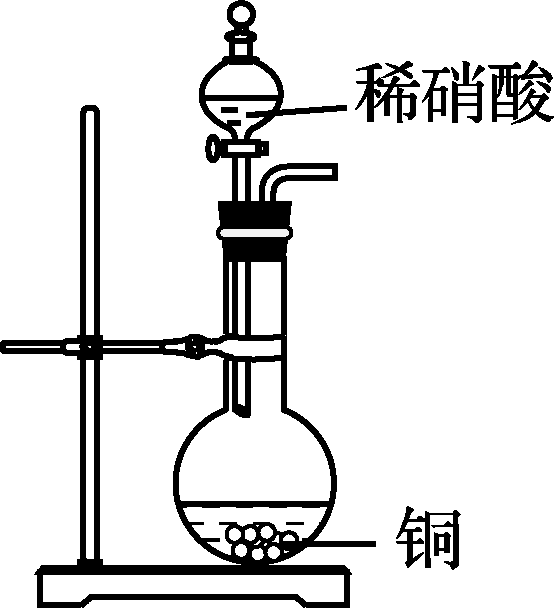
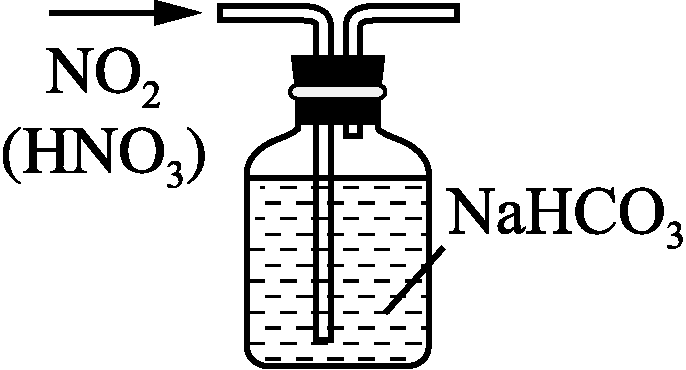
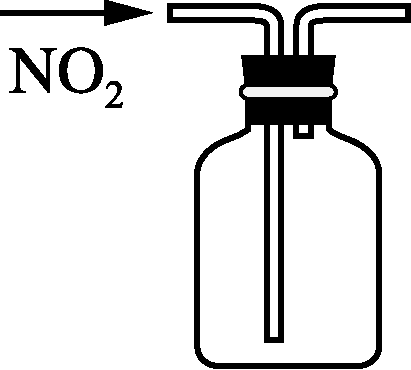
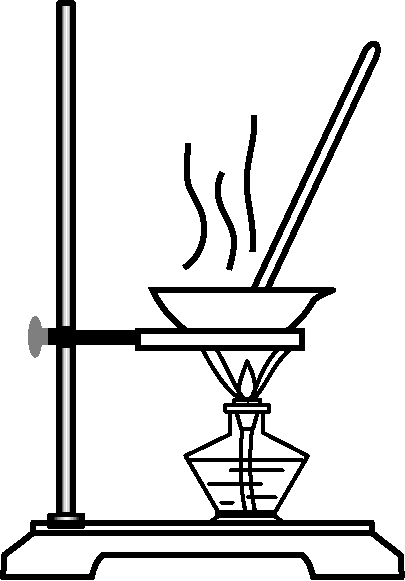
甲 乙 丙 丁
5. 短周期主族元素X、Y、Z、W原子序数依次增大,X的原子半径小于Y的原子半径,Z的单质是空气中含量最高的气体,W原子最外层比Y原子最外层少1个电子, W的单质制得的金属容器常温下可盛装浓硫酸。下列说法正确的是 ( )
6. 下列指定反应的离子方程式正确的是( )
7. 在给定条件下,下列选项所示的物质间转化均能实现的是 ( )
8. 已知:①C6H12O6(s)===2C2H5OH(l)+2CO2(g) ΔH1
② 6CO2(g)+6H2O(g)===C6H12O6(s)+6O2(g) ΔH2
③ 2H2O(g) ===2H2(g)+O2(g) ΔH3
④ 2CO2(g)+6H2(g) === C2H5OH(l)+3H2O(g) ΔH4
下列有关说法正确的是( )
9. 常温下,下列各组离子在指定溶液中可能大量共存的是 ( )
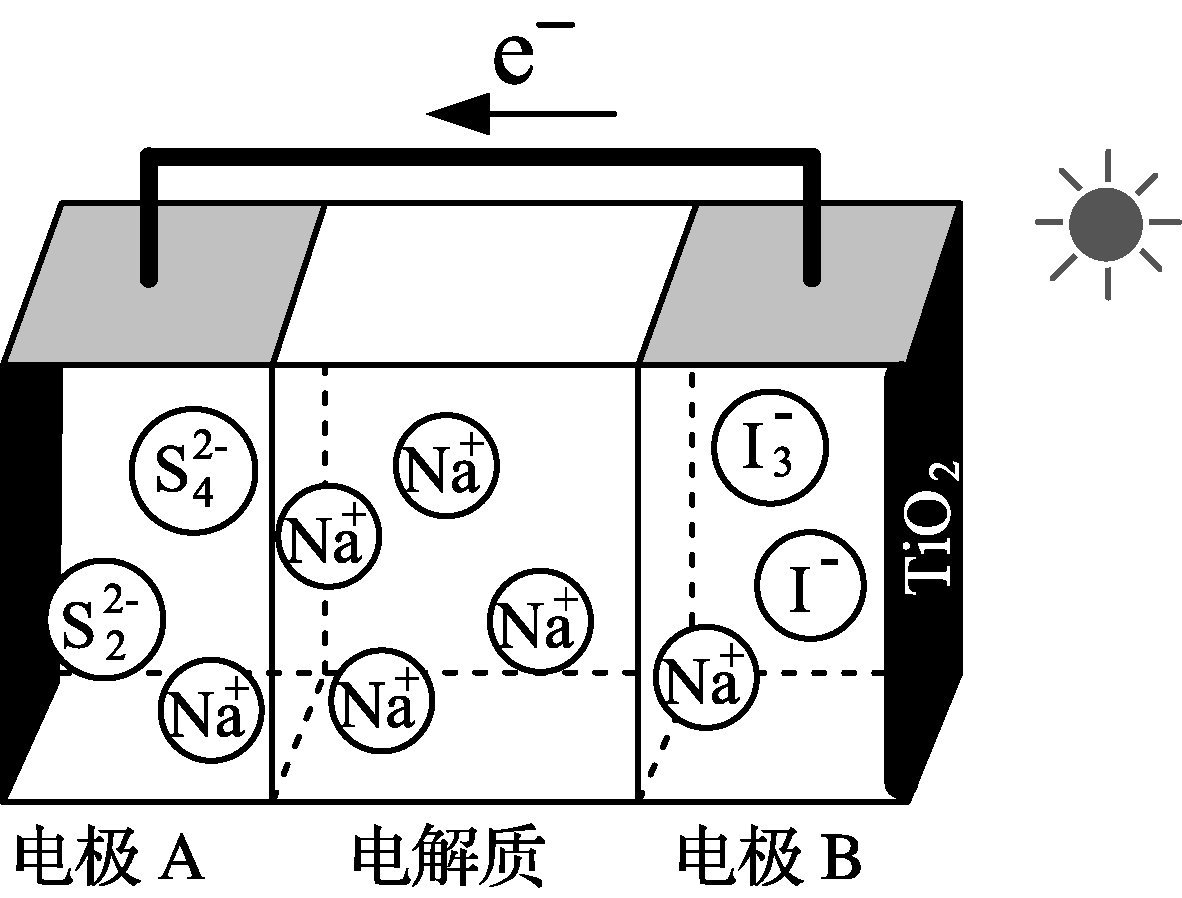
10. 某新型光充电电池结构如右图。在太阳光照射下,TiO2光电极激发产生电子,对电池充电,Na+在两极间移动。下列说法正确的是( )
不定项选择题:本题包括5小题,每小题4分,共计20分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
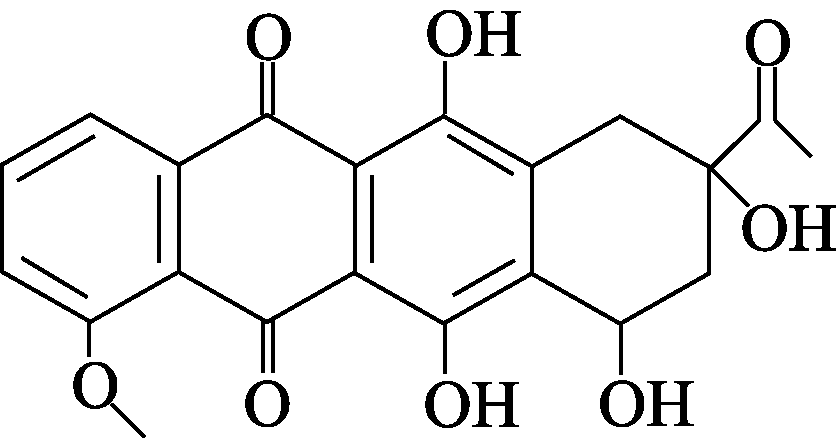
12. 下列说法正确的是( )
13. 根据下列实验操作和现象所得到的结论正确的是( )
| 选项 | 实验操作和现象 | 实验结论 |
| A | 用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色 | 该溶液中一定不含K+ |
| B | 将稀盐酸滴入硅酸钠溶液中,充分振荡,有白色沉淀产生 | 非金属性:Cl>Si |
| C | 向淀粉溶液中加入稀硫酸并加热,再加入银氨溶液,水浴加热,未见有银镜产生 | 淀粉没有水解 |
| D | 相同条件下,在两支试管中各加入4 mL 0.01 mol·L-1KMnO4和2 mL 0.1 mol·L-1H2C2O4,再向其中一支试管中快速加入少量MnSO4固体,加有MnSO4的试管中溶液褪色较快 | MnSO4对该反应有催化作用 |
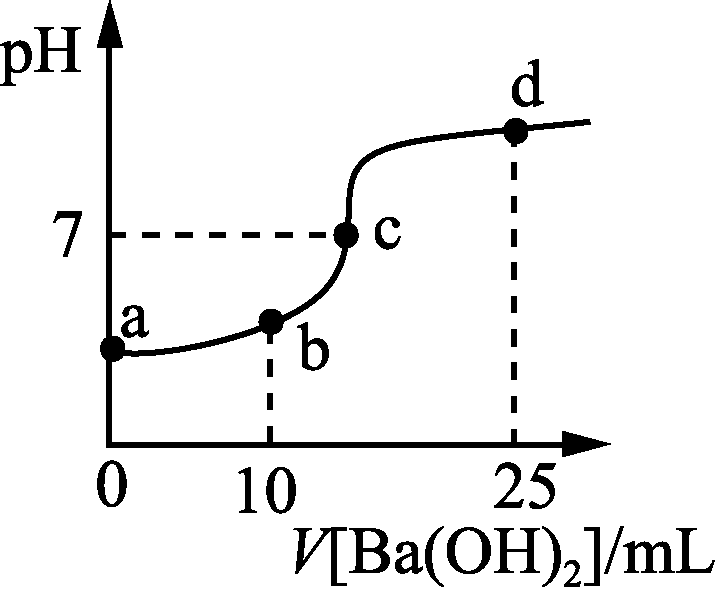 14. 常温下,向20 mL 浓度均为0.1 mol·L-1(NH4)2SO4、NH4HSO4混合溶液中滴加0.1mol·L-1的Ba(OH)2溶液。充分反应后静置,溶液的pH与所加Ba(OH)2溶液体积的关系如右图,下列说法正确的是( )
14. 常温下,向20 mL 浓度均为0.1 mol·L-1(NH4)2SO4、NH4HSO4混合溶液中滴加0.1mol·L-1的Ba(OH)2溶液。充分反应后静置,溶液的pH与所加Ba(OH)2溶液体积的关系如右图,下列说法正确的是( )
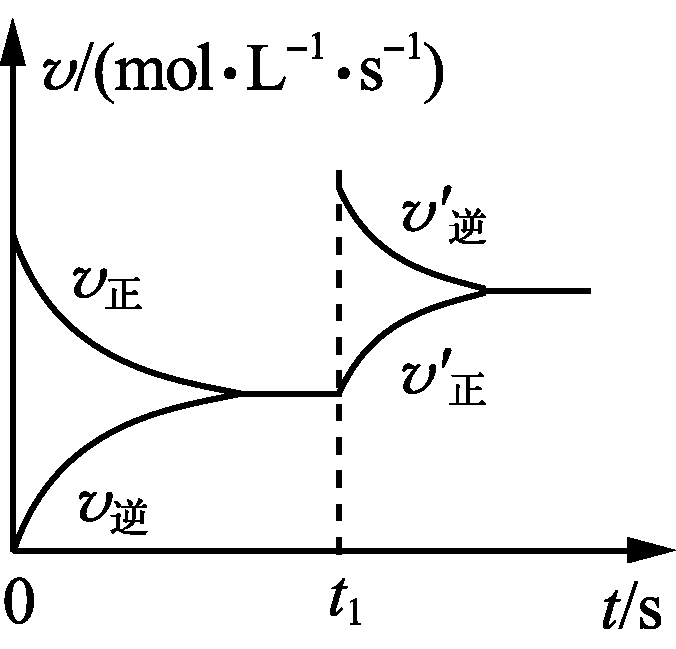 15. 温度为T时,向体积为2 L的恒容密闭容器中加入足量铁粉和0.08 mol H2O(g),发生反应3Fe(s)+4H2O(g)Fe3O4(s)+4H2(g),一段时间后达平衡。t1时刻向容器中再充入一定量的H2,再次达平衡时H2的体积分数为20%。下列说法正确的是( )
15. 温度为T时,向体积为2 L的恒容密闭容器中加入足量铁粉和0.08 mol H2O(g),发生反应3Fe(s)+4H2O(g)Fe3O4(s)+4H2(g),一段时间后达平衡。t1时刻向容器中再充入一定量的H2,再次达平衡时H2的体积分数为20%。下列说法正确的是( )
非选择题
16. (12分)碳酸钙可用作食品添加剂。以磷石膏(主要成分为CaSO4·2H2O)为原料制备碳酸钙的一种工艺流程如下:
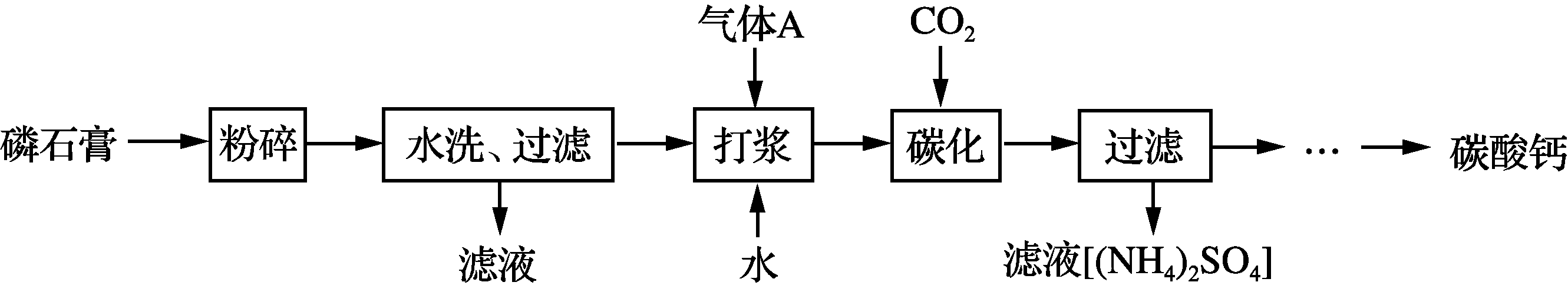
| SiO2 | P2O5 | Al2O3 | F- | Fe2O3 | |
| 水洗前/% | 9.21 | 3.08 | 0.55 | 0.68 | 0.19 |
| 水洗后/% | 8.96 | 1.37 | 0.46 | 0.29 | 0.27 |
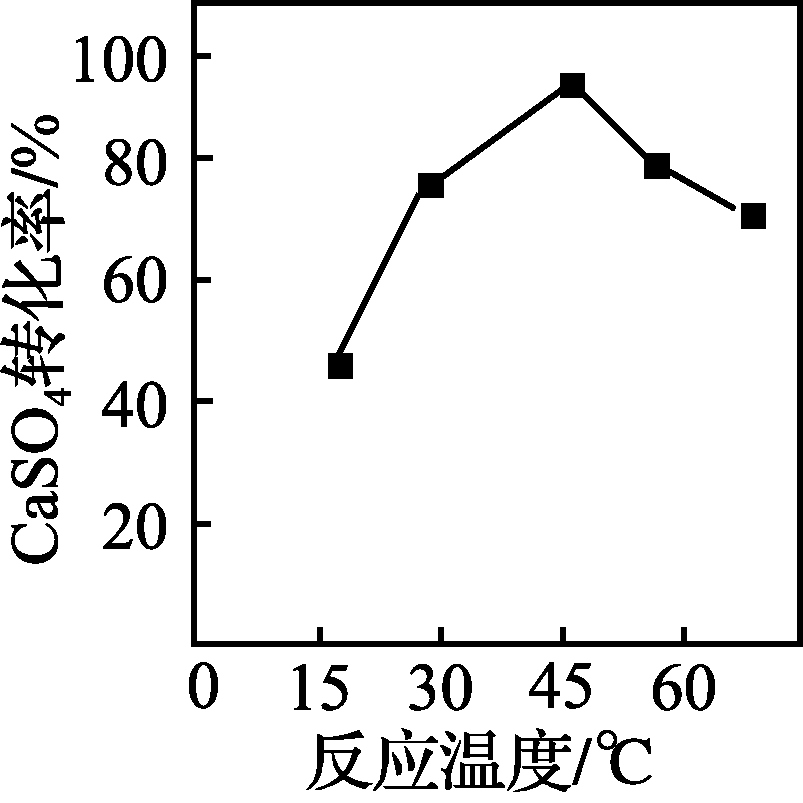 气体A的化学式为________。
气体A的化学式为________。(4) 工业上电解(NH4)2SO4溶液可制取过二硫酸铵[(NH4)2S2O8],其中S2O的结构可表示为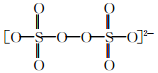 。电解时阳极的电极反应式为____________________________。过二硫酸铵可用于游泳池中水的消毒,其原因是________________________________________________________________________。
。电解时阳极的电极反应式为____________________________。过二硫酸铵可用于游泳池中水的消毒,其原因是________________________________________________________________________。
17. (15分)化合物E是一种合成高血压药物的中间体,其合成路线流程图如下:
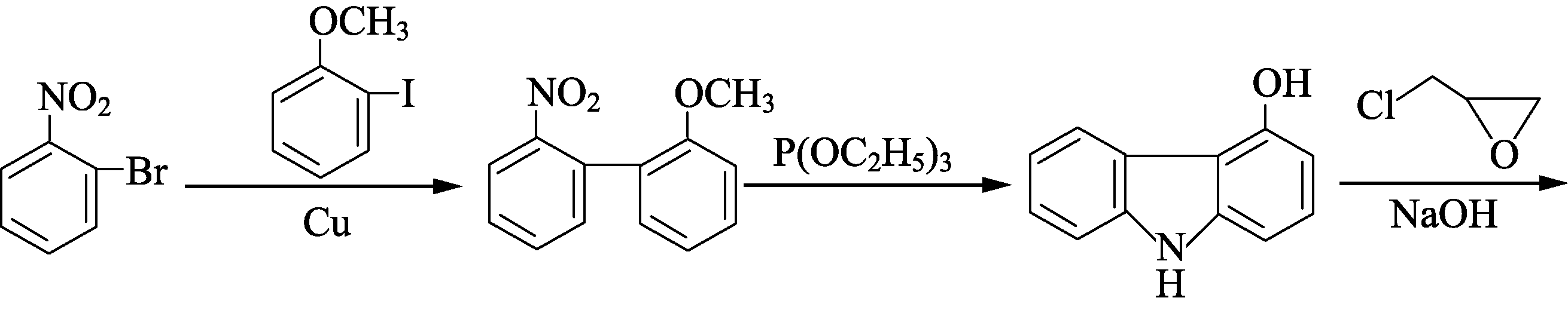
A B C
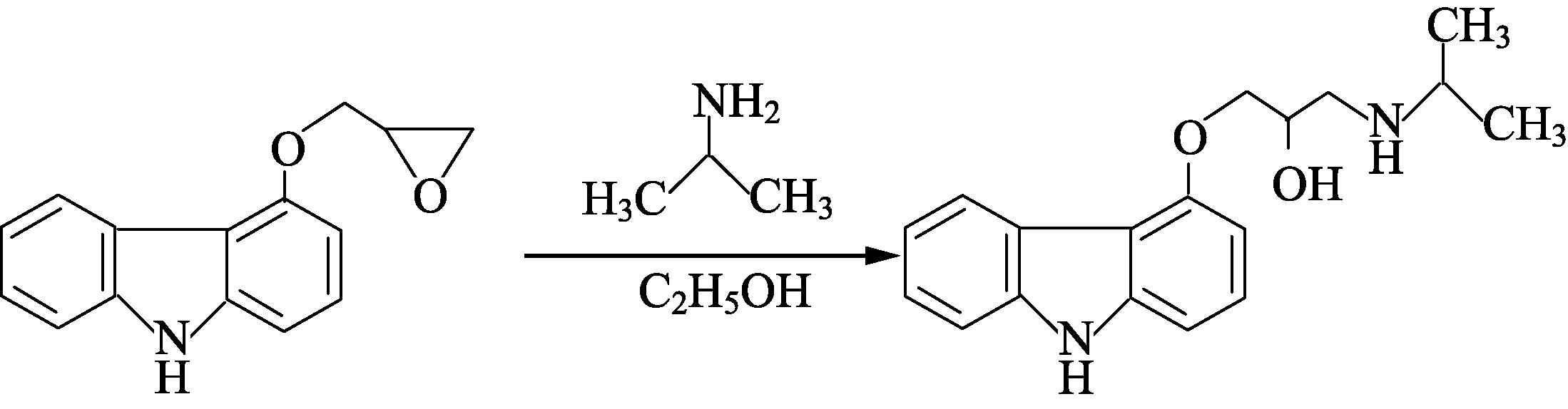
D E
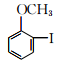 中所含官能团名称为________和________。
中所含官能团名称为________和________。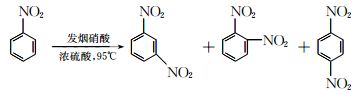 (产物中,间二硝基苯占93%)
(产物中,间二硝基苯占93%)18. (12分) 硝酸铈铵、磷酸锰铵是两种重要的复盐,在工农业生产中具有广泛应用。
(2) 硝酸铈铵[(NH4)2Ce(NO3)6]的制备方法如下:
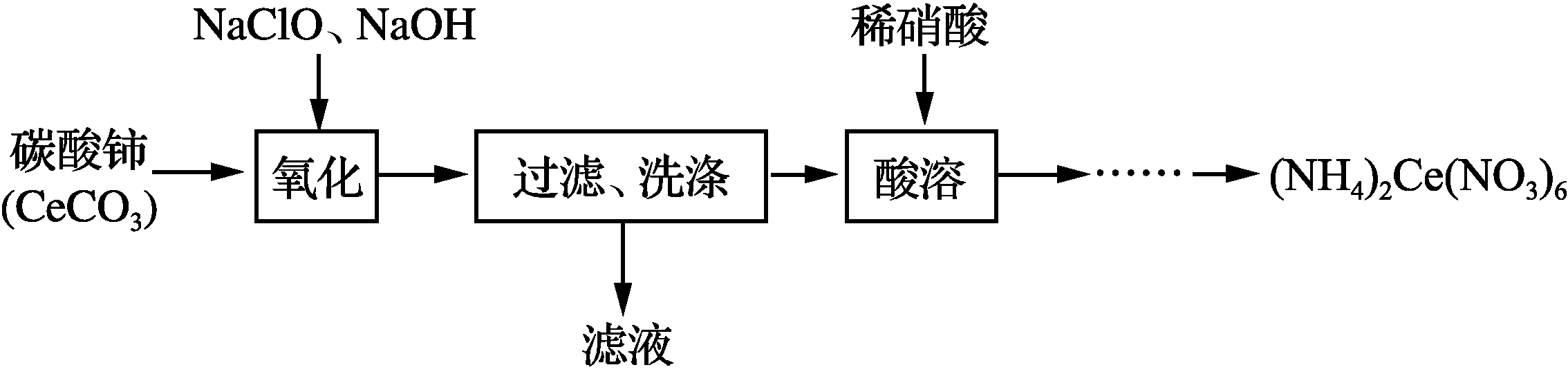
①“氧化”得到CeO2的化学方程式为________________________________。
② 证明CeO2已经洗涤干净的方法是_____________________________。
(3) 为测定磷酸锰铵[(NH4)aMnb(PO4)c·xH2O]的组成,进行如下实验:①称取样品2.448 0 g,加水溶解后配成100.00 mL溶液A;②量取25.00 mL溶液A,加足量NaOH溶液并充分加热,生成NH3 0.067 20 L(标准状况);③另取25.00 mL溶液A,边鼓空气边缓慢滴加氨水,控制溶液pH 6 ~ 8,充分反应后,将溶液中Mn2+转化为Mn3O4,得Mn3O4 0.2290 g。通过计算确定该样品的化学式(写出计算过程)。
19. (15分)黑灰的主要成分是硫化钡(BaS),常用于制取氯化钡等钡盐。
Ⅰ. 工业上常用如下方案测定黑灰中BaS含量:
步骤1:准确称取一定质量黑灰试样置于烧杯中,加入适量的蒸馏水使黑灰充分溶解。
步骤2:过滤并洗涤残留固体2~3次,将滤液、洗涤液合并后完全转移至500 mL容量瓶中,加水定容。
步骤3:取20.00 mL步骤2中溶液于锥形瓶中,再迅速加入10 mL 2% 醋酸稀溶液及25.00 mL 0.5 mol·L-1碘标准溶液(过量),充分振荡,使BaS完全转化为S。
步骤4:向锥形瓶中加入2~3滴淀粉溶液,用0.1 mol·L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液体积VmL(I2+2S2O=== 2I-+S4O)。
步骤5:……
步骤6:数据处理,计算黑灰中BaS含量。
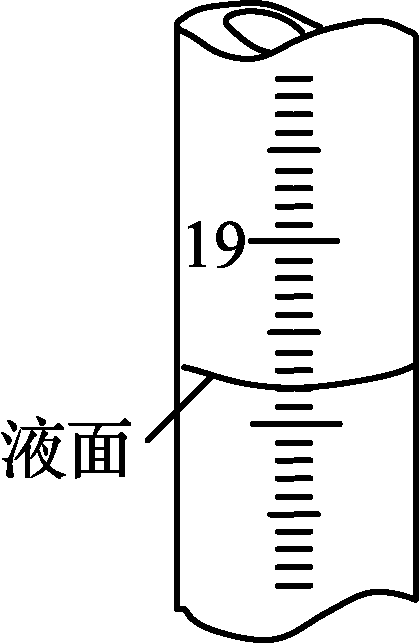 步骤2实验中所需的玻璃仪器有烧杯、漏斗、500 mL容量瓶、________。
步骤2实验中所需的玻璃仪器有烧杯、漏斗、500 mL容量瓶、________。Ⅱ. 氯化钡可用于测定煤矿酸性矿井水中硫酸盐的含量。
(实验中须使用的试剂有:稀氨水、30%双氧水、1 mol·L-1BaCl2溶液)
20. (14分)H2Y2-是乙二胺四乙酸根(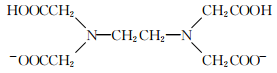 )的简写,可与多种金属离子形成络合物。
)的简写,可与多种金属离子形成络合物。
Ⅰ. H2Y2-与Fe2+形成的络合物FeY2-可用于吸收烟气中的NO。其吸收原理:
FeY2-(aq)+NO(g)![]() FeY2-(NO) (aq) ΔH<0
FeY2-(NO) (aq) ΔH<0
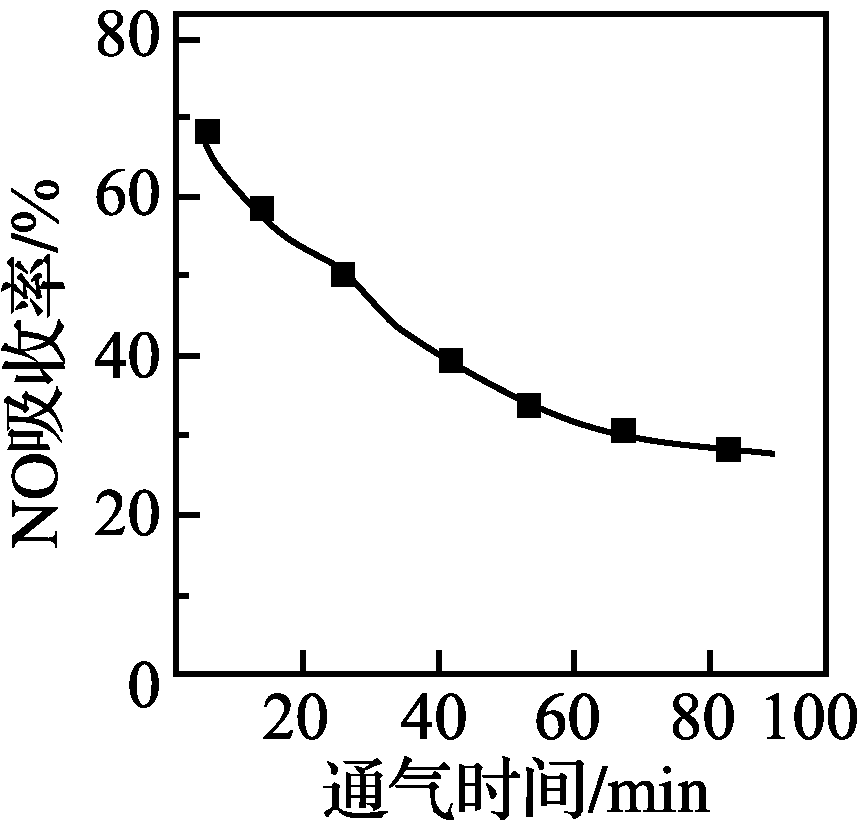
FeY2-(NO) (aq)+Fe+H2O―→FeY2-(aq)+Fe(OH)2+NH3(未配平)。若吸收液再生消耗14 g铁粉,则所吸收的烟气中含有 NO的物质的量为________。
Ⅱ. 络合铜(CuY2-)废水的处理一直是环境工程领域的研究热点。
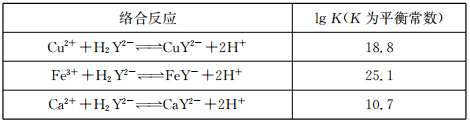
①酸性条件下,·OH可将Y4-(C10H12O8N)氧化生成CO2、H2O、N2。
该反应的离子方程式为________________________________。
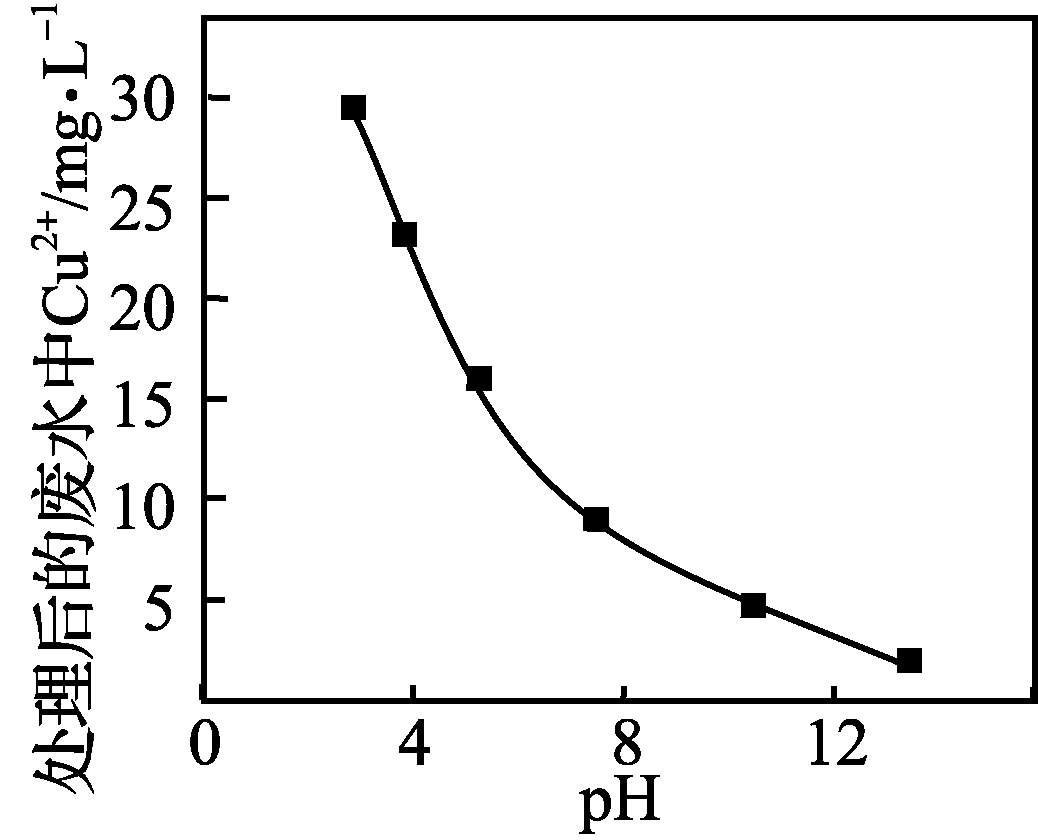
②Na2FeO4在酸性条件下不稳定。用Na2FeO4处理后的废水中Cu2+的浓度与pH的关系如图。pH越大,废水处理效果越好,这是因为___________________________。
21. (12分)【选做题】本题包括A、B两小题。请选定其中一个小题,并在相应的答题区域内作答。若多做,则按A小题评分。
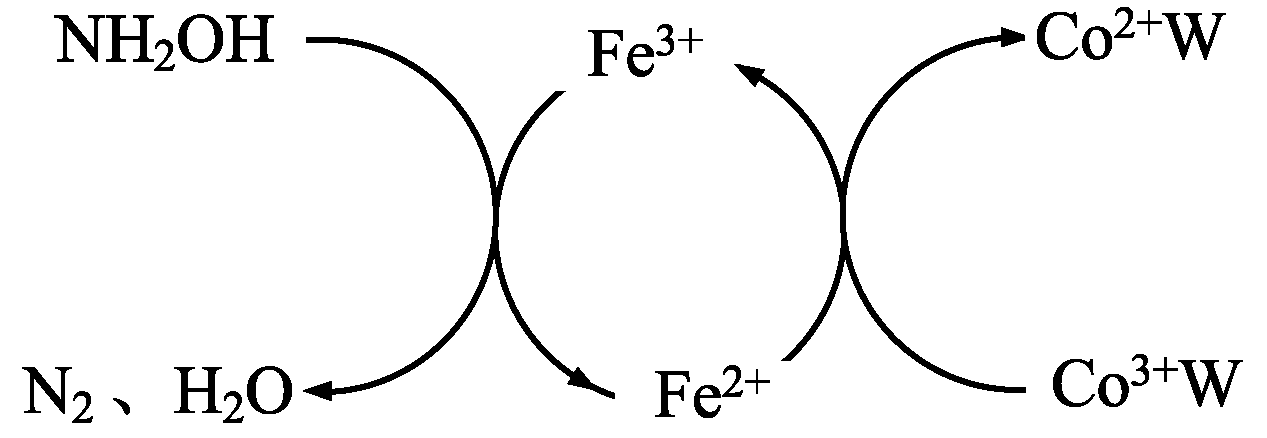
在HClO4-NaClO4介质中,K5[Co3+O4W12O36](简记为Co3+W)催化氧化NH2OH的过程如下:
B. [ 实验化学]
2甲基2己醇常用于合成洗涤剂、乳化剂等。实验室制备2甲基2己醇的流程如下:
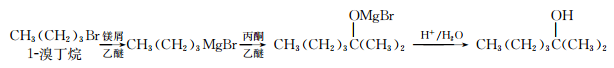
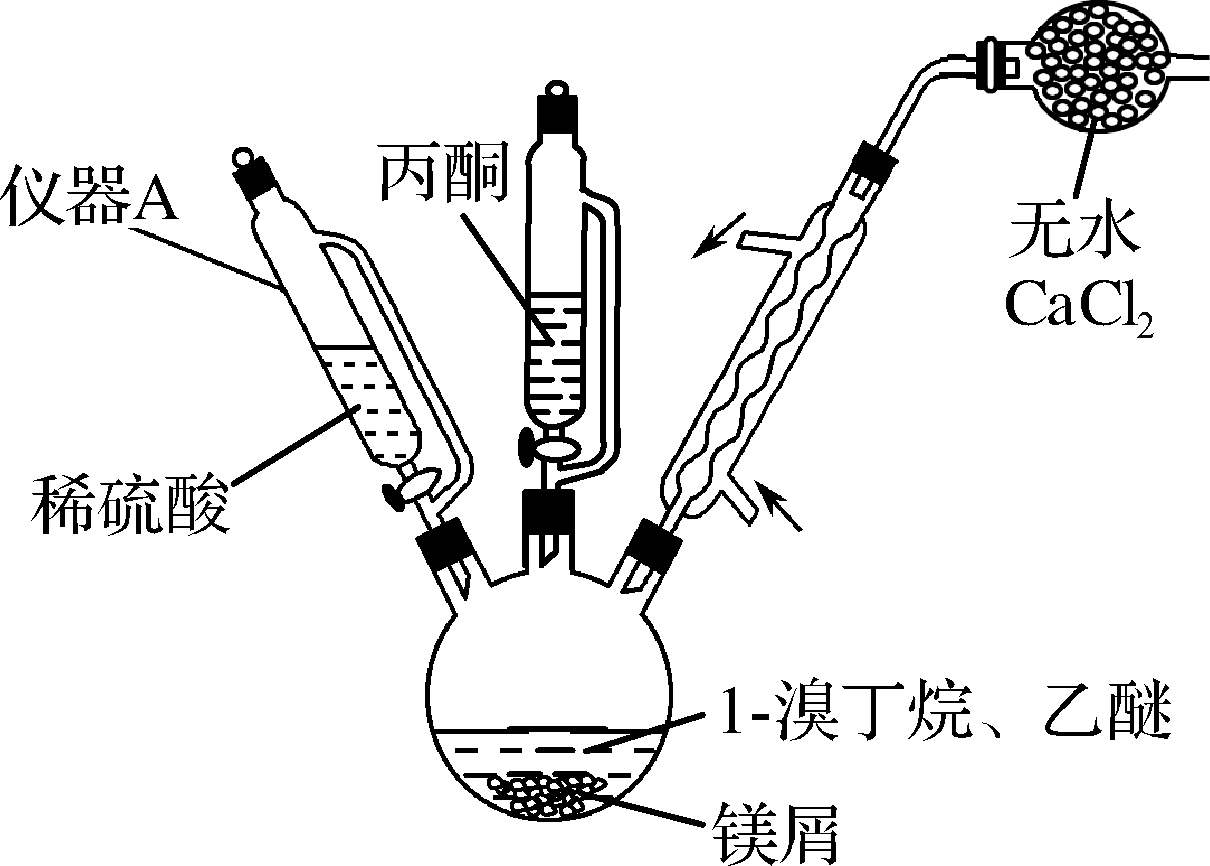 已知:RMgBr化学性质活泼,易与H2O、R′X等发生反应生成RH、R-R′。
已知:RMgBr化学性质活泼,易与H2O、R′X等发生反应生成RH、R-R′。