2018届高三年级第一次模拟考试(五)
化 学
本试卷分选择题和非选择题两部分,共120分,考试用时100分钟。
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 Mg 24 Al 27 S 32 Cl 35.5 Ba 137
选择题
单项选择题:本题包括10小题,每小题2分,共计20分。每小题只有一个选项符合题意。
- 化学与生活密切相关。下列说法不正确的是( )
- 研究海水淡化技术以缓解淡水资源紧缺问题
- 燃煤中加入CaO主要是为了减少CO2气体排放
- 绿色化学要求从源头上消除或减少生产活动对环境的污染
- 研制高性能的耐磨轮胎,可以减少PM2.5等颗粒物的产生
2. 下列有关化学用语表示正确的是( )
- 质量数为37的氯原子:Cl
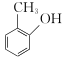
- 间甲苯酚的结构简式:
- F-的结构示意图:
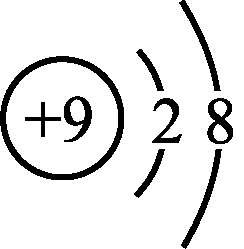
- 硫化氢的电子式:

3. 下列有关物质性质与用途具有对应关系的是( )
- 晶体硅的熔点高、硬度大,可用作半导体材料
- 浓H2SO4具有脱水性,可用来干燥HCl
- 明矾易溶于水,可用作净水剂
- Na具有强还原性,可用于高温下与TiCl4反应制备Ti
4. 下列装置或原理能达到实验目的的是( )

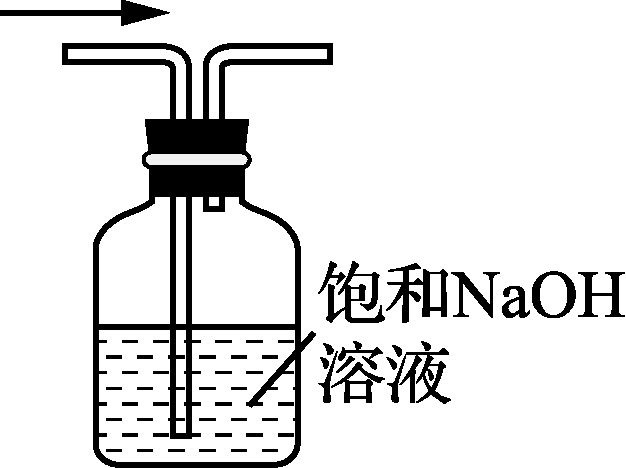
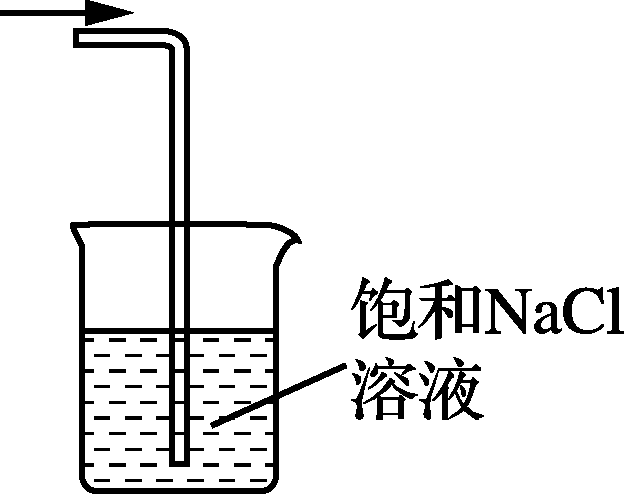

- 制取Cl2 B. 除去Cl2中的HCl C. 氯气的尾气处理 D. 测氯水的pH
5. 短周期主族元素X、Y、Z、W的原子序数依次增大,X的简单氢化物常用作制冷剂,Z的原子半径是所有短周期主族元素中最大的。Y和W同主族且W的原子序数是Y的两倍。下列说法正确的( )
- X的简单氢化物的热稳定性比Y的强
- Z与W形成化合物的水溶液可使蓝色石蕊试纸变红
- 由Y、Z两种元素组成的化合物中可能含共价键
- 离子半径的大小顺序:r(W2-)>r(Z+)>r(Y2-)>r(X3-)
6. 下列指定反应的离子方程式正确的是( )
- 醋酸溶解水垢中的CaCO3:CaCO3+2H+===Ca2++H2O+CO2↑
- 铜与稀硝酸反应:3Cu+8H++2NO===3Cu2++2NO↑+4H2O
- 用热的NaOH溶液溶解S:3S+4OH-2S2-+SO2↑+2H2O
- 向氨水中通入过量SO2:2NH3·H2O+SO2===2NH+SO+H2O
7. 在给定条件下,下列选项所示的物质问转化均能实现的是( )
- SiO2SiCl4Si
- CuSO4Cu(OH)2Cu
- 饱和NaCl(aq)NaHCO3(s)Na2CO3(s)
- FeS2(s)SO3(g)H2SO4
8. 用H2O2和H2SO4的混合溶液可溶出印刷电路板中的铜,其热化学方程式为
Cu(s)+H2O2(l)+2H+(aq)===Cu2+(aq)+2H2O(l) ΔH
已知①Cu(s)+2H+(aq)===Cu2+(aq)+H2(g) ΔH1=+64 kJ·mol-1
②2H2O2(l)===2H2O(l)+O2(g) ΔH2=-196 kJ·mol-1
③H2(g)+O2(g)===H2O(l) ΔH3=-286kJ·mol-1
下列说法不正确的是( )
- 反应①可通过铜作电极电解稀H2SO4的方法实现
- 反应②在任何条件下都能自发进行
- 若H2(g)+O2(g)===H2O(g) ΔH4,则ΔH4<ΔH3
- ΔH=-320 kJ·mol-1
9. 常温下,下列各组离子在指定溶液中能大量共存的是( )
- 无色透明溶液中:Ba2+、Fe3+、Cl-、NO;
- 能使酚酞变红的溶液中:Ca2+、K+、HCO、CO
- 0.1 mol·L-1(NH4)2Fe(SO4)2溶液中:H+、Al3+、Cl-、NO
- =10-12的溶液中:NH、Cu2+、NO、SO
10. 下列图示与对应的叙述相符的是( )
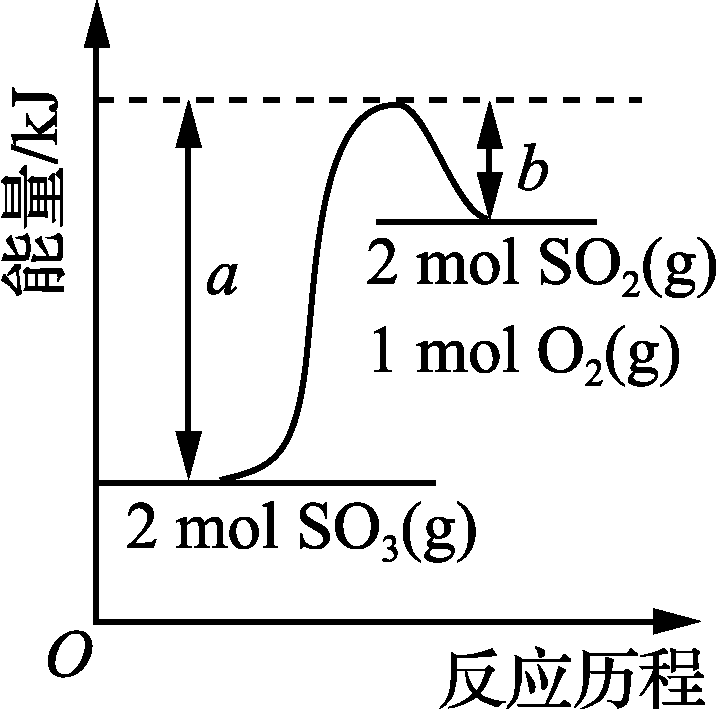
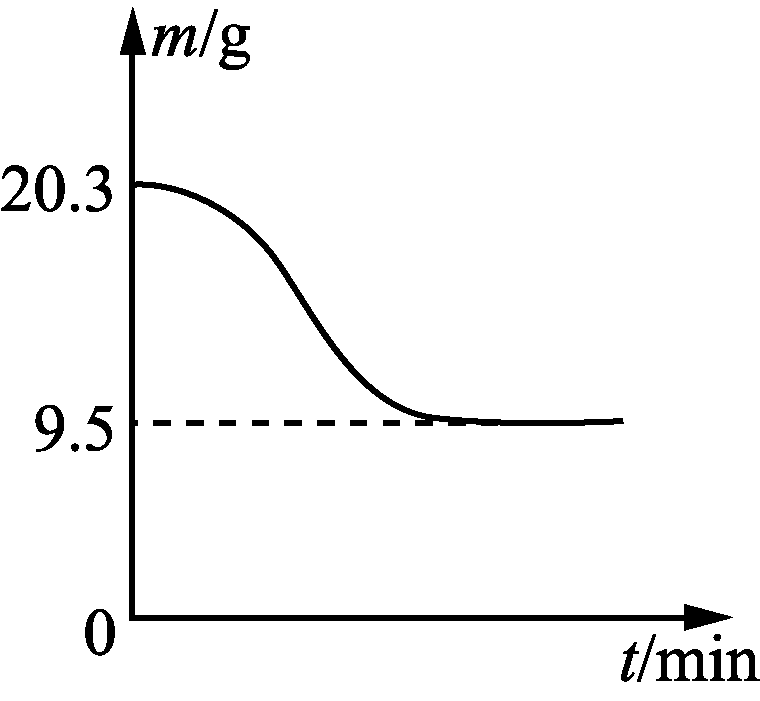
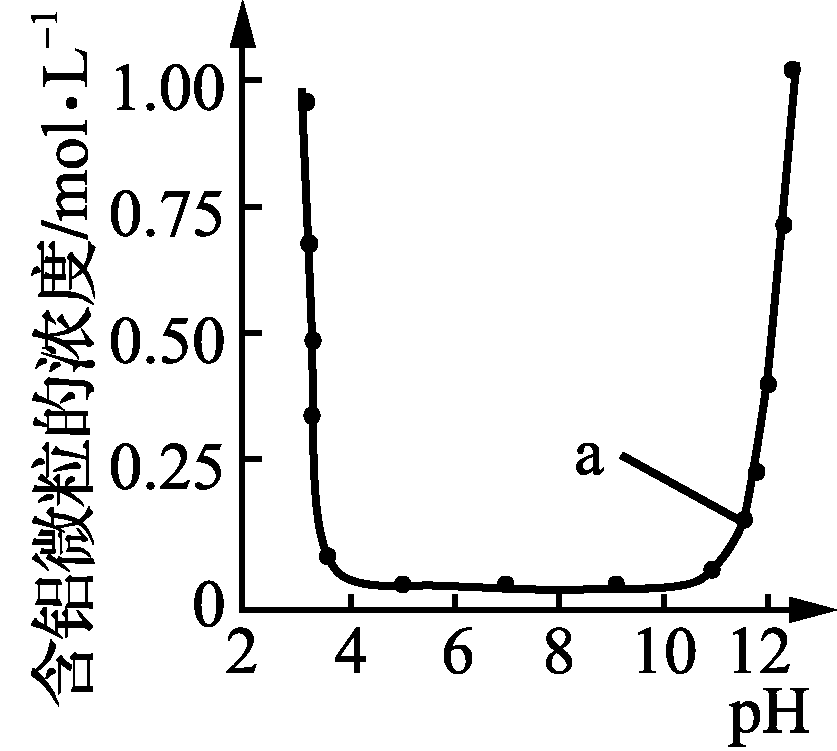
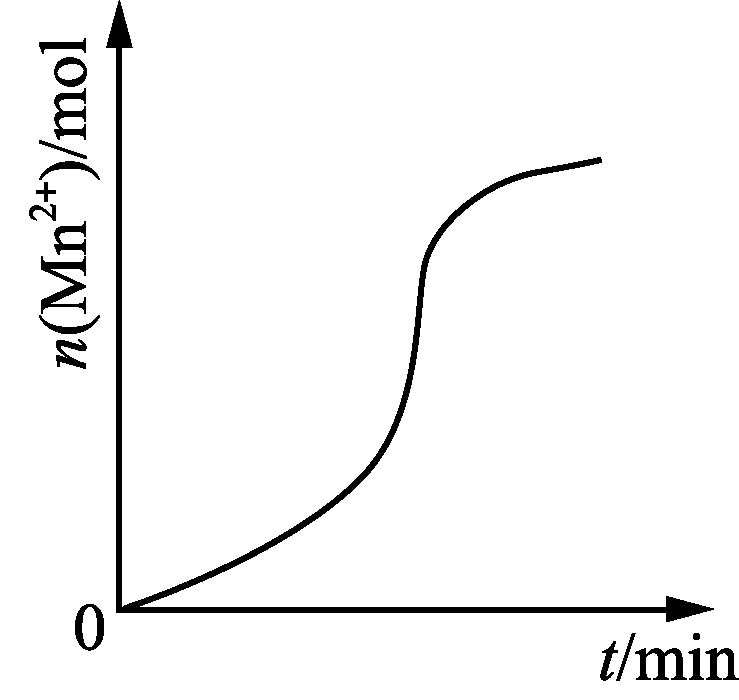
甲 乙 丙 丁
- 由图甲可知,2SO3(g)2SO2(g)+O2(g) ΔH=(b-a)kJ·mol-1
- 图乙表示0.1 mol MgCl2·6H2O在空气中充分加热时残留固体质量随时间的变化
- 图丙表示Al3+与OH-反应时含铝微粒浓度变化曲线,图中a点溶液中存在大量Al3+
- 图丁表示10 mL 0.01 mol·L-1酸性KMnO4溶液与过量的0.1 mol·L-1的H2C2O4溶液混合时,n(Mn2+)随时间的变化(Mn2+对反应有催化作用)
不定项选择题:本题包括5小题,每小题4分,共计20分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
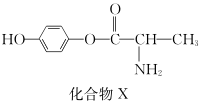 11. 化合物X是一种用于合成γ分泌调节剂的药物中间体,其结构简式如右图所示。下列有关化合物X的说法正确的是( )
11. 化合物X是一种用于合成γ分泌调节剂的药物中间体,其结构简式如右图所示。下列有关化合物X的说法正确的是( )
- 化合物X分子中没有手性碳原子
- 化合物X能与FeCl3溶液发生显色反应
- 1 mol化合物X最多能与2 mol NaOH反应
- 化合物X能发生水解反应,一定条件下可水解得到一种α氨基酸
12. 下列说法正确的是( )
- 合成氨反应是放热反应,所以工业上采用低温条件以提高氨的产率
- 钢铁水闸可用牺牲阳极或外加电流的阴极保护法延缓其腐蚀
- Na2O2与水反应产生1 mol O2,理论上转移的电子数约为4×6.02×1023
- 保持温度不变,向稀氨水中缓慢通入CO2,溶液中的值增大
13. 根据实验操作和现象所得出的结论正确的是 ( )
| 选项 | 实验操作和现象 | 结论 |
| A | 向NaI溶液中滴入少量新制氯水和苯,振荡、静置,溶液上层呈紫色 | I-还原性强于Cl- |
| B | 向某溶液中滴加H2O2溶液后再加入KSCN,溶液呈红色 | 溶液中一定含有Fe2+ |
| C | 测定等浓度的Na2CO3和Na2SO3溶液的pH,Na2CO3的pH大于Na2SO3溶液 | S的非金属性比C强 |
| D | 向蔗糖溶液中加入少量稀硫酸并加热,冷却,加入新制Cu(OH)2悬浊液,加热,未出现红色沉淀 | 蔗糖未水解 |
14. 室温下,下列溶液中微粒的物质的量浓度关系正确的是( )
- 0.10 mol·L-1CH3COONa溶液中通入HCl气体至中性:
c(CH3COO-)>c(Na+)>c(H+)=c(OH-) - 已知Ka(CH3COOH)=1.8×10-5,Ka(HNO2)=1.75×10-4,相同浓度的CH3COONa和NaNO2混合溶液中:c(Na+)>c(NO)>c(CH3COO-)>c(OH-)
- 0.10 mol·L-1氨水与0.05 mol·L-1盐酸等体积混合:
c(OH-)+c(NH3·H2O)=c(H+)+c(Cl-) - 50 mL 0.05 mol·L-1 H2C2O4溶液与25 mL 0.10 mol·L-1 NaOH溶液混合后
溶液pH=2.9:c(Na+)>c(HC2O)>c(H2C2O4)>c(C2O)
15. 甲、乙两个密闭容器中均发生反应:C(s)+2H2O(g)CO2(g)+2H2(g) ΔH>0,有关实验数据如下表所示:
| 容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 平衡
常数 |
| C(s) | H2O(g) | H2(g) |
| 甲 | 2 | T1 | 2.0 | 4.0 | 3.2 | K1 |
| 乙 | 1 | T2 | 1.0 | 2.0 | 1.2 | K2 |
下列说法正确的是( )
- K1=12.8
- T1
- T1℃时向甲容器中再充入0.1 mol H2O(g),则平衡正向移动,CO2(g)的体积分数增大
- 若在T2温度下,向2 L密闭容器中充入1.0 mol CO2和2.0 mol H2,达平衡时,CO2的转化率小于40%
非选择题
16. (12分)某工厂以硝酸为原料生产亚硝酸钠,其工艺流程如下:
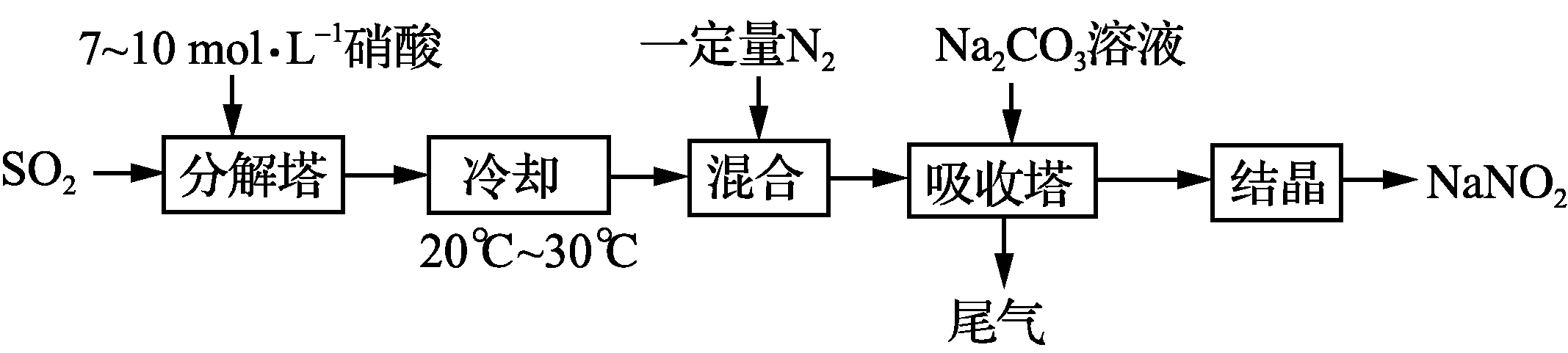
已知:Na2CO3+NO+NO2===2NaNO2+CO2
- “分解塔”中SO2从塔底进入,硝酸从塔顶喷淋,其目的是_____________________。
- “分解塔”中的温度不宜过高,其原因是____________________________________。
- 按一定计量比在“分解塔”中通SO2和喷入硝酸,若反应后生成的NO与NO2物质的量之比恰好1∶1,则“分解塔”中发生反应的化学方程式为_________________________。
- “分解塔”中的硝酸浓度不宜过大的原因是__________________________________。
- 为提高氮氧化物的转化率,可向“尾气”中通入一定量的________气体,再通入“吸收塔”中,实现循环吸收。
- “吸收塔”所得溶液中除含有NaNO2、NaNO3和少量Na2CO3外,还含有的溶质为__________________(填化学式)。
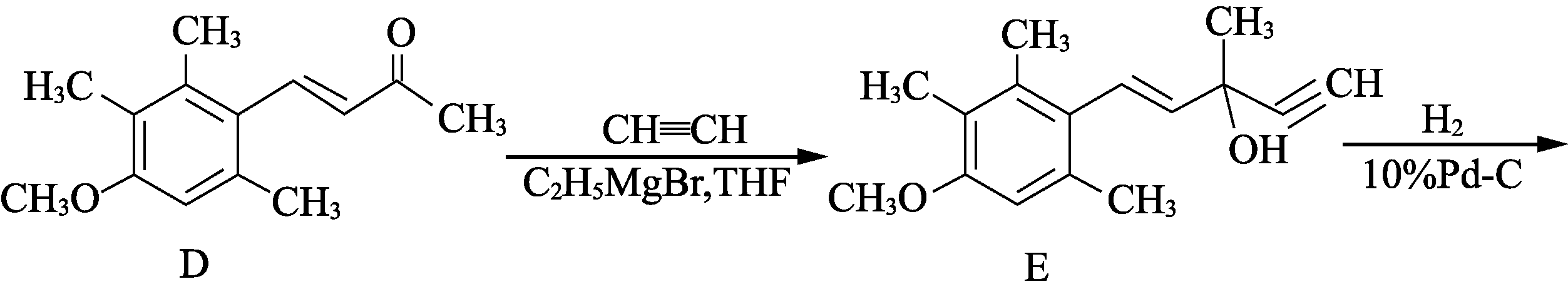
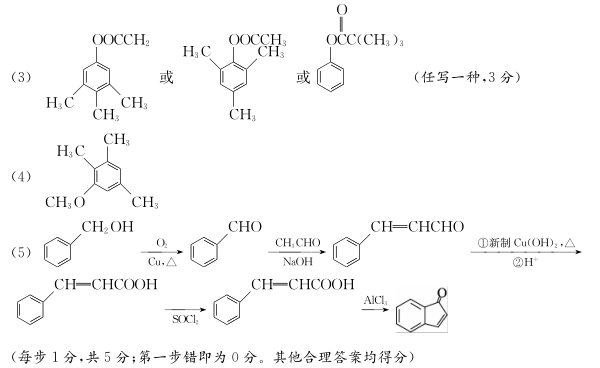
17. (15分)有机物F是合成药物“银屑灵”的中间体,其合成流程如下:
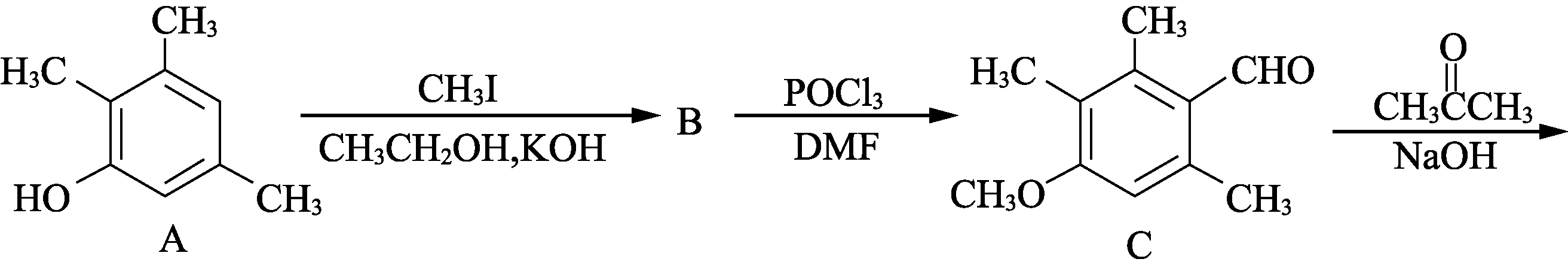
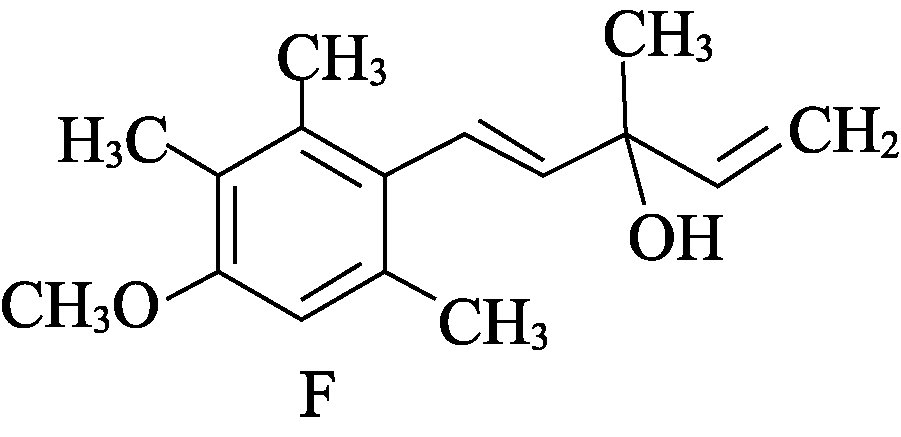
- 化合物C中含氧官能团的名称为________、________。
- D→E的反应类型为________________。
- 写出同时满足下列条件的C的一种同分异构体的结构简式:____________________。
①不能发生银镜反应;
②能发生水解反应,其水解产物之一能与FeCl3溶液发生显色反应;
③分子中有4种不同化学环境的氢。 - 化合物B的分子式为C10H14O,写出B的结构简式:________________。
- 已知:
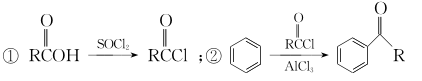 以苯甲醇、乙醛为原料制备
以苯甲醇、乙醛为原料制备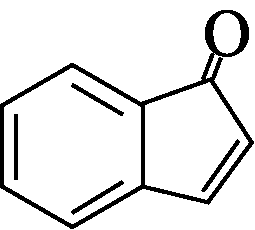 ,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
18. (12分)含铁化合物在生活生产中应用广泛。如高铁酸盐(FeO)被科学家们公认为绿色消毒剂,在强碱性溶液中比较稳定;聚合硫酸铁则是一种高效絮凝剂。
- KClO饱和溶液与Fe(NO3)3饱和溶液反应可制备K2FeO4,两种溶液的混合方式为________________,反应的离子方程为__________________________。
- 高铁酸盐有极强的氧化性,能迅速有效地去除淤泥中的臭味物质,自身被还原成新生态的Fe(OH)3。已知Ksp[Fe(OH)3]=1.0×10-38。若要使溶液中Fe3+沉淀完全(使其浓度小于10-5 mol·L-1),需调节溶液的pH>________。
- 聚合硫酸铁[Fex(OH)y(SO4)z]的组成可通过下列实验测定:
①称取一定质量的聚合硫酸铁配成100.00 mL溶液A;
②准确量取20.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体11.65 g;
③准确量取20.00 mL溶液A,加入足量铜粉,充分反应后过滤、洗涤,将滤液和洗液合并配成250.00 mL溶液B;
④准确量取25.00 mL溶液B,用0.1000 mol·L-1的酸性KMnO4溶液滴定至终点,消耗KMnO4溶液8.00 mL。
通过计算确定该聚合硫酸铁的化学式(写出计算过程)。
19. (15分)实验室用硼镁泥为原料制取MgSO4·7H2O粗产品的过程如下:
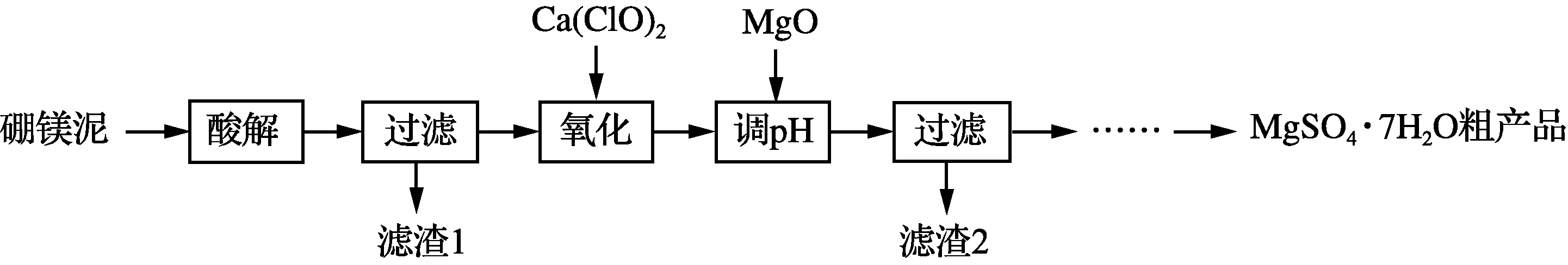
硼镁泥的主要成分如下表:
| MgO | SiO2 | FeO、Fe2O3 | CaO | Al2O3 | B2O3 |
| 30%~40% | 20%~25% | 5%~15% | 2%~3% | 1%~2% | 1%~2% |
- “酸解”时为提高Mg2+的浸出率,可采用的措施是________(写一种)。所加酸不宜过量太多的原因是________。
- “氧化”步骤中,若用H2O2代替Ca(ClO)2,则发生反应的离子方程式为____________________________。实际未使用H2O2,除H2O2成本高外,还可能的原因是______________________。
- “调pH”时用MgO而不用NaOH溶液的原因是____________________。
- 结合附表信息,由MgSO4·7H2O粗产品(含少量CaSO4)提纯获取MgSO4·7H2O的实验方案如下:将粗产品溶于水,________,室温下自然挥发干燥。(实验中必须使用的试剂有:饱和MgSO4溶液,乙醇)
附:两种盐的溶解度(g/100 g水)
| 温度℃ | 10 | 30 | 40 | 50 |
| CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 |
| MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 |
20. (14分)锅炉水垢既会降低燃料的利用率、影响锅炉的使用寿命,还可能造成安全隐患。某锅炉水垢的主要成分有CaCO3、CaSO4、Mg(OH)2、Fe2O3,用酸洗法可除去该水垢,其基本原理如下图所示。
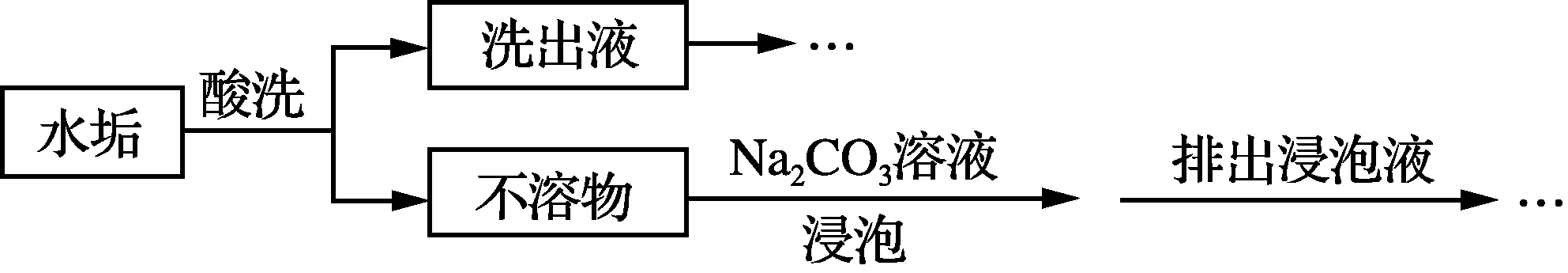
- “酸洗”时,一般不选用稀硫酸的原因是_______________________________。
- “不溶物”用碳酸钠溶液浸泡的目的是________________________________(用离子方程式表示)。
- 为防止洗出液中的Fe3+腐蚀铁质管道,常在洗出液中加入SnCl2溶液,反应中Sn2+转化为Sn4+,则Sn2+与Fe3+反应的物质的量之比为________。
- 柠檬酸(用H3R表示)可用作酸洗剂,溶液中H3R、H2R-、HR2-、R3-的含量与pH的关系如图1所示。图中a曲线所代表的微粒的百分含量随溶液pH的改变而变化的原因是______________________________________(用平衡移动原理解释)。HR2-电离常数为Ka3,请根据图示信息计算出pKa3=________(pKa3=-lg Ka3)。
- 利用如图2所示装置对锅炉水(含Ca2+、Mg2+、HCO)进行预处理,可有效防止锅炉水垢的形成。写出电解过程中,Ca2+形成沉淀的电极反应方程式:________________________________________________________________________。
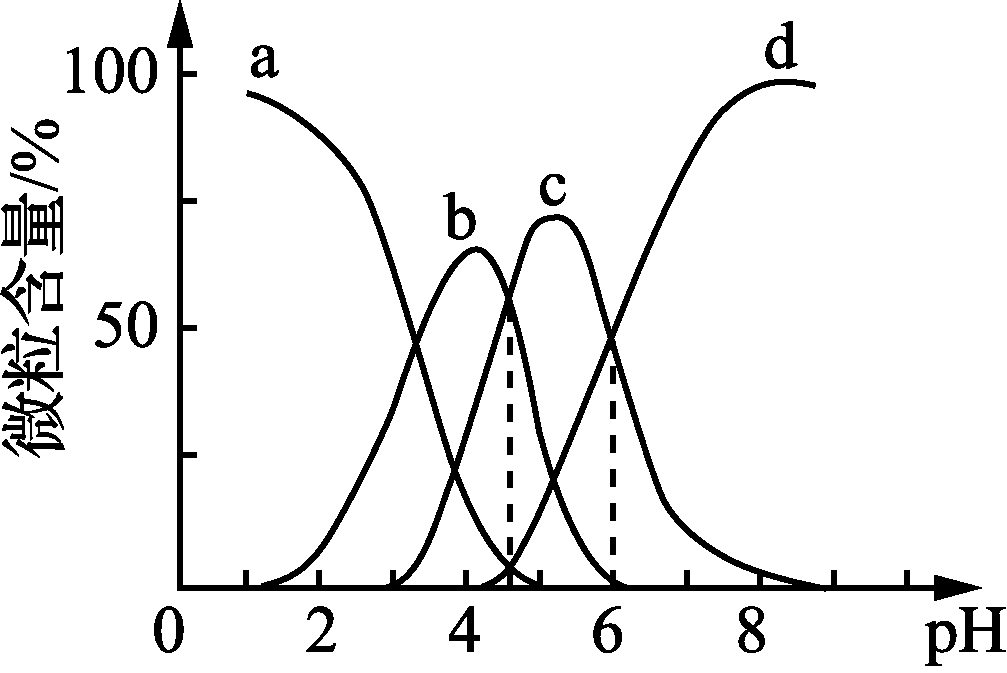
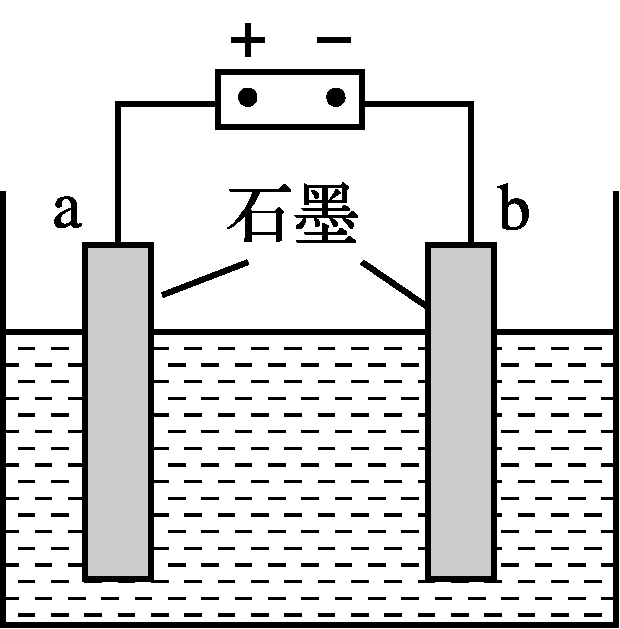
图1 图2
21. (12分)(CN)2、(OCN)2等被称为拟卤素,(CN)2在一定条件下氢化可以得到乙二胺(H2NCH2CH2NH2)。回答下列问题:
- Fe4[Fe(CN)6]3是较早发现的CN-配合物,其中铁元素呈现两种不同的价态。写出外界离子基态核外电子排布式:________________。
- 与OCN-互为等电子体的分子为________(填分子式)。
- 1 mol(CN)2中含有π键的数目为________。
- 乙二胺中C原子的轨道杂化方式为________。
- 乙二胺易溶于水,除因为是极性分子外,还可能的原因为________。
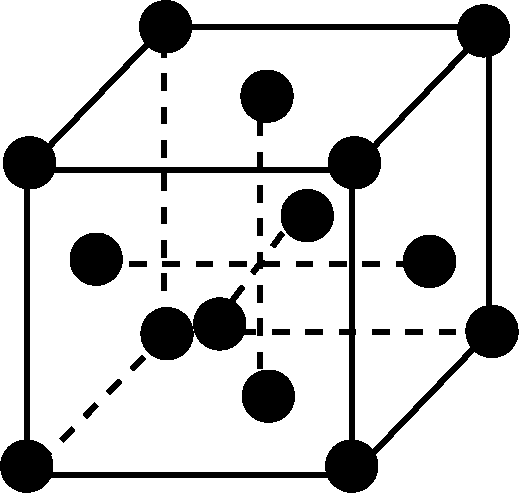
- 含CN-的配合物常用于冶炼黄金。金的晶胞结构如下图所示,晶体中每个Au原子周围紧邻且等距的Au原子有________个。
2018届苏州高三年级第一次模拟考试
化学参考答案
选择题(40分)
单项选择题:本题包括10小题,每小题2分,共计20分。每小题只有一个选项符合题意。
- B 2. C 3. D 4. A 5. C 6. B 7. C 8. C 9. D 10. D
不定项选择题:本题包括5小题,每小题4分,共计20分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
11. BD 12. B 13. A 14. BC 15. AD
非选择题(80分)
16. (12分)
- 使SO2气体被充分吸收(2分)
- 硝酸受热会挥发 分解(2分)
- 2HNO3+2SO2+H2O===NO+NO2+2H2SO4(2分)
- 硝酸浓度过大,氮氧化物中NO2含量高,导致亚硝酸钠产率降低(或硝酸钠含量过高)(2分)
- O2(2分)
- NaHCO3(2分)
17. (15分)
- 醛基、醚键(各1分)
- 加成反应(2分)
 18. (12分)
18. (12分)
- 在搅拌下,将Fe(NO3)3饱和溶液缓慢滴加到KClO饱和溶液中(2分)
3ClO-+2Fe3++10OH-===2FeO+3Cl-+5H2O(2分) - 3(2分)
- 20.00 mL溶液中:n(SO)==0.050 0 mol(1分)
根据:5Fe3+~5Fe2+~MnO(1分)
n(Fe3+)=5n(MnO)=5×0.100 0 mol·L-1×8.00 mL×10-3 L·mL-1×
=0.040 0 mol(1分)
由电荷守恒:3n(Fe3+)=2n(SO)+n(OH-)
n(OH-)=3n(Fe3+)-2n(SO)=3×0.040 0 mol-2×0.050 0 mol=0.020 0 mol
n(Fe3+)∶n(OH-)∶n(SO)=0.040 0 mol∶0.020 0 mol∶ 0.050 0 mol=4∶2∶5
聚合硫酸铁的化学式为Fe4(OH)2(SO4)5(1分)
19. (15分)
- 加热/搅拌/提高酸液浓度等(2分)
避免调pH时消耗过多的MgO(2分) - H2O2+2Fe2++2H+===2Fe3++2H2O(2分)
H2O2不稳定易分解或Fe3+等金属离子会催化H2O2的分解(2分) - 防止加入的NaOH引入Na+杂质(2分)
- 加热浓缩,趁热过滤;将滤液冷却结晶,过滤,用饱和MgSO4溶液洗涤,再用乙醇洗涤(5分)
20. (14分)
- 稀硫酸与碳酸钙反应会生成微溶物硫酸钙,覆盖在反应物表面,阻止反应进一步进行(2分)
- CaSO4+CO
 CaCO3+SO(2分)
CaCO3+SO(2分) - 1∶2(2分)
- 随溶液pH增大,平衡H3R
 H2R-+H+向右移动,故H3R的百分含量减小 6(3分)
H2R-+H+向右移动,故H3R的百分含量减小 6(3分) - 2Ca2++2HCO+2e-===2CaCO3↓+H2↑(3分)
或2H2O+2e-===H2↑+2OH- Ca2++OH-+HCO===CaCO3↓+H2O(2分)
21. (12分)
- [Ar]3d5(或1s22s22p63s23p63d5)(2分)
- CO2、N2O、CS2等(2分)
- 4 mol或2.48×1014(2分)
- sp3(3分)
- 乙二胺与水分子间可以形成氢键(2分)
- 12(2分)










 11. 化合物X是一种用于合成γ分泌调节剂的药物中间体,其结构简式如右图所示。下列有关化合物X的说法正确的是( )
11. 化合物X是一种用于合成γ分泌调节剂的药物中间体,其结构简式如右图所示。下列有关化合物X的说法正确的是( )


 以苯甲醇、乙醛为原料制备
以苯甲醇、乙醛为原料制备




 18. (12分)
18. (12分)