
湖南省醴陵二中、醴陵四中2016-2017学年高二下学期期中联考化学试卷
03月05日
余江一中2016届高三第二次模拟考试 化学试卷
命题人:吴新生 审题人:周军建
时间:90分钟 总分:100分
相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 Al-27 S-32 K-39 Fe-56 Cu-64
一、选择题(每小题只有一个正确答案,每小题3分,共48分)
1、设NA表示阿伏加德罗常数的值,下列说法中不正确的( )
A、2克16O2和14N2的混合气中含有的电子数为NA个
B、1 mol Na与O2完全反应生成Na2O和Na2O2的混合物,转移电子总数为NA个
C、Na2O和Na2O2的混合物中若含有1mol Na+,则其含有阴离子总数为0.5NA
D、常温下,1.0 L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA
2、甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如下图所示(某些条件和部分产物已略去)。下列说法不正确的是( )
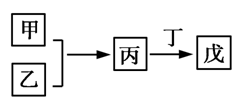
A.若甲既能与盐酸反应又能与NaOH溶液反应,则丙可能属于两性氧化物
B.若丙、丁混合产生白烟,且丙为18电子分子,则乙的水溶液可能具有漂白作用
C.若甲、丙、戊含有同一种元素,该元素的化合价由低到高的顺序可能为甲<丙<戊
D.若甲为短周期中原子半径最大的主族元素的单质,且戊为碱,则丙只能为Na2O2
3、同温同压下,三个等体积的干燥圆底烧瓶中分别充满①HCl ②NO2③体积比为1:1的NO2和O2,进行喷泉实验。经充分反应后烧瓶内溶质的物质的量浓度之比为()
A、1: 1 :1B、4: 4 :5C、5: 5 :4D、15: 10 :12
4、将25.6克的铜完全溶于适量的浓硝酸中,收集到氮的氧化物(NO2、N2O4、NO)的混合气,这些混合气恰好能被250ml 2mol/L NaOH溶液完全吸收,生成NaNO2和NaNO3的盐溶液,则其中NaNO3的物质的量为( )
A、0.1 molB、0.2 molC、0.3molD、0.4 mol
5、下列操作能达到实验目的的是( )
| 选项 | 实 验 目 的 | 实 验 操作 |
| A | 验证金属性Na大于铁 | 向FeCl3溶液中加金属钠,观察是否有铁析出 |
| B | 验证NaI溶液中是否含有FeI2 | 向NaI溶液中加入酸性KMnO4溶液,振荡,观察溶液是否褪色 |
| C | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 |
| D | 验证Br2的氧化性强于I2 | 将少量溴水加入KI溶液中,再加入CCl4,振荡,静置,可观察到下层液体呈紫色 |
6、强热硫酸亚铁固体可反应:FeSO4FexOy + SO2↑ + O2↑ +SO3↑(未配平),则下列有关判断不正确的是( )
A、若所得气体中SO2与O2的体积比为2:1,则FexOy为氧化亚铁
B、若所得FexOy为氧化铁,则气体中SO2与O2的体积比大于2:1
C、若所得FexOy为Fe3O4,则气体中SO2与O2的体积比为3:2
D、生成的混合气通入BaCl2溶液中,产生的沉淀为BaSO4
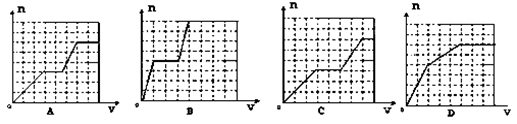
7、已知HCO3―+AlO2―+H2O=CO32―+Al(OH)3↓;将KHCO3溶液不断滴入含等物质的量的KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与滴入的KHCO3溶液体积的关系可表示为( )
8、2013年12月5日中国辽宁舰航母编队中的登陆舰紧急逼停了擅闯南海禁航区的美海军“考本斯”号导弹巡洋舰。据悉,美国“考本斯”号巡洋舰上的核反应堆内使用了液体铝钠合金(单质钠和单质铝熔合而成)做载热介质。下列有关说法不正确的是( )
A.自然界中没有游离的钠和铝
B.若铝钠合金投入水中得无色溶液,则n(Al)≤n(Na)
C.铝钠合金投入到足量氯化铜溶液中,一定有氢氧化铜沉淀,可能有铜和氧化铜
D.m g不同组成的铝钠合金投入足量盐酸中,若放出的H2越多铝的质量分数越小
9、工业上用铝土矿(主要成分为Al2O3,含Fe2O3等杂质)为原料冶炼铝的工艺流程如下:
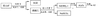
对上述流程中的判断正确的是()
A.试剂X为稀硫酸
B.结合质子( H+)的能力由强到弱的顺序是:AlO2—>OH—>CO32—
C.反应II中生成Al(OH)3的反应为:CO2+AlO2— +2H2O =Al(OH)3↓+HCO3—
D.Al2O3熔点很高,工业上还可采用电解熔融AlCl3冶炼Al
10、现代工业常以氯化钠、二氧化碳和氨气为原料制备纯碱,部分工艺流程如下:
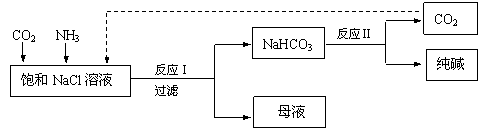
有关说法错误的是()
A.反应Ⅰ原理为CO2+ NH3 + NaCl + H2O=NaHCO3↓ + NH4Cl
B.向饱和NaCl溶液中先通入足量的CO2,再通入足量的NH3
C.反应Ⅰ生成的沉淀,经过过滤、洗涤、煅烧可得到纯碱
D.CO2的结构式为O=C=O,其中碳氧原子均满足8电子稳定结构
11、一定温度下,mg下列物质在足量的氧气中充分燃烧后,产物与足量的过氧化钠完全反应,过氧化钠增质量加了ng,且n>m,符合此要求的物质是()
①H2②CO③CO和H2的混合物④HCOOH⑤CH3CHO
A.①②③B.⑤C.④D.①②③④
12、将一定质量的镁和铝混合物投入200 mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如右图所示。则下列说法不正确的是
A.镁和铝的总质量为9 g
B.最初20 mLNaOH溶液用于中和过量的硫酸
C.硫酸的物质的量浓度为2.5 mol·L-1
D.生成的氢气在标准状况下的体积为11.2 L
 13、实验室一瓶固体M的标签右半部分已被腐蚀,剩余部分
13、实验室一瓶固体M的标签右半部分已被腐蚀,剩余部分
只看到“Na2S”字样(如图所示)。已知固体M只可能是Na2SO3、Na2SiO3、Na2SO4中的一种。若取少量固体M配成稀溶液进行有关实验,下列说法不正确的是( )
A.只用一种试剂就可以确定该固体M的具体成分
B.往溶液中通入二氧化碳,若有白色沉淀,则固体M为Na2SiO3
C.往溶液中加入稀硝酸酸化的BaCl2,若有白色沉淀,则固体M为Na2SO4
D.用pH试纸检验,若pH=7,则固体M一定是Na2SO4
14、某溶液可能含有Cl—、SO42—、CO32—、NH4+、Fe3+、Al3+和K+。取该溶液100mL,加入过量NaOH溶液加热,得到0.02mol气体,同时产生红褐色沉淀;过滤洗涤、灼烧至恒重,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。由此可知原溶液中()
A.至少存在5种离子B. Cl-一定存在,且c(Cl—)≥0.4mol/L
C.SO42—、NH4+一定存在,Cl—可能不存在 D.CO32—、Al3+一定不存在,K+可能存在
15、新型镁铝合金(Mg17Al12)有储氢性能,它一定条件下完全吸氢的反应为:Mg17Al12+17H2=17MgH2+12Al,得到的混合物Y(17MgH2+12Al)能与酸反应释放出大量氢气。下列说法正确的是( )
A.该合金应在氮气保护下,将一定比例的Mg、Al单质熔炼而成
B.该合金中含有离子键,铝元素呈正价
C.1mol Mg17Al12完全吸氢后得到的Y与盐酸完全反应放出H2在标准状况下的体积为1164.8L
D.合金的熔点高于金属镁、金属铝的熔点
16、能正确表示对应反应的离子方程式的是( )
A.向Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O=2SO32-+4Cl-+6H+
B.将磁性氧化铁溶于盐酸:Fe3O4+8H+=Fe3++2Fe2++4H2O
C.将氯化亚铁溶液和稀硝酸混合:Fe2++4H++NO=Fe3++2H2O+NO↑
D.铜溶于稀硝酸:3Cu+8H++2NO3—=3Cu2++2NO↑+4H2O
二、非选择题(共52分)
17、(12分)左图是某同学在实验室中进行铝热反应(铝过量)的实验装置,实验中可观察到的现象之一为“纸漏斗的下部被烧穿,有熔融物落入沙中”。
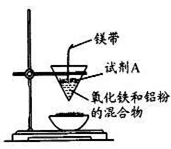
(1)试剂A的名称是。
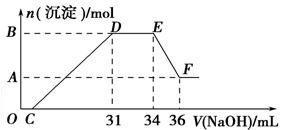
(2)探究铝热反应后固体的性质:将反应后容器中的残余固体置于烧杯中,加入100mL稀硝酸,固体完全溶解,(假设固体全部溶解后溶液体积不变),反应过程中无气体放出(活泼金属可把稀HNO3还原为NH4NO3)。向反应后的溶液中缓慢滴加4 mol·L-1的NaOH溶液,产生沉淀的物质的量与加入NaOH溶液的体积的关系如上右图所示:
①写出DE段发生反应的离子方程式:____________________________________
②求c(HNO3)=__________。③B与A的差值为_____________________
(3)若铝和氧化铁能恰好完全反应。则该铝热剂与盐酸反应时转移电子与所耗H+的物质的量之比为
18、(12分)A、B、C、D、E、F、G七种物质间存在如图所示的转化关系,其中A、B、D、G含有同种元素。
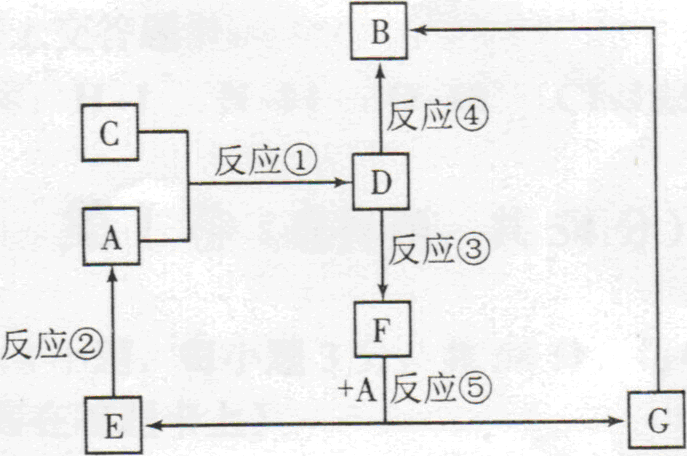
已知:A为金属单质,B为红褐色固体,E为密度最小的气体,G为浅绿色的溶液。
D的水溶液为黄色溶液,能与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀。
在水溶液中D能将某氧化物氧化为F,F是含有三种元素的化合物。请回答下列问题:
(1)构成C物质的元素在周期表中的位置是,在短周期主族元素中,该元素与其相邻元素的原子半径从大到小的顺序是(用元素符号表示)。
(2)D的水溶液呈性,请用离子方程式解释原因:。
(3)上述反应中属于置换反应的是(填序号)。
(4)反应③(即D将某种氧化物氧化为F)的离子方程式:
(5)气体C通入KI溶液中,氧化产物为KIO3,则氧化剂与还原剂物质的量之比为
19、(12分)有一无色溶液可能含Fe3+、Al3+、Fe2+、Mg2+、Cu2+、NH4+、K+、CO32—、SO42—等离子的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如图所示:
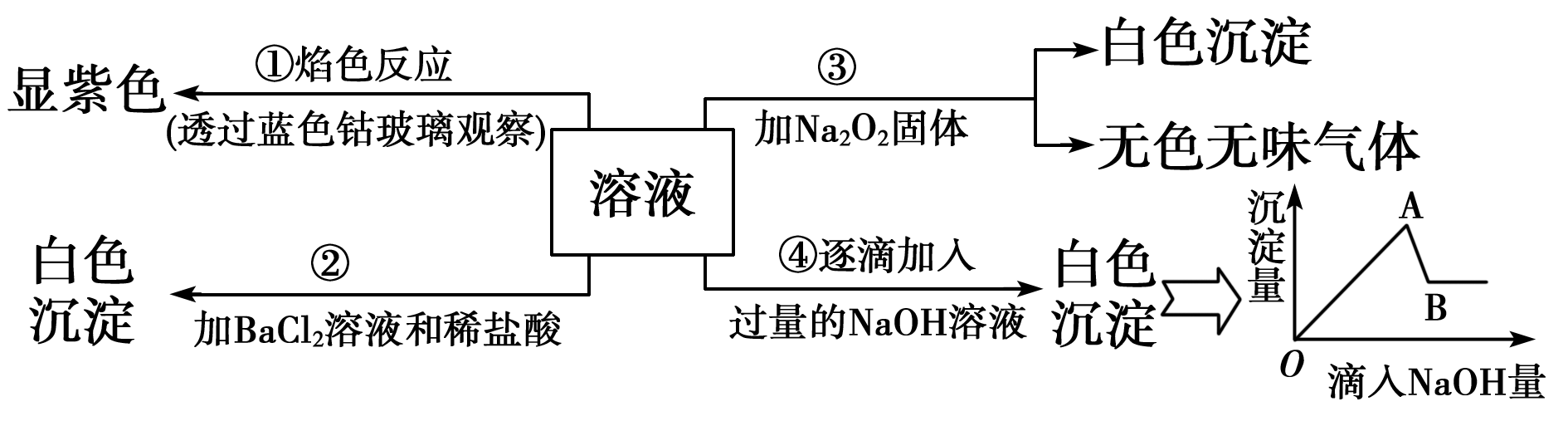
请你根据上图推断:
(1)原溶液中一定存在的离子有(写化学式):___________实验④最终产生的沉淀:_______________
(2)写出由A→B过程中所发生反应的离子方程式:_____________________。
(3)过氧化钠与水反应的化学方程式为:___________________
(4)实验②中加入稀盐酸的目的是________________。
20、(16分)硫酸亚铁铵又称莫尔盐,是浅绿色晶体。它在空气中比一般亚铁盐稳定,是常用的Fe2+试剂。某实验小组利用工业废铁屑制取莫尔盐,并测定其组成,他们进行了以下实验。
Ⅰ.莫尔盐的制取,请回答下列问题。

(1)废铁屑中含氧化铁,无需在制备前除去,理由是___________________、________________(用离子方程式回答),实验前都需将废铁屑放入碳酸钠溶液中煮沸,倾倒出液体,用水洗净铁屑。从以下仪器中选择组装,完成该操作必需的仪器有___________________(填编号)。
①铁架台②玻璃棒③广口瓶④石棉网⑤烧杯⑥漏斗⑦酒精灯
(2)步骤2中加热方式(填“直接加热”﹑“水浴加热”或“沙浴”);必须在铁屑少量剩余时,进行热过滤,其原因是
II.莫尔盐组成的测定
①将摩尔盐低温烘干后,称取7.84 g加热至100℃失去结晶水,质量变为5.68 g。
②选择下图所示的部分装置连接起来,检查气密性后,将上述5.68g固体放入A装置的锥形瓶中,再向锥形瓶中加入足量NaOH浓溶液,充分吸收产生的气体并测出气体质量为0.68 g。
③向A中加入适量3%的H2O2 溶液,充分振荡后滤出沉淀,洗净、干燥、灼烧后,测得其质量为1.6 g。
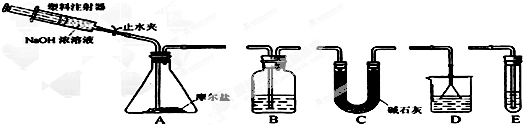
根据上述实验回答下列问题。
(3)步骤②中,选择的装置是A接_______接_______(填代号),A装置中未使用分液漏斗的理由是_______________________________。
(4)根据上述实验数据计算,摩尔盐中n(NH4+):n(Fe2+):n(SO):n(H2O)=___________
余江一中2016届高三第二次模拟考试化学参考答案
一、选择题(每小题只有一个正确答案,每小题3分,共48分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| D | D | C | A | D | C | B | D | C | B |
| 11 | 12 | 13 | 14 | 15 | 16 | ||||
| B | D | C | B | C | D |
二、非选择题(共52分)
17、(12分)(1)氯酸钾(2分)
(2)①NH4+ + OH—=NH3·H2O(2分)②1.48mol/L(3分)③0.008mol(3分)
(3)1:2 (2分)
18、(12分)(1)第三周期 第Ⅶ A族 ; S > Cl >F各2分
(2)酸 Fe3++3H2O⇋Fe(OH)3+3H+各1分共2分
(3)②⑤2分(答对1个给1分,见错就不得分)
(4)2Fe3++SO2+2H2O=2Fe2++SO42-+4H+…… 2分
(5)3:12分
19、(12分,每空2分)(1)K+、SO42—、Al3+、Mg2+
(2)Mg(OH)2 Al(OH)3+OH-= AlO2—+2H2O
(3)2Na2O2+2H2O =4NaOH+O2↑
(4)确定白色沉淀不是碳酸钡沉淀,而是硫酸钡沉淀。
20、(16分)(1)Fe2O3 + 6H+ = 2Fe3+ + 3H2O、2Fe3+ + Fe = 3Fe2+(4分)①②④⑤⑦ (2分 )
(2)水浴加热(2分 )防止Fe2+被氧化,同时热过滤可防止硫酸亚铁以晶体形式析出(2分)
(3)C D(2分)NaOH溶液对分液漏斗活塞、旋塞的磨口腐蚀性强(或分液漏斗活塞、旋塞处会被NaOH溶液腐蚀导致粘结)(2分 ) (4)2∶1∶2∶6 (2分)