
湖南省醴陵二中、醴陵四中2016-2017学年高二下学期期中联考化学试卷
03月05日
仙桃中学2013级高三8月考
化学试卷
可能用到的相对原子质量:H 1 O 16 Na 23 N 14 Al 27 Mg 24 Si 28 Cu 64 S 32
1.下列说法正确的是
A.金属钠着火,立即用泡沫灭火器灭火
B.酒精灯不慎着火,应立即吹熄
C.易燃试剂与强氧化性试剂分开放置并远离火源
D.氢氟酸或浓硝酸存放在带橡胶塞的棕色玻璃瓶中
2.下列过程没有发生化学反应的是
A.用活性炭去除冰箱中的异味
B.用热碱水清除炊具上残留的油污
C.用浸泡过高锰酸钾溶液的硅藻土保鲜水果
D.用含硅胶、铁粉的透气小袋与食品一起密封包装
3.下列有关物质分类或归类中,正确的是
①混合物:盐酸、漂白粉、氯水、水银 ②化合物:CaCl2、NaOH、HCl、HD ③电解质:明矾、生石膏、冰醋酸、氯化银 ④同素异形体:C60、C70、金刚石、石墨
A.①③B.②③C.③④D.④
4.同温同压下,xg的甲气体和yg的乙气体占有相同的体积,根据阿伏加德罗定律判断,下列叙述错误的是
A.x∶y等于甲与乙的相对分子质量之比
B.x∶y等于等质量的甲与乙的分子个数之比
C.x∶y等于同温同压下甲与乙的密度之比
D.y∶x等于同温同体积下等质量的甲与乙的压强之比
5.下列除杂方法正确的是
①除去乙烷中少量的乙烯:通入H2,加催化剂反应
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液
③除去NaBr溶液中的NaI:用氯水氧化NaI,再用CCl4萃取分液
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏
⑤只含有泥沙的粗盐:可通过溶解、过滤、蒸发、结晶的方法提纯
A.①②③B.②④⑤C.③④⑤D.②③④
6.下列说法中不正确的是
①由同一种元素组成的物质是单质 ②阴离子不含金属元素,阳离子含金属元素 ③金属氧化物一定是碱性氧化物 ④碱性氧化物一定是金属氧化物 ⑤非金属氧化物一定是酸性氧化物 ⑥酸性氧化物一定是非金属氧化物 ⑦酸酐一定是氧化物 ⑧酸的元数不一定等于酸中的H原子数 ⑨无氧酸不一定是非金属的氢化物
A.①②④⑤⑦⑧ B.①③⑤⑧⑨C.①②③⑤⑥⑦D.③⑤⑦⑧⑨
7.茶叶中铁元素的检验可经以下四个步骤完成,各步骤中选用的实验用品不能都用到的是
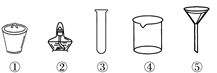
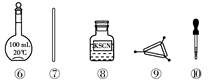
A.将茶叶灼烧灰化,选用①、②和⑨
B.用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦
C.过滤得到滤液,选用④、⑤和⑦
D.检验滤液中的Fe3+,选用③、⑧和⑩
8.设NA为阿伏加德罗常数的值,下列叙述正确的是
A.1.0 L 1.0 mol·L-1的NaAlO2水溶液中含有的氧原子数为2NA
B.25 ℃时pH=13的NaOH溶液中含有OH-的数目为0.1NA
C.常温常压下,92 g NO2和N2O4的混合气体中含有的原子总数为6NA
D.标准状况下,22.4 L氨水含有NA个NH3分子
9.按以下实验方案可以从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物。
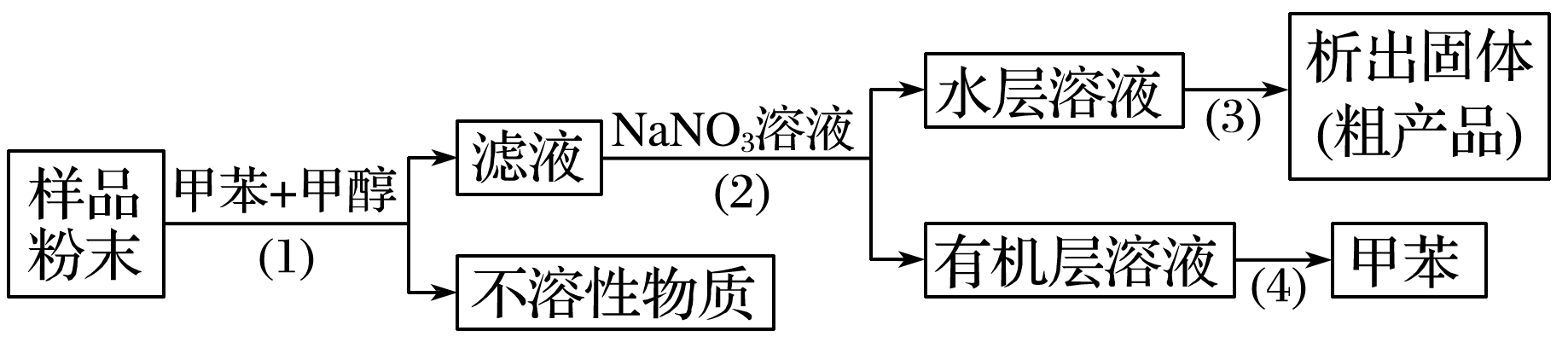
下列说法错误的是
A.步骤(1)需要过滤装置B.步骤(2)需要用到分液漏斗
C.步骤(3)需要用到坩埚D.步骤(4)需要蒸馏装置
10.下列有关溶液组成的描述合理的是
A.无色溶液中可能大量存在Al3+、NH4+、Cl-、S2-
B.弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3-
C.酸性溶液中可能大量存在Na+、ClO-、SO42-、I-
D.中性溶液中可能大量存在Fe3+、K+、Cl-、SO42-
11.在一定温度下,某饱和氢氧化钠溶液体积为VmL,溶液密度为dg·cm-3,质量分数为w,物质的量浓度为cmol·L-1,溶液中含氢氧化钠的质量为mg,该温度下NaOH的溶解度为S。则下列关系中不正确的是
A.S = B.w = %C.S = D.![]()
12.把500 mL含有BaCl2和KCl的混合溶液分成5等份,取一份加入含amol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含bmol硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为
A.10(b-2a) mol·L-1B.10(2a-b) mol·L-1
C.10(b-a) mol·L-1D.0.1(b-2a) mol·L-1
13.下列指定反应的离子方程式正确的是
A.Fe和稀硝酸反应 Fe+2H+===Fe2++H2↑
B.将Fe(NO3)3溶液与少量HI混合:8H++2NO+6I-===4H2O+3I2+2NO↑
C.用过量氨水吸收SO2的反应:NH3·H2O+SO2===NH+HSO
D.少量Ca(OH)2和NaHCO3反应 Ca2++OH-+HCO===CaCO3↓+H2O
14.宋代著名法医学家宋慈的《洗冤集录》中有银针验毒的记载,“银针验毒”涉及的化学反应是 4Ag+2H2S+O2→2X+2H2O,下列说法正确的是
A.X的化学式为AgSB.银针验毒时,空气中氧气失去电子
C.反应中Ag和H2S均是还原剂D.每生成1mo1X,反应转移2mo1电子
15.雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH、Mg2+、Al3+、SO、NO、Cl-。某同学收集了该地区的雾霾,经必要的预处理后得试样溶液,设计并完成了如下实验:
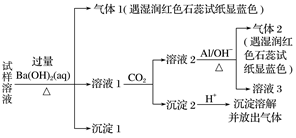
已知:3NO+ 8Al+5OH-+2H2O3NH3↑+8AlO
根据以上的实验操作与现象,该同学得出的结论正确的是
A.试样中肯定存在NH、Mg2+、SO和NO
B.试样中一定不含Al3+
C.试样与Na2CO3溶液一定不能大量共存
D.该雾霾中可能存在NaNO3、NH4Cl和MgSO4
16.在铜的冶炼过程中有如下反应发生5FeS2+14CuSO4+12H2O===7Cu2S+5FeSO4+12H2SO4关于此反应,下列说法正确的是
A.Cu2S既是氧化产物,又是还原产物B.产物中的SO有一部分是氧化产物
C.FeS2只作还原剂D.5 mol FeS2发生反应,有10 mol电子转移
17.向FeI2和FeBr2物质的量之比为1∶1的混合溶液中逐滴滴入氯水,下列离子反应不可能发生的是
A.2Fe2++4I-+3Cl2===2Fe3++2I2+6Cl-
B.2Fe2++2I-+2Cl2===2Fe3++I2+4Cl-
C.2Fe2++2I-+2Br-+3Cl2===2Fe3++I2+Br2+6Cl-
D.2Fe2++4I-+4Br-+5Cl2===2Fe3++2I2+2Br2+10Cl-
18.1.52 g铜镁合金完全溶解于50 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是
A.得到2.54 g沉淀时,加入NaOH溶液的体积是700 mL
B.该合金中铜与镁的物质的量之比是2:1
C.该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
D.NO2和N2O4的混合气体中,NO2的体积分数是80%
19. 已知:将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3,且的值与温度高低有关。当n(KOH)=amol时,下列有关说法错误的是
A.若某温度下,反应后=11,则溶液中=
B.参加反应的氯气的物质的量等于amol
C.改变温度,产物中KClO3的最大理论产量为amol
D.改变温度,反应中转移电子的物质的量ne的范围:amol≤ne≤amol
20.下列离子方程式正确的是
A.向FeSO4溶液中加入少量Na2O2:4Na2O2+6H2O+4Fe2+===4Fe(OH)3↓+8Na++O2↑
B.向明矾溶液中逐滴加入Ba(OH)2溶液至沉淀的质量最大:2Al3++3SO+3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓
C.向NaClO溶液中通入少量SO2: 2ClO-+SO2+H2O===2HClO+SO
D.将0.2 mol/L的NH4Al(SO4)2溶液与0.4 mol/L的Ba(OH)2溶液等体积混合:NH+Al3++2SO+2Ba2++4OH-===Al(OH)3↓+2BaSO4↓+NH3·H2O
21.已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
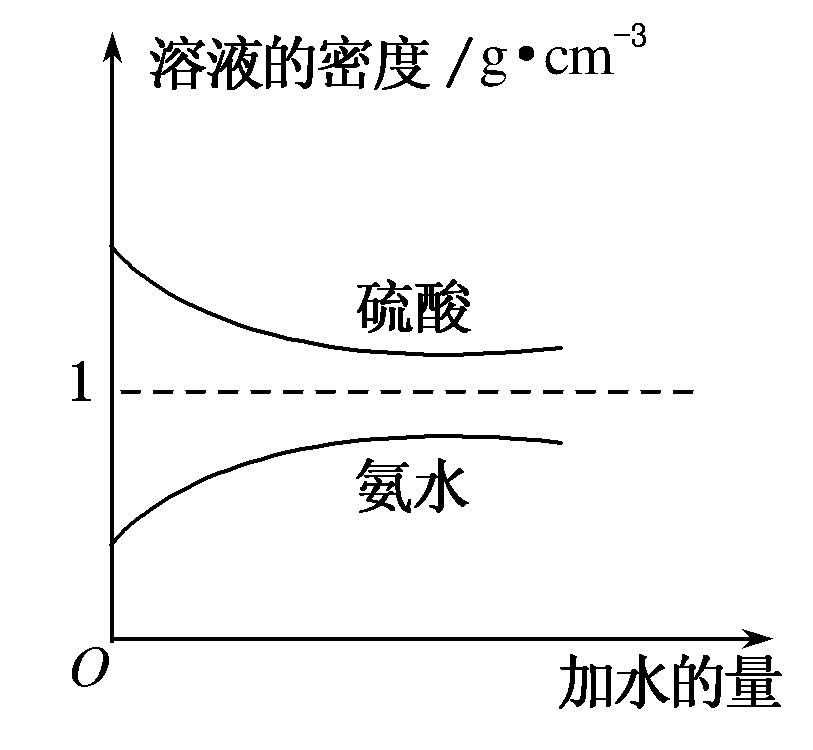
| 溶质的物质的量浓度/mol·L-1 | 溶液的密度/g·cm-3 | |
| 硫酸 | c1 | ρ1 |
| 氨水 | c2 | ρ2 |
22.某中学有甲、乙两个探究性学习小组,他们拟用小颗粒状铝硅合金与足量稀硫酸的反应测定通常状况(约20 ℃,1 atm)下气体摩尔体积。
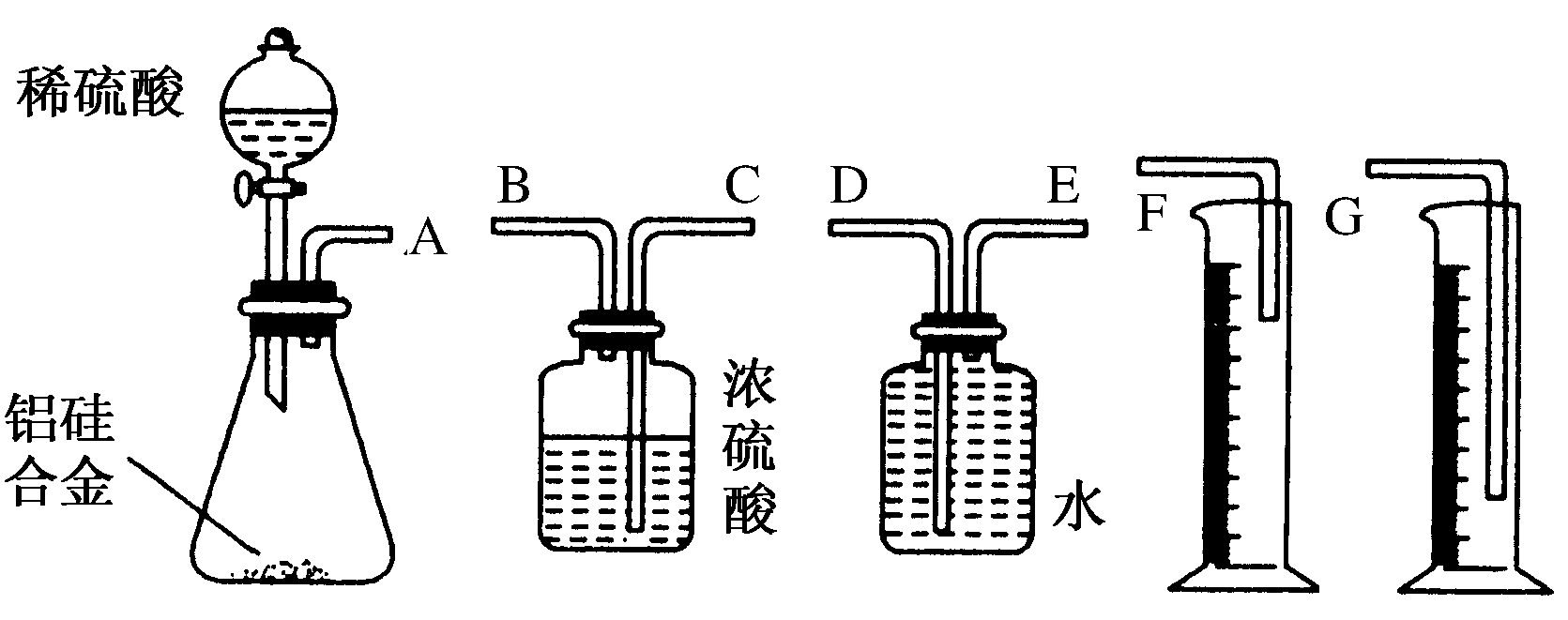 甲组同学拟选用下列实验装置完成实验:
甲组同学拟选用下列实验装置完成实验: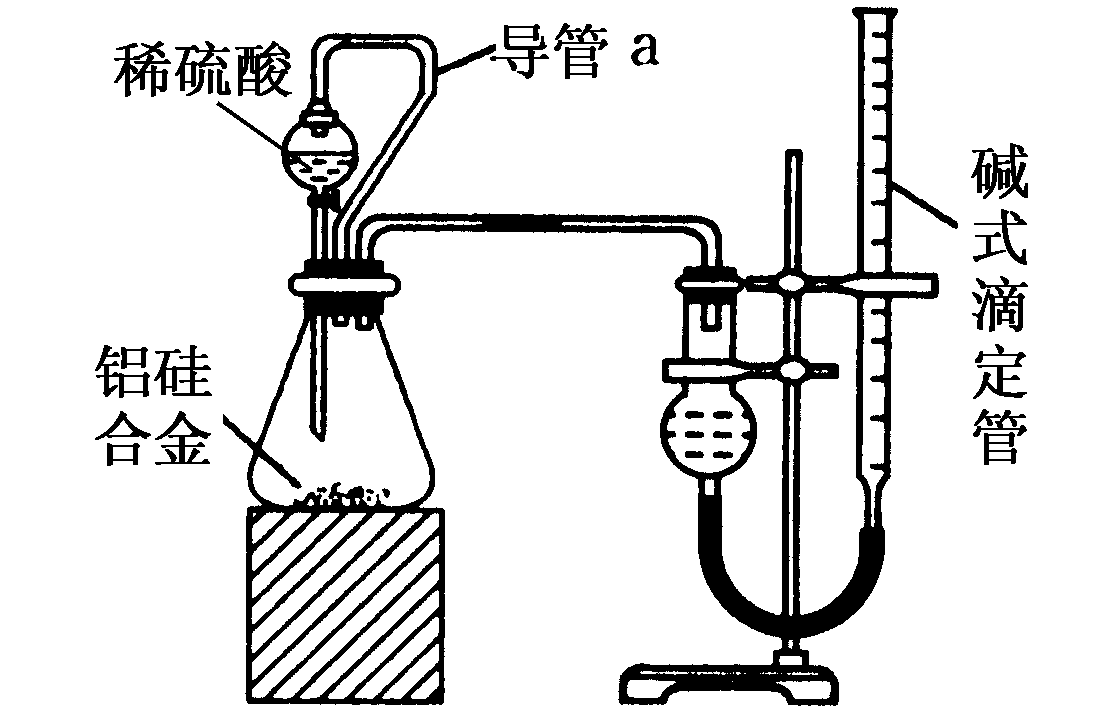
①装置中导管a的作用是:________________________________________________________________
_________________________错误!链接无效。_错误!链接无效。_错误!链接无效。_错误!链接无效。_错误!链接无效。_错误!链接无效。;
②实验中准确测得4个数据:实验前铝硅合金的质量为m1g,实验后残留固体的质量为m2g,实验前后碱式滴定管中液面读数分别为V1mL、V2mL。则通常状况下气体摩尔体积Vm=________。
23.用霞石岩(主要成分为Na2O、K2O、Al2O3、SiO2)制碳酸钠、碳酸钾和氧化铝的工艺流程如下:已知:NaHCO3溶液的pH约为8~9,Na2CO3溶液的pH约为11~12。
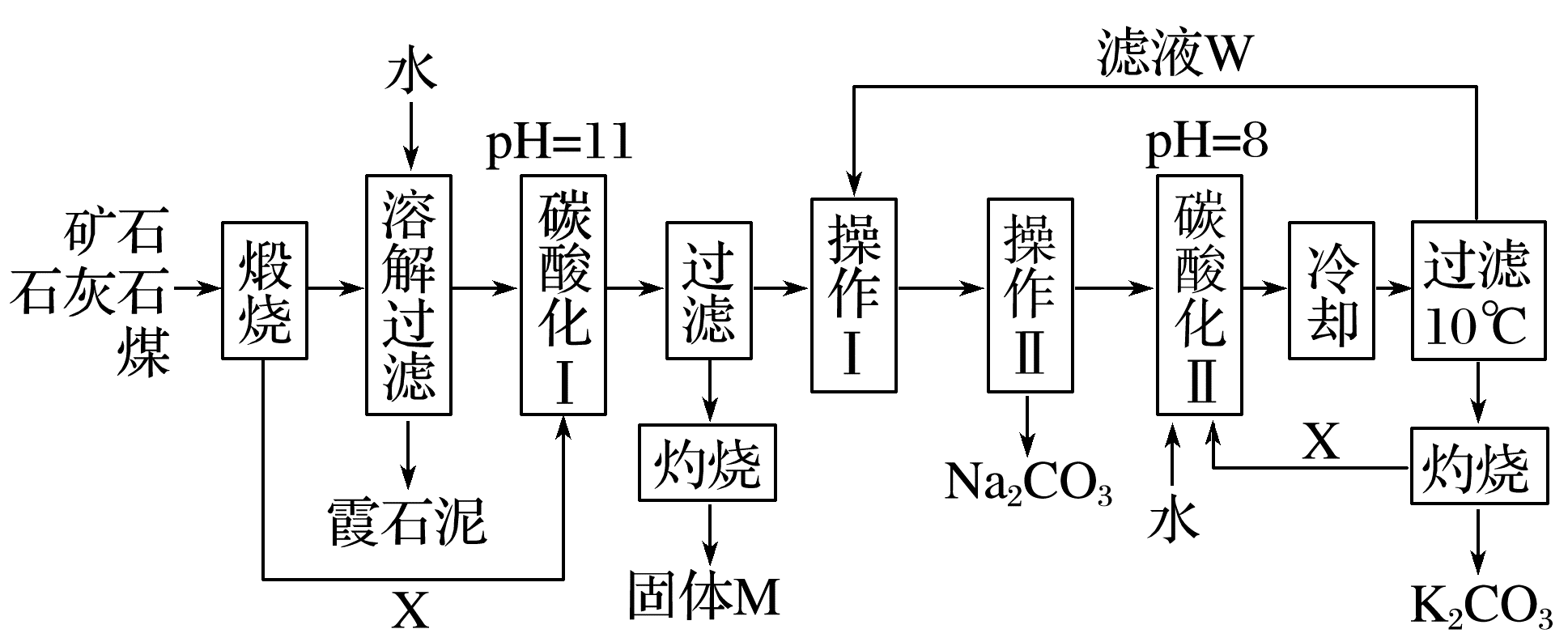
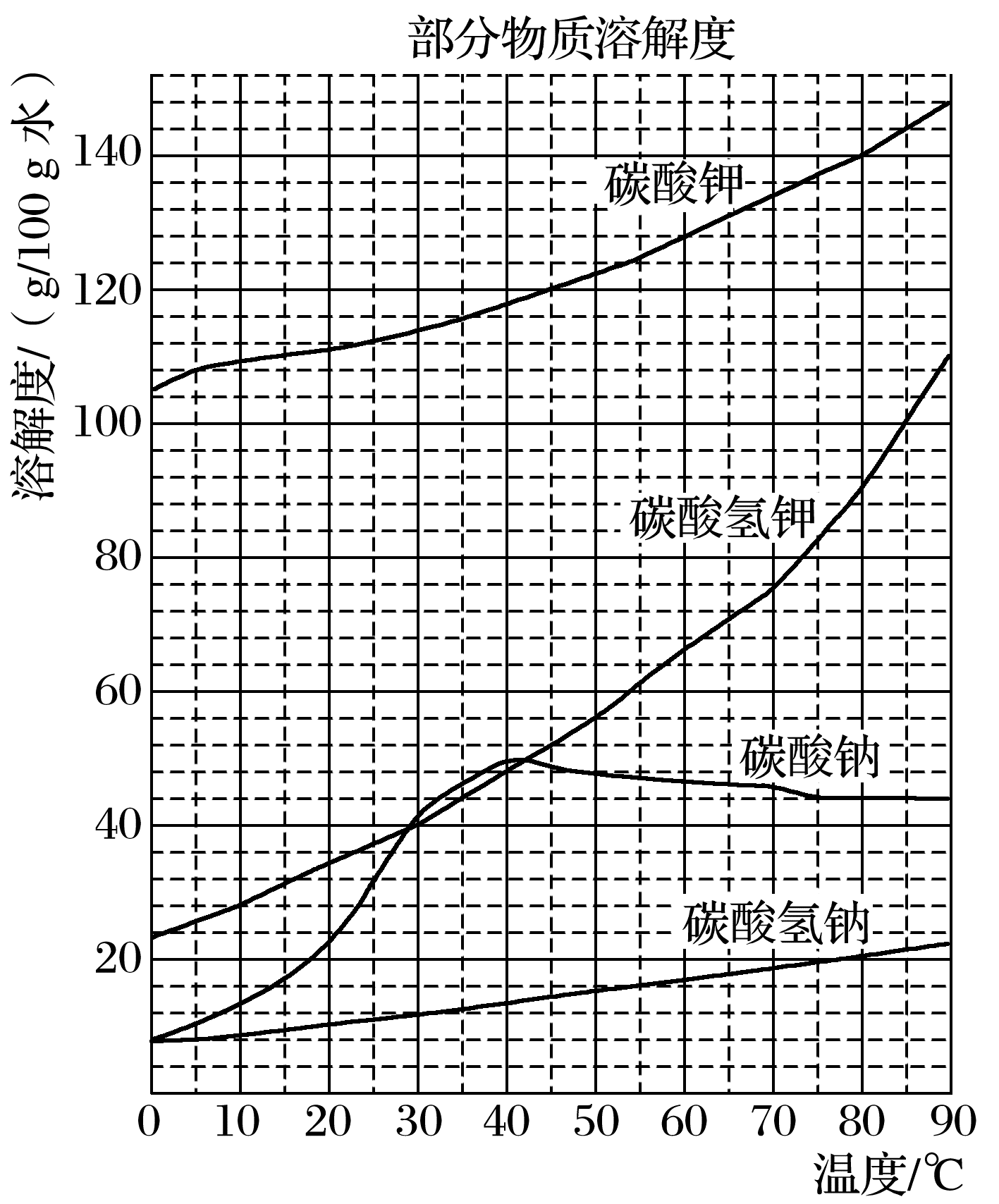
溶解过滤工序产生的滤液中含钠、钾和铝的可溶性盐类,钙和硅等其他杂质在滤渣霞石泥中。部分物质的溶解度如上图,根据题意回答下列问题:
(1)固体M的化学式是________,X物质是________。
(2)实验室进行煅烧操作时盛放固体物质的实验仪器是________,滤液W中主要含有的离子有________。
(3)碳酸化Ⅰ中发生主要反应的离子方程式是__________________。
(4)操作Ⅰ是________(填写名称),操作Ⅱ是________(选填编号)。
a.趁热过滤 b.冷却过滤 c.蒸馏 d.灼烧
(5)碳酸化Ⅱ调整pH=8的目的是_________________________________________,
产品K2CO3中最可能含有的杂质是__________(写化学式)。
24.高纯度锰酸锂(LiMn2O4)是锂电池重要的正极材料。
把分析纯碳酸锂与球形二氧化锰两种粉末,按物质的量1:4混合均匀加热。
①升温到515 ℃时,开始有CO2产生,同时生成固体A,比预计碳酸锂的分解温度(723 ℃)低得多。原因是__________________________________。
②升温到566 ℃时,产生另一种气体X,X恰好与CO2物质的量相等,同时得到固体B。请写出发生的化学反应方程式:______________________________________________________。
③升温到720 ℃时,A、B反应,固体质量逐渐增加,当质量不再增加时,得到高纯度的锰酸锂。请写出发生的化学反应方程式:______________________________________________________。
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| C | A | C | B | B | C | B | C | C | B |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| D | A | B | D | D | B | D | A | C | D |
(5)碳酸根转化为碳酸氢根离子,利于KHCO3结晶析出 Na2CO3
24.(10分)
②4LiOH+8MnO24LiMn2O4+2H2O↑+O2↑
(2)①二氧化锰是催化剂,加快了碳酸锂分解
②4MnO22Mn2O3+O2↑
③2Li2O+4Mn2O3+O24LiMn2O4