
湖南省醴陵二中、醴陵四中2016-2017学年高二下学期期中联考化学试卷
03月05日
海口中学2016届高三第二次模拟考试
化学试题(打印450份)
总分:100分 时间:90分钟 日期:2016-3-10
可能用到的相对原子质量: H 1 C 12 O 16 Na 23 S 32 Cl 35.5
第Ⅰ卷 选择题(共36分)
一、选择题:(本题共6小题。每小题2分,共12分。在每小题给出的四个选项中,只有一项是符合题目要求的)
1.化学与社会、生产、生活紧切相关。下列说法正确的是
A.石英只能用于生产光导纤维
B.从海水中提取物质都必须通过化学反应才能实现
C.为了增加食物的营养成分,可以大量使用食品添加剂
D.“地沟油”禁止食用,但可以用来制肥皂
2.下列有关物质的性质与应用不相对应的是
A.明矾能水解生成Al(OH)3胶体,可用作净水剂
B.FeCl3溶液能与Cu反应,可用于蚀刻印刷电路
C.SO2具有氧化性,可用于漂白纸浆
D.Zn具有还原性和导电性,可用作锌锰干电池的负极材料
3、25 ℃时,下列各组离子在指定溶液中一定能大量共存的是
A.pH=1的溶液中:Na+、K+、MnO、CO
B.c(H+)=1×10-13mol·L-1的溶液中:Mg2+、Cu2+、SO、NO
C.0.1 mol·L-1NH4HCO3溶液中:K+、Na+、NO、Cl-
D.0.1 mol·L-1FeCl3溶液中:Fe2+、NH、SCN-、SO
![]() 4.甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系: 。下列有关物质的推断不正确的是
4.甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系: 。下列有关物质的推断不正确的是
A.若甲为Fe,则丁可能是盐酸
B.若甲为SO2,则丁可能是氨水
C.若甲为焦炭,则丁可能是O2
D.若甲为NaOH 溶液,则丁可能是CO2
5.运用有关概念判断下列叙述正确的是
A.1 mol H2燃烧放出的热量为H2的燃烧热
![]() B.Na2SO3与H2O2的反应为氧化还原反应
B.Na2SO3与H2O2的反应为氧化还原反应
C. 互为同系物
D.BaSO4的水溶液不易导电,故BaSO4是弱电解质
6.短周期元素W、X、Y、Z的原子序数依次增大,其简单离子都能破坏水的电离平衡的是
A.W2-、X+ B.X+、Y3+C.Y3+、 Z2-D.X+、Z2-
二、选择题:(本题共6小题。每小题4分,共24分。每小题有一个或两个选项符合题意,若正确答案只包括一个选项,多选得0分;若正确答案包括两个选项,只选一个且正确得2分,选两个且都正确得4分,但只要选错一个就得0分)
7.亚氨基锂(Li2NH)是一种储氢容量高、安全性好的固体储氢材料,其储氢原理可表示为:Li2NH+H2===LiNH2+LiH,下列有关说法正确的是
A.Li2NH中N的化合价是-1
B.该反应中H2既是氧化剂又是还原剂
C.H-的离子半径比Li+大
D.此法储氢和钢瓶储氢的原理相同
8.下列说法正确的是
A.0.5 mol O3与11.2 L O2所含的分子数一定相等
B.25 °C与60 °C时,水的pH相等
C.中和等体积、等物质的量浓度的盐酸和醋酸所消耗的n(NaOH)相等
D.2SO2(g)+O2(g)===2SO3(g)和4SO2(g)+2O2(g)===4SO3(g)的ΔH之比为1/2
9.在通风橱中进行下列实验:
| 步骤 | |||
| 现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
下列说法中不正确的是:
A.Ⅰ 中气体由无色变红棕色的化学方程式为:2NO+O2=2NO2
B.Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C.对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
D.针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化
10.a.b.c.d为短周期元素,a的M电子层有1个电子,b的最外层电子数为内层电子数的2倍,c的最高化合价为最低化合价绝对值的3倍,c与d同周期,d的原子半径小于c。下列叙述错误的是
A. 它们均存在两种或两种以上的氧化物
B.只有a与其他元素生成的化合物都是离子化合物
C.b.c.d与氢形成的化合物中化学键均为极性共价键
D.d元素的非金属性最强
11、雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH、Mg2+、Al3+、SO、NO、Cl-。某同学收集了该地区的雾霾,经必要的预处理后得试样溶液,设计并完成了如下实验:
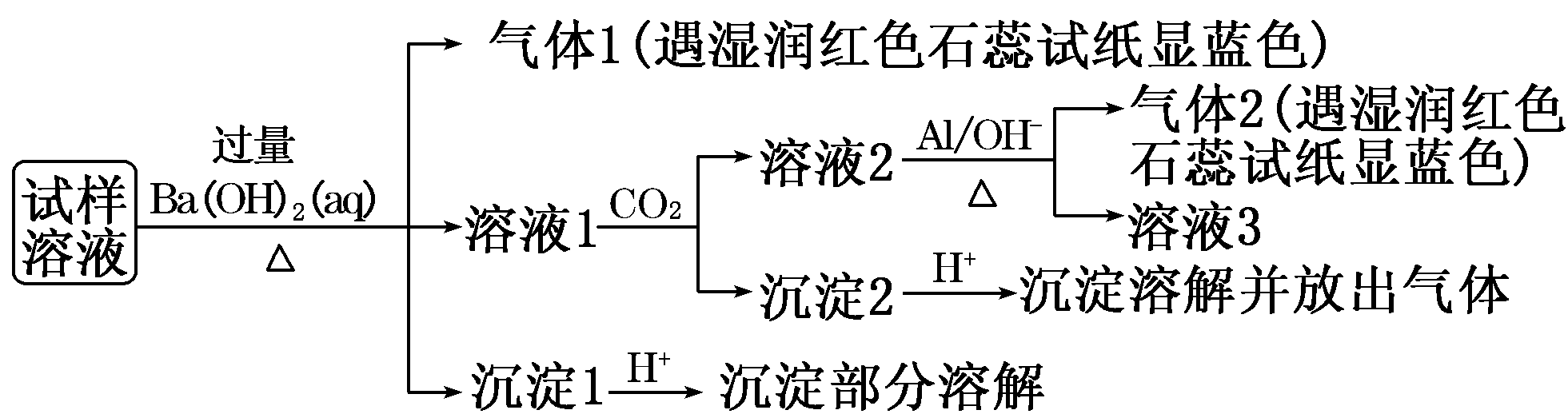
已知:3NO+8Al + 5OH-+2H2O△,3NH3↑+8AlO
根据以上的实验操作与现象,该同学得出的结论不正确的是
A.试样中肯定存在NH、Mg2+、SO和NO
B.试样中一定不含Al3+
C.试样中一定存在Na+、Cl-
D.该雾霾中可能存在NaNO3、NH4Cl和MgSO4
12. 25℃时,水溶液中c(H+)与c(OH-)的变化关系如图中曲线a c所示,下列判断错误的是
A.a c曲线上的任意一点都有c(H+)c(OH-)=10-14
B.b d线段上任意一点对应的溶液都呈中性
C.d点对应溶液的温度高于25℃,pH<7
D.CH3COONa溶液不可能位于c点
第II卷非选择题(64分)
13.(5分)以乙烯为原料合成化合物C的流程如图所示:
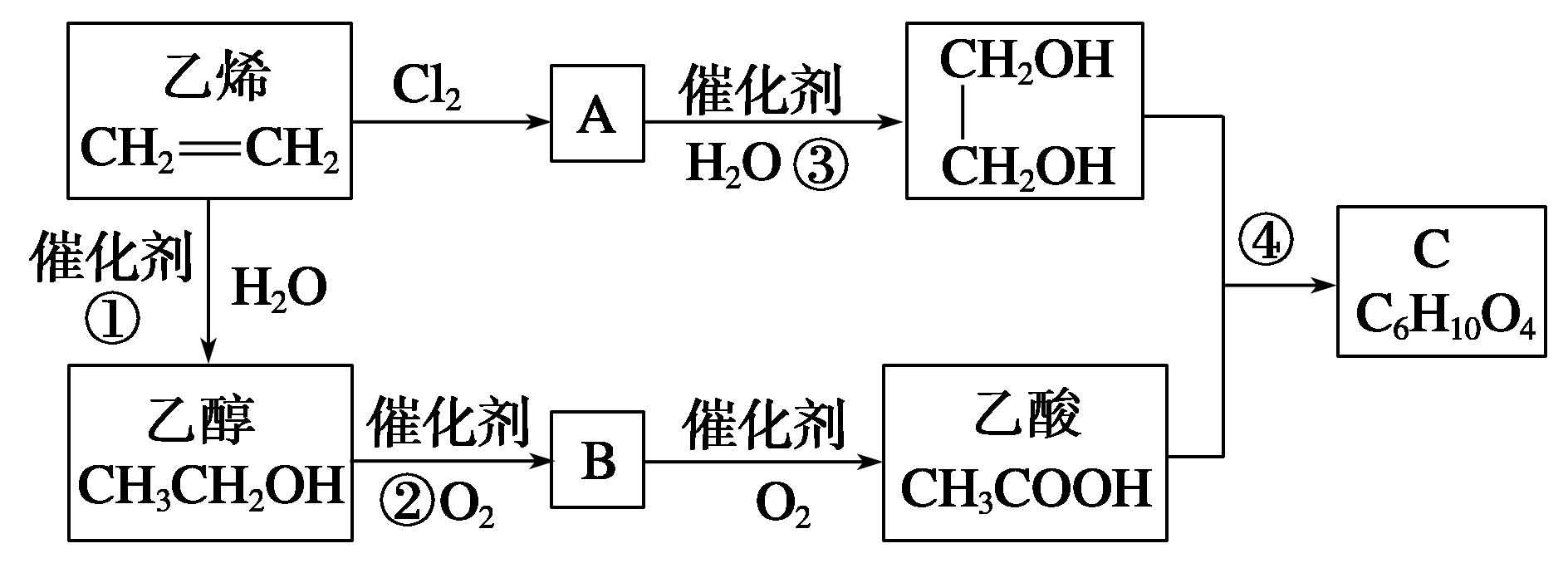
(1)C中官能团名称为 ,①的反应类型为 。
(2)写出A的同分异构体的结构简式: 。
(3)写出反应③的产物与足量金属钠反应的化学方程式: 。
(4)写出反应④的化学方程式: 。
14.(10分)元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。
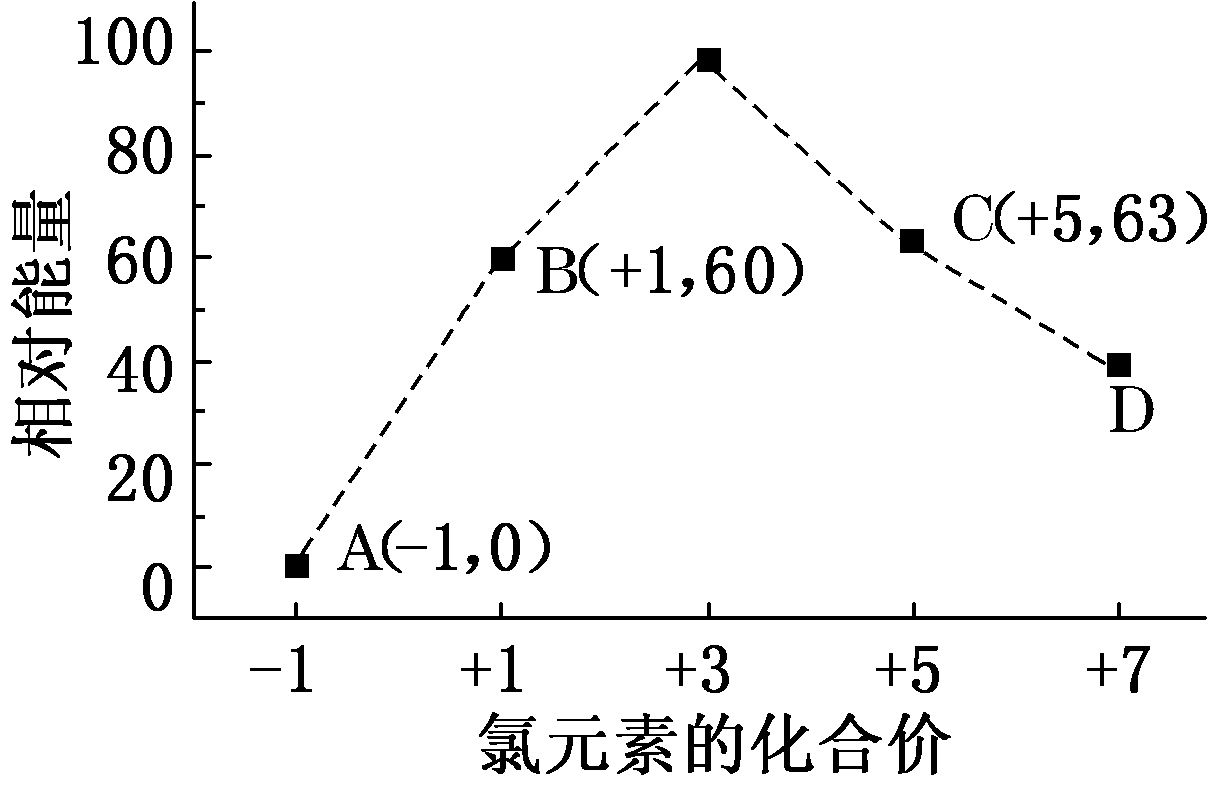
①D是________(填离子符号)。
②B―→A+C反应的热化学方程式为________________________(用离子符号表示)。
15.(7分)银是一种贵金属,古代常用于制造钱币及装饰器皿,现代在电池和照明器材等领域亦有广泛应用。回答下列问题。
(1)久存的银制器皿表面会变黑,失去银白色的光泽,原因是 。
(2)已知Ksp(AgCl)=1.8×10-10,若向5 mL 0.018 mol·L-1的AgNO3溶液中加入
5 mL 0.020 mol·L-1的盐酸,混合后溶液中的Ag+的浓度为 mol·L-1,pH为 。
(3)AgNO3溶液光照易分解,生成Ag和红棕色气体等物质,其光照分解的化学方程式为 。
16.(10分)某兴趣小组拟制备氯气并验证其一系列性质。
Ⅰ.【查阅资料】
①当溴水浓度较小时,溶液颜色与氯水相似也呈黄色。
②硫代硫酸钠溶液在工业上可作为脱氯剂 。
Ⅱ.【性质验证】
实验装置如图所示(省略夹持装置)
实验步骤:
(1)检查装置气密性,按图示加入试剂。仪器a的名称是 ;装置C中Ⅱ处加的试剂可以是 (选填下列字母编号)。
A.碱石灰 B.硅胶 C.浓硫酸 D.无水氯化钙
(2)装置B的作用有 。
(3)写出装置F中相应的离子反应方程式: 。
Ⅲ.【探究与反思】
(1)上图中设计装置D、E的目的是比较氯、溴、碘的非金属性,有同学认为该设计不能达到实验目的,其理由是 。该组的同学思考后将上述D、E、F装置改为实验操作步骤如下:
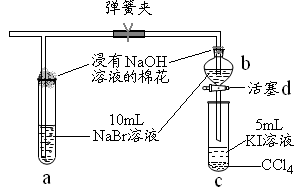 ①打开弹簧夹,缓缓通入氯气
①打开弹簧夹,缓缓通入氯气
②当a和b中的溶液都变为黄色时,夹紧弹簧夹。
③当a中溶液由黄色变为棕色时,停止通氯气。
④___。
(2)设计步骤③的实验思想是 。
(3)步骤④的操作是 。
17.(12分)磺酰氯(SO2Cl2)和亚硫酰氯(SOCl2)均是实验室常见试剂。
已知: SO2Cl2(g)![]() SO2(g) + Cl2(g) K1 △H=a kJ/mol (Ⅰ)
SO2(g) + Cl2(g) K1 △H=a kJ/mol (Ⅰ)
SO₂(g) +Cl₂(g)+ SCl₂(g)![]() 2SOCl₂(g) K2 △H=b kJ/mol (Ⅱ)
2SOCl₂(g) K2 △H=b kJ/mol (Ⅱ)
(1)反应:SO2Cl2(g)+ SCl₂(g) ![]() 2SOCl2(g)的平衡常数K = (用K1、K2表示),该反应△H= kJ/mol(用a、b表示)。
2SOCl2(g)的平衡常数K = (用K1、K2表示),该反应△H= kJ/mol(用a、b表示)。
(2)为研究不同条件对反应(Ⅰ)的影响,以13.5 g SO2Cl2充入2.0 L的烧瓶中,在101 kPa 375 K时,10 min达到平衡,平衡时SO2Cl2转化率为0.80,则0~10 min Cl2的平衡反应速率为,平衡时容器内压强为kPa,该温度的平衡常数为;若要减小SO2Cl2转化率,除改变温度外,还可采取的措施是(列举一种)。
(3)磺酰氯对眼和上呼吸道粘膜有强烈的刺激性,发生泄漏时,实验室可用足量NaOH固体吸收,发生反应的化学方程式为;亚硫酰氯溶于水的离子方程式为。
(4)一定量的Cl2用稀NaOH溶液吸收,若恰好反应,则溶液中各离子浓度由大到小的顺序为;已知常温时次氯酸的Ka=2.5×10-8则该温度下NaClO水解反应的平衡常数Kb= mol·L-1
选考题(请考生在第18、19、20三题中任选一题作答,如果多做,则按所做的第一题计分)
第18、19、20三题的第I题为选择题,在给出的四个选项中,只有两项是符合题目要求的;第II题为非选择题。
18.[选修5—有机化学基础]
18-Ⅰ.(6分)分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是
A.分子中含有2种官能团
B.可与乙醇、乙酸反应,且反应类型相同
C.1mol分枝酸最多可与2molNaOH发生中和反应
D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
18-Ⅱ(14分)有机物H是一种重要的医药中间体。其结构简式如图所示:
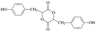
合成H的一种路线如下:
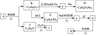
已知以下信息:
①有机物A遇氯化铁溶液发生显色反应,其分子中的苯环上有2个取代基,且A的苯环上一氯代物有2种。
②J能发生银镜反应。
请回答下列问题:
(1)I的名称是 。G生成H的反应类型是 。
(2)B的含氧官能团名称是 ;E生成F的化学方程式为 。
(3)在一定条件下,A与J以物质的量比1∶1反应生成功能高分子材料K,K的结构简式为 。
(4)已知:![]()
C与E以物质的量比1∶1混合在催化剂、加热条件下反应,写出化学方程式 。
(5)L是B的同分异构体,L符合下列条件的结构有 种(不考虑立体结构)。①与B具有相同的官能团;②遇氯化铁溶液发生显色反应。
19.[选修3—物质结构与性质]
19—Ⅰ(6分)下列物质的结构或性质与氢键无关的是
A.乙醚的沸点 B.乙醇在水中的溶解度
C.氢化镁的晶格能 D.DNA的双螺旋结构
19—Ⅱ(14分)钒(23V)是我国的丰产元素,广泛用于催化及钢铁工业。
回答下列问题:
(1)钒在元素周期表中的位置为 ,其价层电子排布图为 。
(2)钒的某种氧化物的晶胞结构如图1所示。晶胞中实际拥有的阴、阳离子个数分别为 、 。
(3)V2O5常用作SO2转化为SO3的催化剂。SO2 分子中S原子价层电子对数是 对,分子的立体构型为 ;SO3气态为单分子,该分子中S原子的杂化轨道类型为 ;SO3的三聚体环状结构如图2所示,该结构中S原子的杂化轨道类型为 ;该结构中S—O键长由两类,一类键长约140pm,另一类键长约为160pm,较短的键为 (填图2中字母),该分子中含有 个键。
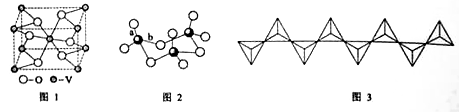
(4)V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4),该盐阴离子的立体构型为 ;也可以得到偏钒酸钠,其阴离子呈如图3所示的无限链状结构,则偏钒酸钠的化学式为 。
20.[选修2—化学与技术]
20—Ⅰ(6分)下列有关海水综合利用的说法正确的是
A.电解饱和食盐水可制得金属钠 B.海带提碘只涉及物理变化
C.海水提溴涉及到氧化还原反应 D.海水提镁涉及到复分解反应
20—Ⅱ(14分)
铁在自然界分别广泛,在工业、农业和国防科技中有重要应用。
回答下列问题:
(1)用铁矿石(赤铁矿)冶炼生铁的高炉如图(a)所示。原料中除铁矿石和焦炭外含有 。除去铁矿石中脉石(主要成分为SiO2 )的化学反应方程式为 ;高炉排出气体的主要成分有N2、CO2 和 (填化学式)。
(2)已知:①Fe2O3 (s)+3C(s)=2Fe(s)+3CO(g) ΔH=+494kJ·mol-1
②CO(g)+![]() O2(g)=CO2(g) ΔH=-283kJ·mol-1
O2(g)=CO2(g) ΔH=-283kJ·mol-1
③C(s)+![]() O2(g)=CO (g) ΔH=-110kJ·mol-1
O2(g)=CO (g) ΔH=-110kJ·mol-1
则反应Fe2O3 (s)+3 C(s)+ ![]() O2(g)=2Fe(s)+3CO2 (g) 的ΔH= kJ·mol-1。理论上反应 放出的热量足以供给反应 所需的热量(填上述方程式序号)
O2(g)=2Fe(s)+3CO2 (g) 的ΔH= kJ·mol-1。理论上反应 放出的热量足以供给反应 所需的热量(填上述方程式序号)
(3)有人设计出“二步熔融还原法”炼铁工艺,其流程如图(b)所示,其中,还原竖炉相当于高炉的 部分,主要反应的化学方程式为 ;熔融造气炉相当于高炉的 部分。
(4)铁矿石中常含有硫,使高炉气中混有SO2污染空气,脱SO2 的方法是 。