
湖南省醴陵二中、醴陵四中2016-2017学年高二下学期期中联考化学试卷
03月05日
衡阳八中2018届高三年级实验班第一次质检试卷
化学(试题卷)
注意事项:
1.本卷为衡阳八中高三实验班第一次质检试卷,分两卷。其中共19题,满分100分,考试时间为90分钟。
2.考生领取到试卷后,应检查试卷是否有缺页漏页,重影模糊等妨碍答题现象,如有请立即向监考老师通报。开考15分钟后,考生禁止入场,监考老师处理余卷。
3.请考生将答案填写在答题卡上,选择题部分请用2B铅笔填涂,非选择题部分请用黑色0.5mm签字笔书写。考试结束后,试题卷与答题卡一并交回。
第I卷 选择题(共48分)
本卷共16题,每题3分,共48分。在每题后面所给的四个选项中,只有一个是正确的。
1.下列物质中,属于酸性氧化物的是
2.下列条件下,两瓶气体所含原子数一定相等的是
C. 同体积、同密度的CH4和NH3 D. 同压强、同体积的O2和CO2
3.用NA表示阿伏伽德罗常数的值,下列叙述中正确的是
4.下列离子方程式正确的是
5.向含Fe2+、I-、Br-的溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知b-a=5,线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素。下列说法正确的是
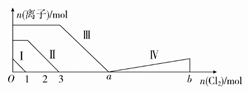
C. 根据图象无法计算a的值 D. 原溶液中n(FeI2)∶n(FeBr2)=3∶1
6.某干燥粉末可能由Na2O、Na2O2、Na2CO3、NaHCO3、NaCl中的一种或几种组成。将该粉末与足量的盐酸反应有气体X逸出,X通过足量的NaOH溶液后体积缩小(同温、同压下测定)。若将原来混合粉末在空气中用酒精灯加热,也有气体放出,且剩余固体的质量大于原混合粉末的质量。下列判断正确的是
①粉末中一定有Na2O、Na2O2、NaHCO3 ②粉末中一定不含有Na2CO3和NaCl
③粉末中一定不含有Na2O和NaCl ④无法肯定粉末中是否含有Na2CO3和NaCl
7.某溶液中可能存在Br-、CO、SO、Al3+、I-、Mg2+、Na+等7种离子中的某几种。现取该溶液进行实验,得到如下现象:
①向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;
②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。
已知:5Cl2+I2+6H2O===10HCl+2HIO3
据此可以判断:该溶液肯定不存在的离子组是
C. Al3+、SO、I- D. Al3+、Br-、SO
8.用如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是
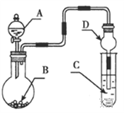
9.短周期主族元素X、Y、Z、W原子序数依次增大,X的某种单质是一种粮仓中常用的粮食保护气,Y和Z原子的最外层电子数之和等于W原子的最外层电子数,Z原子核外电子数是W原子最外层电子数的2倍。下列说法正确的是( )
10.将1 mol A(g)和1 mol B(g)投入一容积可变的密闭容器中,发生如下可逆反应:A(g)+B(g)![]() xC(g),经测定C在反应混合物中的物质的量分数(C%)与时间(t)符合图Ⅰ所示关系,由此推断下列说法中正确的是
xC(g),经测定C在反应混合物中的物质的量分数(C%)与时间(t)符合图Ⅰ所示关系,由此推断下列说法中正确的是
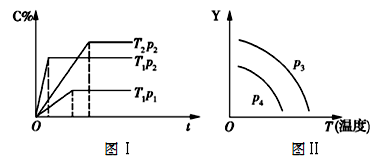
11.以反应5H2C2O4+2MnO4-+6H +===10CO2↑+2Mn2++8H2O为例探究“外界条件对化学反应速率的影响”。实验时,分别量取H2C2O4溶液和酸性KMnO4溶液,迅速混合并开始计时,通过测定溶液褪色所需时间来判断反应的快慢。
| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
| 浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | ||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
下列说法不正确的是
12.下列各图与表述一致的是
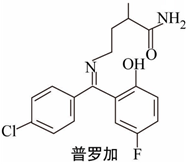
13.普罗加比对癫痫、痉挛和运动失调均有良好的治疗效果,其结构如图所示,有关普罗加比的说法正确的是
14.某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)可用于制备FeCO3,其流程如下:
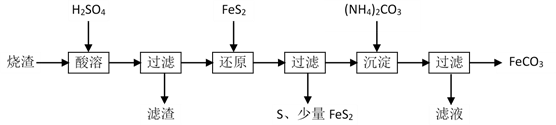
已知:“还原”时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应Ⅰ如下:FeS2+ 14Fe3++ 8H2O =15Fe2++ 2SO42—+ 16H+
下列说法不正确的是
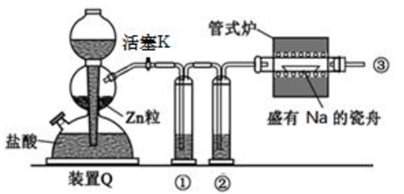
15.实验室用 H2 和钠反应制备氢化钠的装置如右图所示(Zn 粒中含有少量 ZnS 杂质), 下列说法不正确的是
16.下列实验中,对应的现象及结论都正确且两者具有因果关系的是
| 选项 | 实验 | 现象 | 结论 |
| A | 向FeSO4溶液中滴加HNO3酸化的H2O2 | 溶液由浅绿色变为黄色 | 氧化性: H2O2>Fe3+ |
| B | 将铜粉加1mol·L-1Fe(SO4)3溶液中 | 溶液变蓝、有黑色固体出现 | 活泼性: Fe>Cu |
| C | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 | 金属熔化,但液 态铝不滴落下来 | 熔点:A12O3>A1 |
| D | 将稀盐酸滴入饱和NaHCO3溶液中,再将产生的气体通入Na2SiO3溶液 | Na2SiO3溶液变浑浊 | 酸性:HCl>H2CO3>H2SiO3 |
第II卷 非选择题(共52分)
本卷共3题,第17题14分,第18题20分,第19题18分,共52分。
17.(本题满分14分)亚硝酰氯(NOCl)是有机合成中ffi重要试剂,可由NO与Cl2在常温常压(或稍低温度)下合成,其熔点-64.5℃,沸点-5.5℃,遇水易水解。实验室模拟制备装置如图所示(部分夹持装置省略),D中三颈烧瓶置于-10℃冰盐水中。
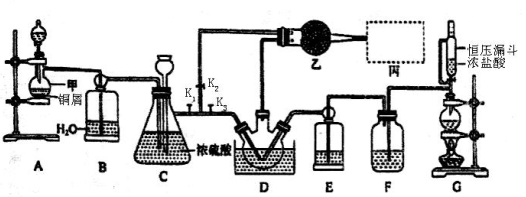
经查阅资料:NO与NaOH溶液不反应,但NO2+NO+2NaOH =2NaNO2+H2O
19.(本题满分20分)已知:①甲醛(HCHO)与葡萄糖化学性质相似,都具有还原性。②甲酸钙易溶于水。为探究过量甲醛和新制Cu(OH)2反应的产物,进行如下实验。
(1)在右图装置中进行实验,向a中加入0.5 mol·L-1CuSO4溶液50 mL和5 mol·L-1NaOH溶液100 mL,振荡,再加入40%的甲醛溶液50 mL,缓慢加热20分钟后冷却至室温。
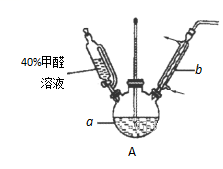
①仪器a的名称是_____________;(1分)
②能说明甲醛具有还原性的实验现象是______________。(2分)
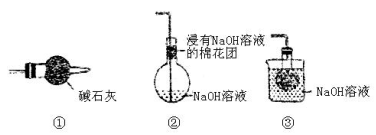
(2)上述实验有副反应发生,产生的气体为CO、H2中的一种或两种。为确认气体成分,将装置A和如下图所示装置连接后进行实验。
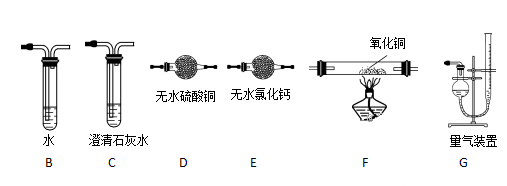
依次连接的合理顺序为A→B→___→____→____→____→G,装置B的作用是_________。有H2的实验现象是_________________________。(4分)
(3)已知HCHO![]() HCOOH
HCOOH![]() H2CO3。设计实验证明a中甲醛中的碳元素未被氧化成+4价。写出实验操作、现象、结论______________________。(4分)
H2CO3。设计实验证明a中甲醛中的碳元素未被氧化成+4价。写出实验操作、现象、结论______________________。(4分)
(4)反应后a中有红色固体产生,为探究其组成,提出如下假设:
假设一:只有Cu2O。 假设二:只有Cu。
假设三:Cu2O和CuO 假设四:________________________ ;
假设_______明显不成立,理由是___________________________ 。(3分)
进行如下实验(以下每步均充分反应):
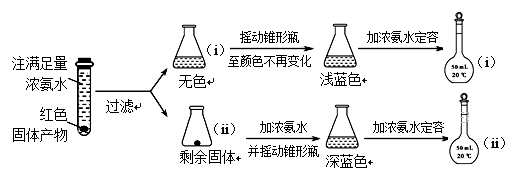
已知:Cu2O![]() [Cu(NH3)4]+(无色)
[Cu(NH3)4]+(无色)![]() [Cu(NH3)4]2+(蓝色)
[Cu(NH3)4]2+(蓝色)
①锥形瓶ii中固体完全溶解得深蓝色溶液的离子方程式为____________________;(3分)
②将容量瓶ii中的溶液稀释100倍后,溶液的颜色与容量瓶i相近。由此可知固体产物的组成及物质的量之比约为________________。(3分)
19.(本题满分18分)绿矾的化学式可表示为FeSO4·xH2O,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的某些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加少量稀H2SO4后,再滴加KSCN溶液,溶液颜色无明显变化。充分振荡后,溶液逐渐变红。溶液变红的原因是_________(用离子方程式表示)。(3分)
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g。按下图连接好装置进行实验。
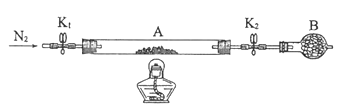
①下列实验操作步骤的正确排序为________________(填标号);重复上述操作步骤,直至A恒重,记为m3g。(3分)
a.关闭K1和K2b.打开K1和K2,缓缓通入N2c.点燃酒精灯,加热 d.称量A e.冷却到室温 f.熄灭酒精灯
②判断A是否恒重的方法是____________________。(3分)
③根据实验记录,绿矾化学式中结晶水数目x=________________(列式表示)。(3分)
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入由下图所示仪器组装而成的装置中,打开K1和K2,缓缓通入N2一段时间后,加热。实验后反应管中残留固体为红色粉末。
①反应中有两种气体产物生成,为检验该气体混合物的组成,请从下图所示的仪器中,选择合适的仪器(含其中的试剂),组成一套实验装置,该装置的连接顺序(按气体流向从左到右)依次为___________→D(填装置序号)。装置中除有气泡冒出外,其他证明实验结论的现象分别为__________________________。(3分)
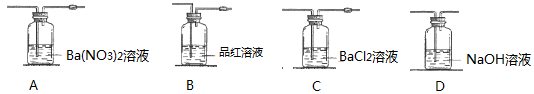
②硫酸亚铁高温分解的化学方程式为_____________________。(3分)
衡阳八中2018届高三年级实验班第一次质检化学参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | C | A | B | B | B | A | A | A | D | B |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | ||||
| 答案 | B | C | D | C | D | C |
17.
(1)蒸馏烧瓶
(2)平衡压强,便于液体顺利流下
(3)![]()
(4)储存A中产生的NO D
(5)防止水蒸气进入D,使NOCl水解 ②
18.
(1)三颈瓶或三颈烧瓶 a中出现砖红色物质
(2)E F D C 吸收甲醛蒸气,防止其干扰后续检验 F中黑色固体变红色,D中固体变蓝色
(3)取少量a中反应后的清液,滴入过量稀硫酸,未见气泡产生,说明甲醛中的碳元素未被氧化成+4价
(4)Cu2O和Cu 三 CuO为黑色固体
2Cu+O2+8NH3·H2O ===2[Cu(NH3)4]2++4OH-+6H2On(Cu2O)︰n(Cu)=1︰200
19. (1)4Fe2+ + O2+ 4H+=4Fe3++ 2H2O
(2)bcfead 最后两次称量 A的质量差不超过0.1克 ![]()
(3)C、B 生成白色沉淀、褪色 2FeSO4![]() Fe2O3+SO2↑+SO3↑
Fe2O3+SO2↑+SO3↑