
湖南省醴陵二中、醴陵四中2016-2017学年高二下学期期中联考化学试卷
03月05日
2019年湖南省长沙一中高考化学模拟试卷(二)
一、选择题(共7小题,每小题6分,满分42分)
1.(6分)化学在人类生活中扮演重要角色,下列说法正确的是( )
A.蔬菜和粗粮中富含纤维素,纤维素在人体中酶的作用下能水解成葡萄糖
B.混凝法、中和法、沉淀法、氧化还原法是工业处理废水常用的方法
C.可只用淀粉溶液检验食盐中是否加碘
D.鸡蛋清溶液中加人饱和Na2SO4溶液,有沉淀生成是因为蛋白质变性
2.(6分)设NA为阿伏加德罗常数的值.下列有关叙述正确的是( )
A.1 mol CnH2n﹣2(n≥2)中所含的共用电子对数为(3n+1)NA
B.25℃时,1L pH=2 的H2SO4溶液中所含H+数为0.01NA
C.标准状况下,22.4 L CH3OH 中含有的共价键数为5NA
D.60g的乙酸和葡萄糖混合物充分燃烧消耗3NA个O2
3.(6分)3,5﹣二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成.一种以间苯三酚为原料的合成反应如图:

反应结束后,先分离出甲醇,再加入乙醚,将获得的有机层(含少量氯化氢)进行洗涤,然后分离提纯得到产物.甲醇和3,5﹣二甲氧基苯酚的部分物理性质见表:
| 物质 | 沸点/℃ | 熔点/℃ | 溶解性 |
| 甲醇 | 64.7 | ﹣97.8 | 易溶于水 |
| 3,5﹣二甲氧基苯酚 | 172~175 | 33~36 | 易溶于甲醇、乙醚,微溶于水 |
下列说法正确的是( )
A.分离出甲醇的操作是结晶
B.间苯三酚与苯酚互为同系物
C.上述合成反应属于取代反应
D.洗涤时可以用饱和Na2CO3溶液除氯化氢
4.(6分)表1是元素周期表的一部分:
| 氧 | X |
| Y | Z |
表2
| 数据编号 | 滴入NaOH溶液的体积/mL | 溶液的pH | |
| HX | HZ | ||
| ① | 0 | 3 | 1 |
| ② | 20.00 | a | 7 |
25℃时,用浓度为0.1000mol/L的氢氧化钠溶液分别滴定20.00mL浓度均为0.1000mol/L的两种酸HX、HZ(忽略溶液体积变化),实验数据如表2,下列判断正确的是( )
A.表格中a<7
B.25℃时,HX的电离常数Ka=1×10﹣6
C.Y和Z两元素的简单氢化物受热分解,前者分解温度高
D.0.1000mol/L Na2Y的水溶液中:c(Y2﹣)+c(HY﹣)+c(H2Y)=0.1000mol/L
5.(6分)某学生探究0.25mol/L Al2(SO4)3溶液与0.5mol/L Na2CO3溶液的反应,实验如下。
| 实验1 | 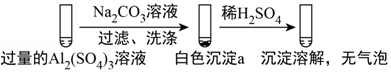 |
| 实验2 | 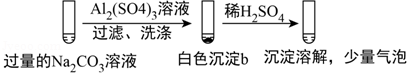 |
下列分析不正确的是( )
A.实验1中,白色沉淀a是Al(OH)3
B.实验2中,白色沉淀b含有CO32﹣
C.实验1、2中,白色沉淀成分不同的原因与混合后溶液的pH无关
D.检验白色沉淀a、b是否洗涤干净,均可用盐酸酸化的BaCl2溶液
6.(6分)甲醇是重要的化工原料和燃料。将CO2与含少量CO的H2混合,在恒容密闭容器中发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),图1是在两种投料比[]分别为1:4和1:6时,CO2平衡转化率随温度变化的曲线,图2是生成的甲醇/过氧化氢燃料电池的工作原理示意图

下列有关说法正确的是( )
A.图1中b点对应的平衡常数K值大于c点
B.图1中a点对应的H2的转化率等于30%
C.图2中电极M上发生还原反应
D.图2中电极N的反应式:H2O2+2e﹣+2H+=2H2O
7.(6分)T1和T2温度下(T1>T2),BaSO4在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是( )
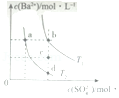
A.T1时,c点有沉淀生成
B.T2时,蒸发溶剂可能由d点变到b点
C.T2时,由a点开始加入BaCl2固体,Ksp增大
D.BaSO4的溶解度随温度升高而增大
二、解答题(共3小题,满分43分)
8.(14分)硫化碱法是工业上制备Na2S2O3的方法之一,反应原理为:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2(该反应△H>0),某研究小组在实验室用硫化碱法制备Na2S2O3•5H2O流程如图一.
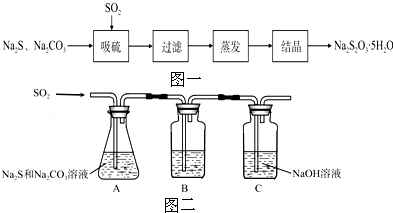
(1)吸硫装置如图二所示.
①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是 ,表明SO2吸收效率低的实验现象是B中溶液 .
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是 、 .(写出两条)
(2)假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验.(室温时CaCO3饱和溶液的pH=10.2)
限选试剂及仪器:稀硝酸、AgNO3溶液、CaCl2溶液、Ca(NO3)2溶液、酚酞溶液、蒸馏水、pH计、烧杯、试管、滴管
| 序号 | 实验操作 | 预期现象 | 结论 |
| ① | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解, . | 有白色沉淀生成 | 样品含NaCl |
| ② | 另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解, . | 有白色沉淀生成,上 层清液pH>10.2 | 样品含NaOH |
(3)Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:第一步:准确称取a g KIO3(相对分子质量:214)固体配成溶液,第二步:加入过量KI固体和H2SO4溶液,滴加指示剂,第三步:用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为V mL.则c(Na2S2O3)= mol•L﹣1.(只列出算式,不作运算)
已知:IO3﹣+5I﹣+6H+═3I2+3H2O 2S2O32﹣+I2═S4O62﹣+2I﹣
某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的Na2S2O3浓度可能 (填“无影响”、“偏低”或“偏高”),原因是 .
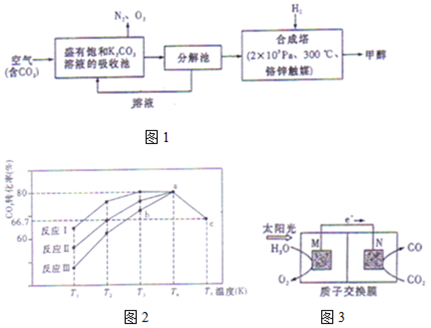
9.(15分)近年科学家提出“绿色自由”构想。把含有大量CO2的空气吹入K2CO3溶液中,再把CO2从溶液中提取出来,并使之与H2反应生成可再生能源甲醇。其工艺流程如图1所示:
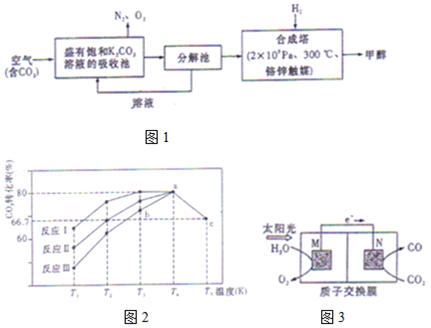
(1)分解池中主要物质是 ;
(2)在合成塔中,若有4.4kg CO2与足量H2恰好完全反应,生成气态的水和甲醇,可放出5370kJ的热量,写出该反应的热化学方程式 ;
(3)该工艺在那些方面体现了“绿色自由”构想中的“绿色” 。(答二条)
(4)一定条件下,向2L恒容密闭容器中充入1mol CO2和3mol H2,在不同催化剂作用下发生反应I、反应II与反应III,相同时间内CO2的转化率随温度变化如图2所示:
(图中c点的转化率为66.67%,即转化了)
①催化剂效果最佳的反应是 (填“反应I”,“反应II”,“反应III”)。
②b点v (正) v (逆)(填“>”,“<”,“=”)。
③若此反应在a点时已达平衡状态,a点的转化率比c点高的原因是 。
④c点时该反应的平衡常数K= 。
⑤一定条件下,向2L恒容密闭的上述容器中再充入1mol CO2和3mol H2,达到新的化学平衡后,CO2的浓度较原平衡浓度 (填“增大”、“减小”或“不变”)。
(5)科学家还研究了其它转化温室气体的方法,利用图3所示装置可以将CO2转化为气体燃料CO.该装置工作时,N电极的电极反应式为 。
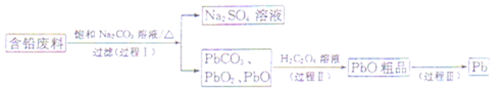
10.(14分)我国每年产生的废旧铅蓄电池约330万吨。从含铅废料(含PbSO4、PbO2、PbO等)中回收铅,实现铅的再生,意义重大。一种回收铅的工艺流程如下:
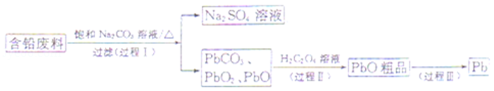
(1)铅蓄电池放电时,PbO2作 极。
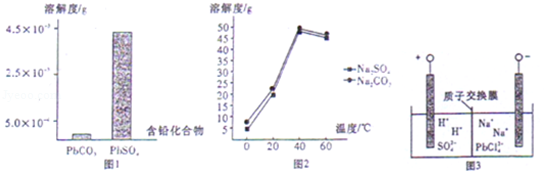
(2)过程I,已知:PbSO4、PbCO3的溶解度(20℃)见图l;Na2SO4、Na2CO3的溶解度见图2。
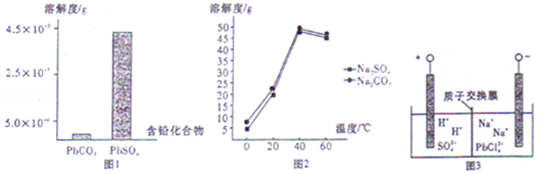
①根据图l写出过程I的离子方程式: 。
②生产过程中的温度应保持在40℃,若温度降低,PbSO4的转化速率下降。根据图2,解释可能原因:
i.温度降低,反应速率降低;
ii. (请你提出一种合理解释)。
(3)①过程Ⅱ,发生反应2PbO2+H2C2O4═2PbO+H2O2+2CO2↑.实验中检测到有大量O2放出,推测PbO2氧化了H2O2,通过实验证实了这一推测。实验方案是 。(已知:PbO2为棕黑色固体;PbO为橙黄色固体)
②写出H2O2的电子式 。
(4)过程Ⅲ,将PbO粗品溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液,生成Pb,如图3。
①阴极的电极反应式是 。
②电解一段时间后,PbCl42﹣浓度极大下降,为了恢复其浓度且实现物质的循环利用,阴极区采取的方法是 。
(5)如果用铅蓄电池作电源电解饱和食盐水制取Cl2,已知某铅蓄电池中硫酸溶液的体积为0.8L,电解其按硫酸浓度为4.5mol/L,当制得26.88L Cl2时(指在标准状况下),求理论上电解后电池中硫酸溶液的浓度为 mol•L﹣1.(假设电解前后硫酸溶液的体积不变)
[化学-选修3:物质结构与性质]
11.(15分)硼及其化合物应用广泛。回答下列问题:
(1)基态B原子的价电子轨道表达式为 ,其第一电离能比Be (填“大”或“小”)。
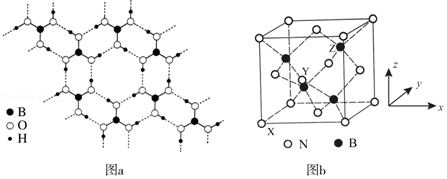
(2)氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,提供孤电子对的成键原子是 ,写出一种与氨硼烷互为等电子体的分子 (填化学式)。
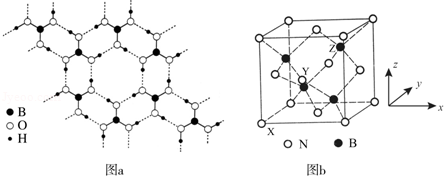
(3)常温常压下硼酸(H3BO3)晶体结构为层状,其二维平面结构如图a。
①B原子的杂化方式为 。从氢键的角度解释硼酸在冷水中的溶解度小而加热时溶解度增大: 。
②路易斯酸碱理论认为,任何可接受电子对的分子或离子叫路易斯酸,任何可给出电子对的分子或离子叫路易斯碱。从结构角度分析硼酸是路易斯酸: 。
(4)立方氮化硼(BN)是特殊的耐磨和切削材料,其晶胞结构与金刚石相似,如图b所示。
①与氮原子直接连接的硼原子构成的几何形状为 。硼原子和氮原子所连接的最小环为 元环。
②晶胞有两个基本要素:
原子坐标参数,表示晶胞内部各原子的相对位置。如图b所示,其中原子坐标参数X为(0,0,0),Y原子的坐标参数为(,0,),则Z原子的坐标参数为 。
晶胞参数,描述晶胞的大小和形状。已知立方氮化硼的密度为d g•cm﹣3,阿伏加德罗常数值为NA,则晶胞参数a= nm.(列出计算式即可)
[化学--选修5:有机化学基础]
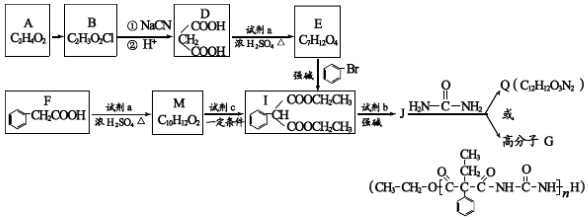
12.A和a是生活中常见的两种有机物,可用于制备安眠药苯巴比妥Q,合成过程如下:
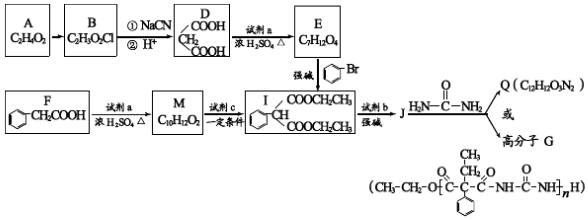
已知: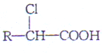
![]()
(1)A的官能团名称为 。。
(2)A→B的反应类型为
(3)D→B的反应方程式为 。
(4)写出符合下列条件F的同分异构体的结构简式 。
①遇 Fe3+溶液显紫色②发生银镜反应③苯环上的一溴代物有两种
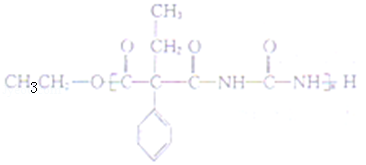
(5)J 与 ![]() 在催化剂作用下既可以生成 Q,又可以生成 G,写出生成 G 的化学方程式 。
在催化剂作用下既可以生成 Q,又可以生成 G,写出生成 G 的化学方程式 。
(6)下列说法正确的是 。
a.E与M互为同系物
b.B水解酸化后的产物可以发生加聚反应
c.用试剂b制备乙烯的条件是NaOH的醇溶液、加热
d.Q的结构简式是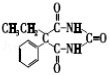
(7)写出以CH2=CH﹣CH=CH2和E位主要原料制备![]() 的流程。(无机试剂自选)
的流程。(无机试剂自选)
2019年湖南省长沙一中高考化学模拟试卷(二)
参考答案与试题解析
一、选择题(共7小题,每小题6分,满分42分)
1.(6分)化学在人类生活中扮演重要角色,下列说法正确的是( )
A.蔬菜和粗粮中富含纤维素,纤维素在人体中酶的作用下能水解成葡萄糖
B.混凝法、中和法、沉淀法、氧化还原法是工业处理废水常用的方法
C.可只用淀粉溶液检验食盐中是否加碘
D.鸡蛋清溶液中加人饱和Na2SO4溶液,有沉淀生成是因为蛋白质变性
【考点】14:物质的组成、结构和性质的关系.菁优网版权所有
【专题】56:化学应用.
【分析】A.人体不含纤维素酶;
B.现代废水处理方法主要分为物理处理法、化学处理法和生物处理法三类,化学处理法有:中和法、化学混凝法、氧化还原法等;物理处理法有:通常采用沉淀、过滤、离心分离、气浮、蒸发结晶、反渗透等方法;生物处理法又分为需氧处理和厌氧处理两种方法;
C.食盐中的碘不是碘单质;
D.蛋白质在硫酸钠溶液中发生盐析.
【解答】解:A.人体不含纤维素酶,纤维素在人体中不能水解,故A错误;
B.混凝法、中和法、沉淀法、氧化还原法是工业处理废水常用的方法,故B正确;
C.食盐中的碘以碘酸钾形式存在,与淀粉不反应,所以只用淀粉溶液检验食盐中是否加碘不能达到目的,故C错误;
D.蛋白质在硫酸钠溶液中发生盐析,性质没有发生变化,故D错误;
故选:B。
【点评】本题综合考查物质的性质和用途,为高考常见题型,侧重于化学与生活、化学与环境的考查,有利于培养学生良好的科学素养,注意相关基础知识的积累,难度不大.
2.(6分)设NA为阿伏加德罗常数的值.下列有关叙述正确的是( )
A.1 mol CnH2n﹣2(n≥2)中所含的共用电子对数为(3n+1)NA
B.25℃时,1L pH=2 的H2SO4溶液中所含H+数为0.01NA
C.标准状况下,22.4 L CH3OH 中含有的共价键数为5NA
D.60g的乙酸和葡萄糖混合物充分燃烧消耗3NA个O2
【考点】4F:阿伏加德罗常数.菁优网版权所有
【专题】518:阿伏加德罗常数和阿伏加德罗定律.
【分析】A、CnH2n﹣2中C原子与H原子之间的共用电子对为(2n﹣2)对,而C原子之间的共用电子对为n﹣1+2=n+1对;
B、pH=2的硫酸溶液中,氢离子浓度为0.01mol/L;
C、标况下甲醇为液体;
D、乙酸和葡萄糖的最简式均为CH2O.
【解答】解:A、CnH2n﹣2中C原子与H原子之间的共用电子对为(2n﹣2)对,而C原子之间的共用电子对为n﹣1+2=n+1对,即CnH2n﹣2中含共用电子对为(2n﹣2)+(n+1)=(3n﹣1)对,故1 mol CnH2n﹣2(n≥2)中所含的共用电子对数为(3n﹣1)NA,故A错误;
B、pH=2的硫酸溶液中,氢离子浓度为0.01mol/L,故1L溶液中含有的氢离子的物质的量为0.01mol,个数为0.01NA个,故B正确;
C、标况下甲醇为液体,故不能根据气体摩尔体积来计算其物质的量和共价键个数,故C错误;
D、乙酸和葡萄糖的最简式均为CH2O,故60g混合物中含有的CH2O的物质的量为2mol,而1molCH2O燃烧消耗1mol氧气,故2molCH2O燃烧消耗的氧气分子个数为2NA个,故D错误。
故选:B。
【点评】本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.
3.(6分)3,5﹣二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成.一种以间苯三酚为原料的合成反应如图:

反应结束后,先分离出甲醇,再加入乙醚,将获得的有机层(含少量氯化氢)进行洗涤,然后分离提纯得到产物.甲醇和3,5﹣二甲氧基苯酚的部分物理性质见表:
| 物质 | 沸点/℃ | 熔点/℃ | 溶解性 |
| 甲醇 | 64.7 | ﹣97.8 | 易溶于水 |
| 3,5﹣二甲氧基苯酚 | 172~175 | 33~36 | 易溶于甲醇、乙醚,微溶于水 |
下列说法正确的是( )
A.分离出甲醇的操作是结晶
B.间苯三酚与苯酚互为同系物
C.上述合成反应属于取代反应
D.洗涤时可以用饱和Na2CO3溶液除氯化氢
【考点】HD:有机物的结构和性质.菁优网版权所有
【专题】545:物质的分离提纯和鉴别.
【分析】A.甲醇与3,5﹣二甲氧基苯酚沸点不同;
B.间苯三酚与苯酚含有的羟基数目不同;
C.根据官能团的变化判断;
D.碳酸钠和酚羟基反应.
【解答】解:A.甲醇与3,5﹣二甲氧基苯酚沸点不同,应用蒸馏的方法分离,故A错误;
B.间苯三酚与苯酚含有的羟基数目不同,二者不是同系物,故B错误;
C.题给反应可看作﹣OH的H被甲基取代,为取代反应,故C正确;
D.碳酸钠和酚羟基反应,应用碳酸氢钠,故D错误。
故选:C。
【点评】本题考查有机物的合成、分离,为高频考点,侧重考查学生的分析能力和实验能力,注意把握题给信息以及有机物的结构和性质,难度不大.
4.(6分)表1是元素周期表的一部分:
| 氧 | X |
| Y | Z |
表2
| 数据编号 | 滴入NaOH溶液的体积/mL | 溶液的pH | |
| HX | HZ | ||
| ① | 0 | 3 | 1 |
| ② | 20.00 | a | 7 |
25℃时,用浓度为0.1000mol/L的氢氧化钠溶液分别滴定20.00mL浓度均为0.1000mol/L的两种酸HX、HZ(忽略溶液体积变化),实验数据如表2,下列判断正确的是( )
A.表格中a<7
B.25℃时,HX的电离常数Ka=1×10﹣6
C.Y和Z两元素的简单氢化物受热分解,前者分解温度高
D.0.1000mol/L Na2Y的水溶液中:c(Y2﹣)+c(HY﹣)+c(H2Y)=0.1000mol/L
【考点】DO:酸碱混合时的定性判断及有关ph的计算;R3:中和滴定.菁优网版权所有
【专题】51C:元素周期律与元素周期表专题.
【分析】根据各元素在周期表中的相对位置可知,X为F、Y为S、Z为Cl元素,则HX为HF、HZ为HCl,
A.HF为弱酸,加入20.00mL等浓度的氢氧化钠溶液时,反应后溶质为NaF,溶液呈碱性;
B.根据0.1000mol/L的HF溶液的pH=3计算该稳定性HF的电离平衡常数;
C.非金属性越强,氢化物稳定性越强,分解时需要温度越高;
D.根据该溶液中的物料守恒分析.
【解答】解:根据各元素在周期表中的相对位置可知,X为F、Y为S、Z为Cl元素,则HX为HF、HZ为HCl,
A.当滴入20.00mL等浓度、等体积的HF溶液后,二者恰好反应生成NaF,氟离子部分水解溶液呈碱性,则a>7,故A错误;
B.0.1000mol/L的HF溶液的pH=3,则c(H+)=0.001mol/L,c(HF)≈0.1000mol/L,c(F﹣)≈c(H+)=0.001mol/L,则Ka1×10﹣5,故B错误;
C.Y、Z分别为S、Cl元素,非金属性S<Cl,则HCl的稳定性较强,即HCl分解时需要温度较高,故C错误;
D.0.1000mol/L Na2S的水溶液中,根据物料守恒可得:c(H2S)+c(S2﹣)+c(HS﹣)=0.1000mol/L,故D正确;
故选:D。
【点评】本题考查酸碱混合的定性判断及溶液pH的计算,题目难度中等,明确元素周期律结构为解答关键,注意掌握溶液酸碱性与溶液pH的关系,试题培养了学生的分析、理解能力及灵活应用能力.
5.(6分)某学生探究0.25mol/L Al2(SO4)3溶液与0.5mol/L Na2CO3溶液的反应,实验如下。
| 实验1 | 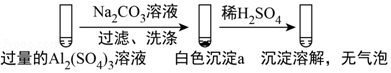 |
| 实验2 | 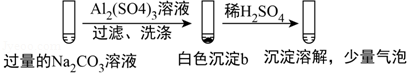 |
下列分析不正确的是( )
A.实验1中,白色沉淀a是Al(OH)3
B.实验2中,白色沉淀b含有CO32﹣
C.实验1、2中,白色沉淀成分不同的原因与混合后溶液的pH无关
D.检验白色沉淀a、b是否洗涤干净,均可用盐酸酸化的BaCl2溶液
【考点】U5:化学实验方案的评价.菁优网版权所有
【专题】545:物质的分离提纯和鉴别.
【分析】实验1在过量的硫酸铝溶液中加入碳酸钠溶液,过滤、洗涤,得到的沉淀a加入稀硫酸,沉淀溶解,没有气泡,可说明沉淀a含有Al(OH)3,
实验2在过量的碳酸钠溶液中加入硫酸铝溶液,过滤、洗涤,得到沉淀b,加入稀硫酸,沉淀溶解,并有少量气泡,沉淀b中含有Al(OH)3,并含有碳酸盐,以此解答该题。
【解答】解:A.由以上分析可知实验1中,白色沉淀a是Al(OH)3,故A正确;
B.实验2中有气泡生成,该气体为二氧化碳,可说明白色沉淀b含有CO32﹣,故B正确;
C.实验1、2中,加入试剂顺序不同,生成的沉淀的pH不同,生成沉淀不同,可说明与pH有关,故C错误;
D.检验沉淀是否洗涤干净,可通过检验硫酸根离子的方法,即用盐酸酸化的BaCl2溶液,观察是否有沉淀生成,故D正确。
故选:C。
【点评】本题考查化学实验方案的评价,为高频考点,侧重考查学生的分析能力和实验能力的考查,注意把握物质的性质以及实验现象的分析,难度不大。
6.(6分)甲醇是重要的化工原料和燃料。将CO2与含少量CO的H2混合,在恒容密闭容器中发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),图1是在两种投料比[]分别为1:4和1:6时,CO2平衡转化率随温度变化的曲线,图2是生成的甲醇/过氧化氢燃料电池的工作原理示意图
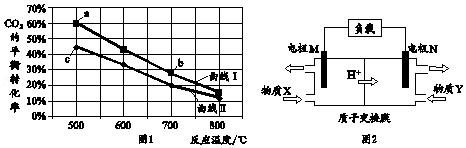
下列有关说法正确的是( )
A.图1中b点对应的平衡常数K值大于c点
B.图1中a点对应的H2的转化率等于30%
C.图2中电极M上发生还原反应
D.图2中电极N的反应式:H2O2+2e﹣+2H+=2H2O
【考点】BH:原电池和电解池的工作原理.菁优网版权所有
【专题】51I:电化学专题.
【分析】A、温度升高二氧化碳的平衡转化率降低,所以平衡逆向移动,则正反应是放热反应;
B、相同条件下,二氧化碳的含量越高,二氧化碳转化率越低;
C、质子向正极移动,所以N是正极,则M是负极;
D、N是正极,发生还原反应,过氧化氢得电子生成水;
【解答】解:A、温度升高二氧化碳的平衡转化率降低,所以平衡逆向移动,则正反应是放热反应,所以b点对应的平衡常数K值小于c点,故A错误;
B、相同条件下,二氧化碳的含量越高,二氧化碳转化率越低,所以曲线Ⅰ是两种投料比[]为1:6,而一氧化碳与氢气的物质的量之比不知,所以无法求氢气的转化率无法,故B错误;
C、质子向正极移动,所以N是正极,则M是负极,所以M发生氧化反应,故C错误;
D、N是正极,发生还原反应,电极反应式为:H2O2+2e﹣+2H+=2H2O,故D正确;
故选:D。
【点评】本题主要考查化学平衡移动原理的应用和原电池的工作原理,学生要注意影响化学平衡常数的因素等知识点和电极反应式的书写,难度中等,解题时注意基础的准确运用。
7.(6分)T1和T2温度下(T1>T2),BaSO4在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是( )
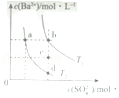
A.T1时,c点有沉淀生成
B.T2时,蒸发溶剂可能由d点变到b点
C.T2时,由a点开始加入BaCl2固体,Ksp增大
D.BaSO4的溶解度随温度升高而增大
【考点】DH:难溶电解质的溶解平衡及沉淀转化的本质.菁优网版权所有
【专题】51G:电离平衡与溶液的pH专题.
【分析】A.T1时,c点Qc<Ksp;
B.蒸发时,阴阳离子浓度均增大;
C.Ksp与温度有关;
D.T1>T2,由图可知,T1时Ksp大.
【解答】解:A.T1时,c点Qc<Ksp,则c点无沉淀生成,故A错误;
B.蒸发时,阴阳离子浓度均增大,d点变到b点时硫酸根离子浓度不变,则蒸发不能实现转化,故B错误;
C.Ksp与温度有关,则T2时,由a点开始加入BaCl2固体,Ksp不变,故C错误;
D.T1>T2,由图可知,T1时Ksp大,则BaSO4的溶解度随温度升高而增大,故D正确;
故选:D。
【点评】本题考查难溶电解质的溶解平衡,为高频考点,把握图中纵横坐标的含义,Ksp及曲线上的点均为平衡点为解答的关键,侧重分析与应用能力的考查,注意纵横坐标的积为Ksp,题目难度不大.
二、解答题(共3小题,满分43分)
8.(14分)硫化碱法是工业上制备Na2S2O3的方法之一,反应原理为:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2(该反应△H>0),某研究小组在实验室用硫化碱法制备Na2S2O3•5H2O流程如图一.
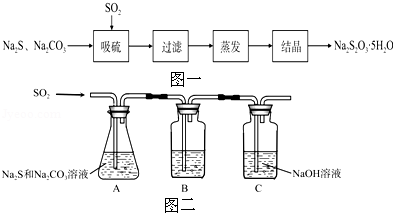
(1)吸硫装置如图二所示.
①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是 品红、溴水或KMnO4溶液 ,表明SO2吸收效率低的实验现象是B中溶液 溶液颜色很快褪色 .
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是 增大SO2的接触面积或控制SO2的流速 、 适当升高温度 .(写出两条)
(2)假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验.(室温时CaCO3饱和溶液的pH=10.2)
限选试剂及仪器:稀硝酸、AgNO3溶液、CaCl2溶液、Ca(NO3)2溶液、酚酞溶液、蒸馏水、pH计、烧杯、试管、滴管
| 序号 | 实验操作 | 预期现象 | 结论 |
| ① | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解, 滴加足量稀硝酸,再滴加少量AgNO3溶液,振荡 . | 有白色沉淀生成 | 样品含NaCl |
| ② | 另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解, 加入过量CaCl2溶液,搅拌,静置,用pH计测定上层清液pH . | 有白色沉淀生成,上 层清液pH>10.2 | 样品含NaOH |
(3)Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:第一步:准确称取a g KIO3(相对分子质量:214)固体配成溶液,第二步:加入过量KI固体和H2SO4溶液,滴加指示剂,第三步:用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为V mL.则c(Na2S2O3)= mol•L﹣1.(只列出算式,不作运算)
已知:IO3﹣+5I﹣+6H+═3I2+3H2O 2S2O32﹣+I2═S4O62﹣+2I﹣
某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的Na2S2O3浓度可能 偏高 (填“无影响”、“偏低”或“偏高”),原因是 4I﹣+4H++O2═2I2+2H2O .
【考点】U3:制备实验方案的设计.菁优网版权所有
【专题】17:综合实验题.
【分析】由制备流程可知,A中发生2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2,B中检验二氧化硫,C在尾气处理,A中反应后过滤、蒸发、结晶得到Na2S2O3•5H2O,
(1)①二氧化硫具有还原性、漂白性;
②减缓二氧化硫的流速,适当升高温度,均能使二氧化硫充分反应;
(2)①氯离子与银离子反应生成白色沉淀不溶于硝酸;
②NaOH的碱性强,可以通过测定pH来确定是否有NaOH;
(3)根据KIO3的量求出I2,再根据S2O32﹣与I2的关系求出Na2S2O3的物质的量及浓度;第三步滴速太慢,I﹣被空气氧化,消耗的Na2S2O3溶液的体积偏小.
【解答】解:(1)①二氧化硫具有还原性、漂白性,所以可以用品红、溴水或KMnO4溶液,来检验二氧化硫是否被完全吸收,若SO2吸收效率低,则二氧化硫有剩余,B中的溶液会褪色,
故答案为:品红、溴水或KMnO4溶液;溶液颜色很快褪色;
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,可以减缓二氧化硫的流速,使二氧化硫与溶液充分接触反应,适当升高温度,也能使二氧化硫充分反应,
故答案为:增大SO2的接触面积或控制SO2的流速;适当升高温度;
(2)实验所用的Na2CO3含少量NaCl、NaOH,若检验NaCl存在,需先加稀硝酸排除干扰,再加硝酸银溶液,若有白色沉淀生成,说明有NaCl;已知室温时CaCO3饱和溶液的pH=10.2,若要检验氢氧化钠存在,需加入过量CaCl2溶液,把Na2CO3转化为CaCO3,再测量溶液的pH,若pH大于10.2,说明含有NaOH,
故答案为:
| 序号 | 实验操作 | 预期现象 |
| ① | 滴加足量稀硝酸,再滴加少量AgNO3溶液,振荡. | 有白色沉淀生成 |
| ② | 加入过量CaCl2溶液,搅拌,静置,用pH计测定上层清液pH | 有白色沉淀生成,上层清液pH大于10.2 |
;
(3)KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O,I2+2Na2S2O3=Na2S4O6+2NaI;
n(KIO3)mol,设参加反应的Na2S2O3为xmol;
KIO3~~~~3I2~~~~6Na2S2O3
1 6
mol xmol
所以 x,则c(Na2S2O3)mol•L﹣1,
第三步滴速太慢,I﹣被空气氧化,发生4I﹣+4H++O2═2I2+2H2O,消耗的Na2S2O3溶液的体积偏小,由c(Na2S2O3)mol•L﹣1,V偏小,c偏大,
故答案为:;偏大;4I﹣+4H++O2═2I2+2H2O.
【点评】本题考查物质的制备实验及含量测定,为高频考点,把握制备流程、混合物分离提纯、化学反应的计算为解答的关键,侧重分析与实验能力的考查,综合性较强,题目难度中等.
9.(15分)近年科学家提出“绿色自由”构想。把含有大量CO2的空气吹入K2CO3溶液中,再把CO2从溶液中提取出来,并使之与H2反应生成可再生能源甲醇。其工艺流程如图1所示:
(1)分解池中主要物质是 KHCO3(或碳酸氢钾) ;
(2)在合成塔中,若有4.4kg CO2与足量H2恰好完全反应,生成气态的水和甲醇,可放出5370kJ的热量,写出该反应的热化学方程式 CO2(g)+3H2(g)H2O(g)+CH3OH(g)△H═﹣53.7kJ/mol ;
(3)该工艺在那些方面体现了“绿色自由”构想中的“绿色” 减少大气中CO2并产生清洁能源甲醇;K2CO3可循环使用;能量可以循环利用,低碳经济等 。(答二条)
(4)一定条件下,向2L恒容密闭容器中充入1mol CO2和3mol H2,在不同催化剂作用下发生反应I、反应II与反应III,相同时间内CO2的转化率随温度变化如图2所示:
(图中c点的转化率为66.67%,即转化了)
①催化剂效果最佳的反应是 反应I (填“反应I”,“反应II”,“反应III”)。
②b点v (正) > v (逆)(填“>”,“<”,“=”)。
③若此反应在a点时已达平衡状态,a点的转化率比c点高的原因是 该反应为放热反应,温度升高,平衡逆向移动 。
④c点时该反应的平衡常数K= 。
⑤一定条件下,向2L恒容密闭的上述容器中再充入1mol CO2和3mol H2,达到新的化学平衡后,CO2的浓度较原平衡浓度 增大 (填“增大”、“减小”或“不变”)。
(5)科学家还研究了其它转化温室气体的方法,利用图3所示装置可以将CO2转化为气体燃料CO.该装置工作时,N电极的电极反应式为 CO2+2H++2e﹣═CO+H2O 。
【考点】CP:化学平衡的计算.菁优网版权所有
【专题】51E:化学平衡专题.
【分析】整个流程为把含有大量CO2的空气吹入K2CO3溶液中,再把CO2从溶液中提取出来,并使之与H2反应生成可再生能源甲醇,含CO2的空气通入盛有饱和K2CO3溶液的吸收池中,CO2被吸收,N2和O2不发生反应,溶液进入分解池中进一步反应,分解池中的溶液可以回到吸收池中进行二次处理,从分解池中分离出来的CO2在合成塔中与H2在一定条件下反应转化为CH3OH,据此分析,
(1)饱和K2CO3溶液吸收CO2生成KHCO3;
(2)4400gCO2的物质的量为100mol,与足量H2反应,生成气态的H2O和甲醇,可放出5370kJ的热量,则1molCO2参加反应,反应的焓变为△H=﹣53.7kJ/mol;
(3)该工艺体现了“绿色自由”构想的“绿色”理念,根据流程分析,用CO2合成甲醇,有助于减少大气中的CO2,同时K2CO3溶液可以循环利用,据此分析解答;
(4)①使用不同的催化剂,催化效果不一定,CO的转化率不一样,根据图象分析;
②温度升高,仍能继续反应,说明该温度时反应尚未达到化学平衡,反应仍能向右进行;
③若此反应在a点时已达平衡状态,a点的转化率比c点高,根据图象,温度升高,从a到c过程中CO2转化率降低,温度升高,说明温度升高不利于反应正向进行;
④c点的转化率为66.67%,即转化了,起始时往2L恒容密闭容器中充入1molCO2和3molH2,根据方程式计算化学平衡常数K;
⑤再充入1mol CO2和3mol H2,相当于增大压强,平衡向着正向移动,但二氧化碳浓度比原平衡增大;
(5)根据装置图分析,N电极上CO2转化为CO,过程为得电子反应,H+参与反应生成H2O,据此写出电极反应。
【解答】解:(1)饱和K2CO3溶液吸收CO2生成KHCO3,所以分解池中主要溶质为KHCO3,
故答案为:KHCO3(或碳酸氢钾);
(2)CO2与足量H2反应,生成气态的H2O和甲醇,反应的方程式为:CO2(g)+3H2(g)H2O(g)+CH3OH(g),4400gCO2的物质的量为100mol,与足量H2反应,生成气态的H2O和甲醇,可放出5370kJ的热量,则1molCO2参加反应,反应的焓变为△H=﹣53.7kJ/mol,
故答案为:CO2(g)+3H2(g)H2O(g)+CH3OH(g)△H═﹣53.7kJ/mol;
(3)该工艺体现了“绿色自由”构想的“绿色”理念,根据流程分析,用CO2合成甲醇,有助于减少大气中的CO2,同时K2CO3溶液可以循环利用,体现了低碳、环保,
故答案为:减少大气中CO2并产生清洁能源甲醇;K2CO3可循环使用;能量可以循环利用,低碳经济等;
(4)①使用不同的催化剂,催化效果不一定,CO的转化率不一样,根据图象分析,催化效果最好的反应是反应Ⅰ,
故答案为:反应Ⅰ;
②温度升高,仍能继续反应,说明该温度时反应尚未达到化学平衡,反应仍能向右进行,则反应速率v正>v逆,
故答案为:>;
③若此反应在a点时已达平衡状态,a点的转化率比c点高,根据图象,温度升高,从a到c过程中CO2转化率降低,温度升高,说明温度升高不利于反应正向进行,反应为放热反应,
故答案为:该反应为放热反应,温度升高,平衡逆向移动;
④c点的转化率为66.67%,即转化了,起始时往2L恒容密闭容器中充入1molCO2和3molH2,则平衡体系中c(CO2)mol/L,c(H2)mol/L,c(CH3OH)=c(H2O)mol/L,所以反应的化学平衡常数为K,
故答案为:;
⑤一定条件下,向2L恒容密闭的上述容器中再充入1mol CO2和3mol H2,增大了压强,平衡向着正向移动,达到新的化学平衡后,二氧化碳的转化率增大,但平衡后二氧化碳的物质的量比原平衡大,则CO2的浓度较原平衡浓度会增大,
故答案为:增大;
(5)根据装置图分析,N电极上CO2转化为CO,过程为得电子反应,H+参与反应生成H2O,则N电极上发生的电极反应为:CO2+2H++2e﹣═CO+H2O,
故答案为:CO2+2H++2e﹣═CO+H2O。
【点评】本题考查化学平衡的计算,题目难度中等,涉及到化学原理相关知识,盖斯定律的应用,化学平衡的移动,化学平衡常数的计算,电极反应式的书写,均为高频考点,整体难度中等,具有一定的综合性。
10.(14分)我国每年产生的废旧铅蓄电池约330万吨。从含铅废料(含PbSO4、PbO2、PbO等)中回收铅,实现铅的再生,意义重大。一种回收铅的工艺流程如下:
(1)铅蓄电池放电时,PbO2作 正 极。
(2)过程I,已知:PbSO4、PbCO3的溶解度(20℃)见图l;Na2SO4、Na2CO3的溶解度见图2。
①根据图l写出过程I的离子方程式: PbSO4(s)+CO32﹣(aq)=PbCO3(s)+SO42﹣(aq) 。
②生产过程中的温度应保持在40℃,若温度降低,PbSO4的转化速率下降。根据图2,解释可能原因:
i.温度降低,反应速率降低;
ii. 硫酸钠和碳酸钠浓度降低,反应速率减小 (请你提出一种合理解释)。
(3)①过程Ⅱ,发生反应2PbO2+H2C2O4═2PbO+H2O2+2CO2↑.实验中检测到有大量O2放出,推测PbO2氧化了H2O2,通过实验证实了这一推测。实验方案是 取少量PbO2与试管中,向其中滴加H2O2溶液,产生可使带火星木条复燃的气体,同时棕黑色固体变为橙黄色,证实推测正确 。(已知:PbO2为棕黑色固体;PbO为橙黄色固体)
②写出H2O2的电子式 ![]() 。
。
(4)过程Ⅲ,将PbO粗品溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液,生成Pb,如图3。
①阴极的电极反应式是 PbCl42﹣+2e﹣=Pb+4Cl﹣ 。
②电解一段时间后,PbCl42﹣浓度极大下降,为了恢复其浓度且实现物质的循环利用,阴极区采取的方法是 继续向阴极区加PbO粗品 。
(5)如果用铅蓄电池作电源电解饱和食盐水制取Cl2,已知某铅蓄电池中硫酸溶液的体积为0.8L,电解其按硫酸浓度为4.5mol/L,当制得26.88L Cl2时(指在标准状况下),求理论上电解后电池中硫酸溶液的浓度为 1.5 mol•L﹣1.(假设电解前后硫酸溶液的体积不变)
【考点】P8:物质分离和提纯的方法和基本操作综合应用.菁优网版权所有
【专题】545:物质的分离提纯和鉴别.
【分析】含铅废料(PbSO4、PbO2、PbO等),加入饱和碳酸钠溶液过滤得到PbCO3、PbO2、PbO和滤液硫酸钠溶液,PbCO3、PbO2、PbO加入草酸过滤得到PbO粗品,将PbO粗品溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液,生成Pb和O2,
(1)铅蓄电池放电时Pb做负极,PbO2做正极;
(2)①碳酸铅溶解度小于硫酸铅;
②反应速率减小的原因是温度降低、物质浓度减小;
(3)①实验中检测到有大量O2放出,推测PbO2氧化了H2O2,可以取二氧化铅和过氧化氢混合检验是否生成氧气设计;
②过氧化氢为共价化合物,氧原子和氧原子、氢原子形成两队共用电子对,据此写出电子式;
(4)电解Na2PbCl4溶液,生成Pb和O2,
①阴极的电极反应是发生还原反应,元素化合价降低;
②阴极电解一段时间后溶液为HCl和NaC1的混合溶液,根据题意“将PbO粗品溶解在HCl和NaC1的混合溶液中,得到含Na2PbC14的电解液”可知后加入PbO;
(5)根据电极反应和转移的电子守恒计算。
【解答】解:(1)铅蓄电池放电时,铅元素化合价0价变化为+2价,Pb做负极,铅元素化合价+4价变化为+2价,PbO2做正极,
故答案为:正;
(2)①碳酸铅溶解度小于硫酸铅,根据图l写出过程I的离子方程式为:PbSO4(s)+CO32﹣(aq)=PbCO3(s)+SO42﹣(aq),
故答案为:PbSO4(s)+CO32﹣(aq)=PbCO3(s)+SO42﹣(aq);
②生产过程中的温度应保持在40℃,若温度降低,PbSO4的转化速率下降,反应速率减小的原因是温度降低、硫酸钠和碳酸钠浓度降低,反应速率减小,
故答案为:硫酸钠和碳酸钠浓度降低,反应速率减小;
(3)①过程Ⅱ,发生反应2PbO2+H2C2O4═2PbO+H2O2+2CO2↑.实验中检测到有大量O2放出,推测PbO2氧化了H2O2,通过实验证实了这一推测。实验方案是:取少量PbO2与试管中,向其中滴加H2O2溶液,产生可使带火星木条复燃的气体,同时棕黑色固体变为橙黄色,证实推测正确,
故答案为:取少量PbO2与试管中,向其中滴加H2O2溶液,产生可使带火星木条复燃的气体,同时棕黑色固体变为橙黄色,证实推测正确;
②过氧化氢为共价化合物,氧原子和氧原子、氢原子形成两队共用电子对,过氧化氢的电子式为:![]() ,
,
故答案为:![]() ;
;
(4)电解Na2PbCl4溶液,生成Pb和O2,
①阴极的电极反应是发生还原反应,元素化合价降低,阴极的电极反应式是,PbCl42﹣+2e﹣=Pb+4Cl﹣,
故答案为:PbCl42﹣+2e﹣=Pb+4Cl﹣;
②阴极电解一段时间后溶液为HCl和NaC1的混合溶液,根据题意“将PbO粗品溶解在HCl和NaC1的混合溶液中,得到含Na2PbC14的电解液”可知后加入PbO,
故答案为:继续向阴极区加PbO粗品;
(5)当制得26.88L Cl2时,氯气的物质的量为1.2mol,转移电子的物质的量=1.2mol×2=2.4mol,根据PbO2+Pb+2H2SO4═2PbSO4+2H2O知,当转移电子的物质的量为2.4mol时,消耗硫酸的物质的量2.4mol,则电解后电池中硫酸溶液的浓度为:1.5mol。L﹣1;
故答案为:1.5。
【点评】本题考查了化学工艺流程分析、实验原理分析、离子方程式书写、化学实验方案的设计、物质分离提纯、平衡移动原理的应用、原电池和电解池原理等,涉及实验的基本操作,属综合考查,题目难度中等。
[化学-选修3:物质结构与性质]
11.(15分)硼及其化合物应用广泛。回答下列问题:
(1)基态B原子的价电子轨道表达式为 ![]() ,其第一电离能比Be 小 (填“大”或“小”)。
,其第一电离能比Be 小 (填“大”或“小”)。
(2)氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,提供孤电子对的成键原子是 N原子 ,写出一种与氨硼烷互为等电子体的分子 CH3CH3 (填化学式)。
(3)常温常压下硼酸(H3BO3)晶体结构为层状,其二维平面结构如图a。
①B原子的杂化方式为 sp2 。从氢键的角度解释硼酸在冷水中的溶解度小而加热时溶解度增大: H3BO3分子之间形成氢键,使硼酸缔合成层状大分子,在冷水中与溶解度小,而热水中H3BO3分子之间形成氢键被破坏,H3BO3分子与水分子之间形成大量的氢键 。
②路易斯酸碱理论认为,任何可接受电子对的分子或离子叫路易斯酸,任何可给出电子对的分子或离子叫路易斯碱。从结构角度分析硼酸是路易斯酸: 硼酸分子中B原子有1个2p空轨道 。
(4)立方氮化硼(BN)是特殊的耐磨和切削材料,其晶胞结构与金刚石相似,如图b所示。
①与氮原子直接连接的硼原子构成的几何形状为 正四面体 。硼原子和氮原子所连接的最小环为 六 元环。
②晶胞有两个基本要素:
原子坐标参数,表示晶胞内部各原子的相对位置。如图b所示,其中原子坐标参数X为(0,0,0),Y原子的坐标参数为(,0,),则Z原子的坐标参数为 (,,) 。
晶胞参数,描述晶胞的大小和形状。已知立方氮化硼的密度为d g•cm﹣3,阿伏加德罗常数值为NA,则晶胞参数a= 107 nm.(列出计算式即可)
【考点】8J:位置结构性质的相互关系应用;9I:晶胞的计算.菁优网版权所有
【专题】51C:元素周期律与元素周期表专题;51D:化学键与晶体结构.
【分析】(1)基态B原子价电子排布式为2s22p1,结合泡利原理、洪特规则画出价电子轨道表达式;Be原子元素2s轨道为全充满稳定状态,第一电离能高于同周期相邻元素的;
(2)B原子有空轨道,NH3中N原子有1对孤电子对,与氨硼烷互为等电子体的分子,可以用2个C原子代替B、N原子;
(3)①H3BO3中B原子连接3个羟基,形成3个σ键,没有孤电子对,杂化轨道数目=3+0=3;H3BO3分子之间形成氢键,冷水中与水分子之间形成氢键少,而热水中H3BO3分子之间形成氢键被破坏,H3BO3分子与水分子之间形成大量的氢键;
②分子中B原子有空轨道,可以接受电子对;
(4)①N原子与周围的4个B原子形成正四面体;硼原子和氮原子所连接的最小环有3个B原子、3个N原子;
②由X、Y的参数,可知X处于坐标系原点,x、z轴形成平面为晶胞前平面,x、y轴构成的平面为晶胞下底面,z、y轴构成的平面为晶胞左侧平面,Y处于晶胞的前平面面心位置。Z与周围4个N原子形成正四面体,Z与顶点N原子连线处于晶胞体对角线上,且二者距离为体对角线的,则Z与X的距离为晶胞体对角线长度的,Z到坐标系的3个平面距离均为晶胞棱长的.均摊法计算晶胞中个原子数目,再计算晶胞中各原子总质量,而原子总质量也等于晶体密度与晶胞体积的乘积。
【解答】解:(1)基态B原子价电子排布式为2s22p1,由泡利原理、洪特规则,价电子轨道表达式为![]() ;Be原子元素2s轨道为全充满稳定状态,第一电离能高于同周期相邻元素的,故第一电离能Be>B,
;Be原子元素2s轨道为全充满稳定状态,第一电离能高于同周期相邻元素的,故第一电离能Be>B,
故答案为:![]() ;小;
;小;
(2)B原子有空轨道,NH3中N原子有1对孤电子对,N原子提供孤电子对个B原子形成配位键,与氨硼烷互为等电子体的分子,可以用2个C原子代替B、N原子,与氨硼烷等电子体一种分子为:CH3CH3,
故答案为:N原子;CH3CH3;
(3)①H3BO3中B原子连接3个羟基,形成3个σ键,没有孤电子对,杂化轨道数目=3+0=3,B原子的杂化方式为sp2,H3BO3分子之间形成氢键,使硼酸缔合成层状大分子,在冷水中与溶解度小,而热水中H3BO3分子之间形成氢键被破坏,H3BO3分子与水分子之间形成大量的氢键,故硼酸在冷水中的溶解度小而加热时溶解度增大,
故答案为:sp2;H3BO3分子之间形成氢键,使硼酸缔合成层状大分子,在冷水中与溶解度小,而热水中H3BO3分子之间形成氢键被破坏,H3BO3分子与水分子之间形成大量的氢键;
②硼酸分子中B原子有1个2p空轨道,可以接受电子对,属于路易斯酸,
故答案为:硼酸分子中B原子有1个2p空轨道;
(4)①N原子与周围的4个B原子形成正四面体;硼原子和氮原子所连接的最小环有3个B原子、3个N原子,硼原子和氮原子所连接的最小环为六元环,
故答案为:正四面体;六;
②由X、Y的参数,可知X处于坐标系原点,x、z轴形成平面为晶胞前平面,x、y轴构成的平面为晶胞下底面,z、y轴构成的平面为晶胞左侧平面,Y处于晶胞的前平面面心位置。Z与周围4个N原子形成正四面体,Z与顶点N原子连线处于晶胞体对角线上,且二者距离为体对角线的,则Z与X的距离为晶胞体对角线长度的,Z到坐标系的3个平面距离均为晶胞棱长的.由Y的参数可知晶胞棱长为1,Z到坐标系平面距离均为,故Z的参数为:(,,),
晶胞中B原子数目=4、N原子数目=864,晶胞中原子总质量g=d g•cm﹣3×(a×10﹣7cm)3,解得a107,
故答案为:(,,);107。
【点评】本题考查物质结构与性质,侧重考查学生分析解决问题能力、知识迁移运用能力,注意同周期第一电离能变化异常情况,(4)中原子参数确定为易错点、难点,关键是明确坐标系的距离、B与N原子距离与晶胞棱长的关系,需要学生具备一定的空间想象与数学计算能力。
[化学--选修5:有机化学基础]
12.A和a是生活中常见的两种有机物,可用于制备安眠药苯巴比妥Q,合成过程如下:
已知:
![]()
(1)A的官能团名称为 羧基 。。
(2)A→B的反应类型为 取代反应
(3)D→B的反应方程式为 HOOCCH2COOH+2CH3CH2OHCH3CH2OOCCH2COOCH2CH3+2H2O 。
(4)写出符合下列条件F的同分异构体的结构简式 ![]() 。
。
①遇 Fe3+溶液显紫色②发生银镜反应③苯环上的一溴代物有两种
(5)J 与 ![]() 在催化剂作用下既可以生成 Q,又可以生成 G,写出生成 G 的化学方程式 n
在催化剂作用下既可以生成 Q,又可以生成 G,写出生成 G 的化学方程式 n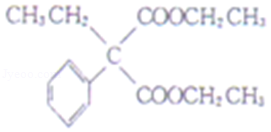 +n
+n![]()
 +2(n﹣1)CH3CH2OH 。
+2(n﹣1)CH3CH2OH 。
(6)下列说法正确的是 cd 。
a.E与M互为同系物
b.B水解酸化后的产物可以发生加聚反应
c.用试剂b制备乙烯的条件是NaOH的醇溶液、加热
d.Q的结构简式是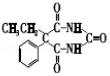
(7)写出以CH2=CH﹣CH=CH2和E位主要原料制备![]() 的流程。(无机试剂自选)
的流程。(无机试剂自选)
【考点】HC:有机物的合成.菁优网版权所有
【专题】534:有机物的化学性质及推断.
【分析】A是生活中常见有机物,根据A分子式知,A为CH3COOH,B发生信息中的反应生成D,根据D结构简式知,B为CH2ClCOOH,D和a在浓硫酸条件下反应生成E,E和溴苯发生取代反应生成I,则E为CH3CH2OOCCH2COOCH2CH3,a为CH3CH2OH,F和乙醇发生酯化反应生成M为![]() ,M和c发生取代反应生成I,c为ClCOOCH2CH3,根据G结构简式知,J为
,M和c发生取代反应生成I,c为ClCOOCH2CH3,根据G结构简式知,J为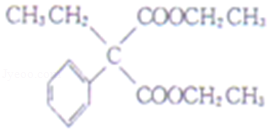 ,Q为
,Q为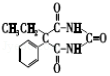 ,则b为CH3CH2Cl;
,则b为CH3CH2Cl;
(7)1,3﹣丁二烯发生加成反应生成1,4﹣二溴﹣2﹣丁烯,1,4﹣二溴﹣2﹣丁烯发生取代反应然后发生加成反应生成![]() 。
。
【解答】解:通过以上分析知,
(1)A为乙酸,A中官能团为羧基,
故答案为:羧基;
(2)A为乙酸、B为CH2ClCOOH,A发生取代反应生成B,则该反应为取代反应,
故答案为:取代反应;
(3)E为CH3CH2OOCCH2COOCH2CH3,a为CH3CH2OH,D为丙二酸,D和乙醇发生酯化反应生成E,
反应方程式为HOOCCH2COOH+2CH3CH2OHCH3CH2OOCCH2COOCH2CH3+2H2O,
故答案为:HOOCCH2COOH+2CH3CH2OHCH3CH2OOCCH2COOCH2CH3+2H2O;
(4)F的同分异构体符合下列条件:
①遇 Fe3+溶液显紫色,说明含有酚羟基;
②发生银镜反应,说明含有醛基,
③苯环上的一溴代物有两种,说明苯环上有2种氢原子,
则符合条件的同分异构体结构简式为![]() ,
,
故答案为:![]() ;
;
(5)生成G的方程式为n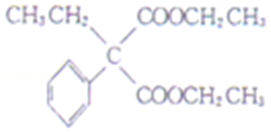 +n
+n![]()
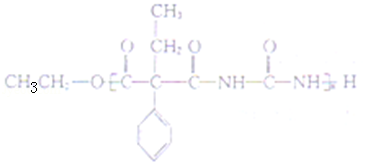 +2(n﹣1)CH3CH2OH,
+2(n﹣1)CH3CH2OH,
故答案为:n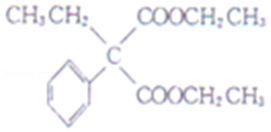 +n
+n![]()
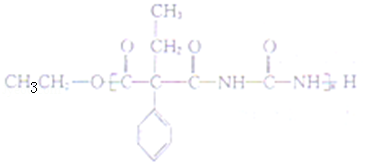 +2(n﹣1)CH3CH2OH;
+2(n﹣1)CH3CH2OH;
(6)a.E为CH3CH2OOCCH2COOCH2CH3,M为![]() ,二者结构不相似,所以E与M互不是同系物,故错误;
,二者结构不相似,所以E与M互不是同系物,故错误;
b.B水解产物为HOCH2COOH,含有醇羟基和羧基,能发生缩聚反应,故错误;
c.b为CH3CH2Cl,b发生消去反应生成乙烯,需要的条件是氢氧化钠醇溶液、加热,故正确;
d.Q的结构简式是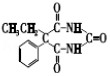 ,故正确;
,故正确;
故选cd;
(7)1,3﹣丁二烯发生加成反应生成1,4﹣二溴﹣2﹣丁烯,1,4﹣二溴﹣2﹣丁烯发生取代反应然后发生加成反应生成![]() ,合成路线为CH2=CHCH=CH2BrCH2CH=CHCH2Br
,合成路线为CH2=CHCH=CH2BrCH2CH=CHCH2Br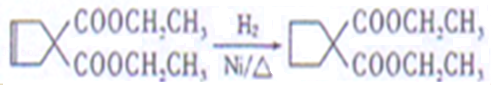 ,
,
故答案为:CH2=CHCH=CH2BrCH2CH=CHCH2Br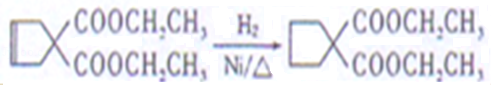 。
。
【点评】本题考查有机物推断和合成,侧重考查推断及知识综合运用能力,根据某些物质结构简式、反应条件结合题给信息进行推断,难点是QJ结构简式确定及合成路线设计,题目难度中等。
声明:试题解析著作权属菁优网所有,未经书面同意,不得复制发布
日期:2019/4/12 21:45:40;用户:tp;邮箱:lsgjgz137@xyh.com;学号:21474120