
湖南省醴陵二中、醴陵四中2016-2017学年高二下学期期中联考化学试卷
03月05日
2019年湖南师大附中高考化学模拟试卷(一)
一、选择题(共7小题,每小题3分,满分21分)
1.(3分)化学与生活,社会发展息息相关、下列有关说法不正确的是( )
A.“霾尘积聚难见路人”。雾霾所形成的气溶胶有丁达尔效应
B.“曾青(硫酸铜)涂铁,铁赤色如铜”过程中发生了置换反应
C.为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅胶
D.医用酒精体积分数是75%,用医用酒精菌消毒是使细菌、病毒蛋白质变性后死亡
2.(3分)NA表示阿伏加德罗常数的数值,下列说法正确的是( )
A.在标准状况下.11.2L丙烷含有的极性键数目为5NA
B.7g锂在空气中完全燃烧时转移的电子数为NA
C.1mol葡萄糖(C6H12O6)分子含有的羟基数目为6NA
D.常温下,0.2L0.5mol/LNH4NO3溶液中含有的氮原子数小于0.2NA
3.(3分)工业酸性废水中的Cr2O72﹣可转化为Cr3+除去,实验室用电解法模拟该过程,结果如下表所示(实验开始时溶液的体积均为50mL,Cr2O72﹣的起始浓度、电压、电解时间均相同)。下列说法中,不正确的是( )
| 实验 | ① | ② | ③ |
| 电解条件 | 阴、阳极均 为石墨 | 阴、阳极均为石墨,滴 加1mL浓硫酸 | 阴极为石墨,阳极为铁, 滴加1mL浓硫酸 |
| Cr2O72﹣的去除率/% | 0.922 | 12.7 | 57.3 |
A.对比实验①②可知,降低pH可以提高Cr2O72﹣的去除率
B.实验③中,理论上电路中每通过6mol电子,就有1molCr2O72﹣被还原
C.实验②中,Cr2O72﹣在阴极放电的电极反应式是Cr2O72﹣+6e﹣+14H+=2Cr3++7H2O
D.实验③中,C2O72﹣去除率提高的原因是Cr2O72﹣+6Fe2++14H+=2Cr3++6Fe3++7H2O
4.(3分)根据下列实验操作和现象所得到的结论正确的是( )
| 选项 | 实验操作和现象 | 实验结论 |
| A | 向苯酚浊液中加入Na2CO3溶液,溶液变澄清 | 酸性:苯酚>HCO3﹣ |
| B | 将少量Fe(NO3)2加水溶解后,滴加稀硫酸酸化,再滴加KSCN溶液,溶液变成血红色 | Fe(NO3)2已变质 |
| C | 氯乙烷与NaOH溶液共热后,滴加AgNO3溶液,生成白色沉淀 | 氯乙烷发生水解 |
| D | 在2mL 0.01mol•L﹣1的Na2S溶液中先滴入几滴0.01mol•L﹣1ZnSO4溶液有白色沉淀生成,再滴入0.01mol•L﹣1CuSO4溶液,又出现黑色沉淀 | Ksp(CuS)<Ksp(ZnS) |
A.AB.BC.CD.D
5.(3分)体育竞技中服用兴奋剂既有失公平,也败坏了体育道德。某种兴奋剂的结构简式如图所示。有关该物质的说法中正确的是( )
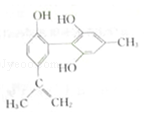
A.该物质与苯酚属于同系物,遇FeCl3溶液呈紫色
B.滴入酸性KMnO4溶液振荡,紫色褪去,能证明其结构中存在碳碳双键
C.该分子中的所有碳原子可能共平面
D.1mol该物质分别与浓溴水和H2反应时最多消耗Br2和H2分别为1mol和7mol
6.(3分)短周期主族元素A、B、C、D的原子序数依次增大。已知A、C的原子序数之差为8,A、B、C三种元素原子的最外层电子数之和为15,B元素原子的最外层电子数等于A元素原子的最外层电子数的一半,下列叙述正确的是( )
A.简单离子的半径:B>C>D>A
B.B与C形成的化合物在水溶液中能稳定存在
C.C与D都可形成具有漂白性的化合物,且漂白原理相同
D.B与D形成的化合物溶于水所得溶液显酸性
7.(3分)下列图示与对应的叙述相符的是( )
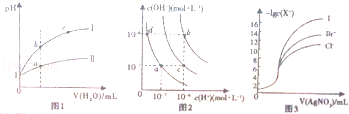
A.图1表示相同温度下pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强
B.图2中纯水仅升高温度,就可以从a点变到c点
C.图2中在b点对应温度下,将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,溶液显中性
D.用0.0100mol/L硝酸银标准溶液,滴定Cl﹣、Br﹣及I﹣且浓度均为0.1000mol/L的混合溶液,由图3曲线,可确定首先沉淀的是Cl﹣
二、填空题(共5小题,每小题15分,满分79分)
8.(15分)亚硝酰氯(ClNO)是有机物合成中的重要试剂,红褐色液体或黄色气体,具有刺鼻恶臭味,遇水反应生成一种氢化物和两种氧化物。某学习小组在实验室用Cl2和NO制备ClNO并测定其纯度,相关实验(夹持装置略去) 如图1.请回答:
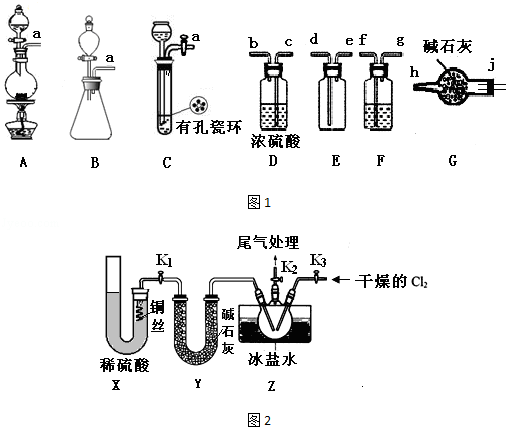
(1)制备Cl2发生装置可以 (填大写字母),反应的离子方程式为 。
(2)欲收集一瓶干燥的氯气,选择装置,其连接顺序为:a→ (按气流方向,用小写字母表示),若用到F,其盛装药品为 。
(3)实验室可用图2装置制备亚硝酰氯(ClNO);
①实验室也可用B装置制备NO,X装置的优点为 。
②检验装置气密性并装入药品,打开k2,然后再打开 (填“k1”“或“k3”),通入一段时间气体,(其目的为 ),然后进行其它操作,当Z有一定量液体生成时,停止实验。
③若无装置Y,则Z中ClNO可能发生反应的化学方程式为 。
(4)取Z中所得液体m g溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用c mol•L﹣1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为22.50mL.(已知:Ag2CrO4为砖红色固体;Ksp(AgCl)=1.56×10﹣10,Ksp(Ag2CrO4)=1×10﹣12),则亚硝酰氯(ClNO)的质量分数为 (用代数式表示)。
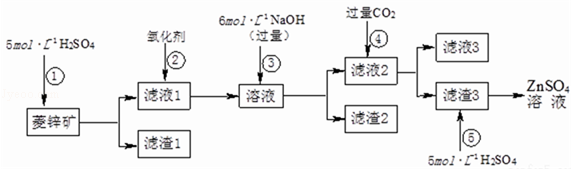
9.(15分)锌钡白是一种白色颜料,工业上由ZnSO4与BaS溶液混合而成,BaS+ZnSO4=ZnS↓+BaSO4↓.请根据以下工业生产流程回答有关问题。
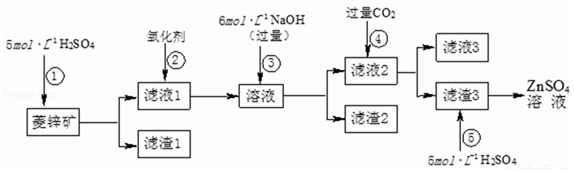
Ⅰ.ZnSO4溶液的制备与提纯:
有关资料:
a.菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等;
b.Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2;
(1)为了达到综合利用、节能减排的目的,上述流程步骤④中的CO2可以来自于步骤 (选填①、②、③或⑤)。
(2)若步骤中加入的氧化剂为H2O2,写出反应的离子方程式 。
(3)滤渣2中主要成分为 (填化学式)。
(4)写出步骤④后产生滤渣3的反应的离子方程式 。
(5)滤液3中含碳粒子的浓度大小顺序为 。
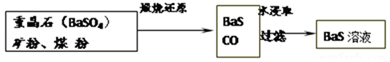
Ⅱ.BaS溶液的制备
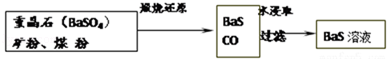
(6)写出“煅烧还原”反应的化学方程式 。BaSO4和BaCO3的Ksp数值接近,用平衡原理解释为什么BaCO3可溶于盐酸,而BaSO4难溶: 。
Ⅲ.制取锌钡白
(7)如果上述工业生产流程中步骤⑤硫酸过量,则ZnSO4与BaS溶液混合制取锌银白产生的后果是 。
10.(16分)硫化氢(H2S)的转化是资源利用和环境保护的重要研究课题。
(1)H2S和CO混合加热可制得频基硫(COS),羰基疏可作粮食熏蒸剂,能防止其些昆虫、线虫和真菌的危害。反应方程式为CO(g)+H2S(g)=COS(g)+H2(g)。
①羰基硫的电子式为 。
②下列能说明碳与硫两元素非金属性相对强弱的是 (填字母代号)。
a.相同条件下水溶液的pH:Na2CO3>Na2SO4
b.酸性:H2SO3>H2CO3
c.S与H2的化合比C与H2的化合更容易
(2)H2S具有还原性,在酸性条件下,能与KMnO4反应生成S、MnSO4、K2SO4和H2O,写出该反应的化学方程式 。
(3)H2S气体溶于水形成的氢硫酸是一种二元弱酸,25℃时,在0.10mol•L﹣1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2﹣)关系如图所示(忽略溶液体积的变化、H2S的挥发)。
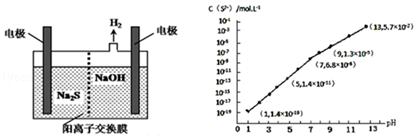
①pH=13时,溶液中的c(H2S)+c(HS﹣)= mol•L﹣1。
②某溶液含0.020mol•L﹣1Mn2+、0.10mol•L﹣1H2S,当溶液pH= 时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10﹣13]。
(4)H2S的废气可用烧碱溶液吸收,将烧碱吸收H2S后的溶液加入到如图所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应:S2﹣﹣2e﹣=S↓ (n﹣1)S+S2﹣⇌Sn2﹣写出电解时阴极的电极反应式: 。
(5)一定温度下将NH4HS固体放入定容真空密闭容器中,可部分分解为硫化氢和氨气:
NH4HS(s)⇌H2S(g)+NH3(g)。
①可以判断上述分解反应已经达到化学平衡状态的是 (填字母代号)
A.v(H2S)=v(NH3) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
②当上述反应达平衡时:p(NH3)×p(H2S)=a(Pa2),则平衡时容器中的总压为 Pa( 用含a 的代数式表示)。[p(NH3)、p(H2S)分别代表NH3、H2S的压强,Pa为压强的单位]
11.(15分)现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素同期表的前四周期,B的基态原子含有3个能级。且每个能级所含的电子数相同。D的原干核外有8个运动状态不同的电子;E与F处干同一周期相邻的族,它们的原子序数相差3,且E的基态原子有4个未成对电子。
请回答下列问题:
(1)请写出:D基资原子的价层电子排布图 ;F基态原子的价层电子排布式:
(2)下列说法错误的是 。
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点:SiO2>CO2
B.电负性顺序:B<C<D
C.N2与CO为等电子体,结构相似
D.稳定性:H2O>H2S,水分子更稳定的原因是水分子间存在氢键
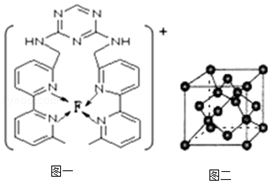
(3)F离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点。向F的硫酸盐溶液中通入过量的C与A形成的气体X可生成[F(X)4]2+,该离子的结构式为 (用元素符号表示)。
(4)某化合物与F(Ⅰ)(Ⅰ表示化合价为+1)结合形成图1所示的离子,该离子中碳原子的杂化方式有 。
(5)B单质的一种同素异形体的晶胞如图2所示,则一个晶胞中所含B原子数为 。
(6)D与F形成离子个数比为1:1的化合物,晶胞与NaCl类似,设D离子的半径为a pm,F离子的半径b pm,求该晶胞的空间利用率 。
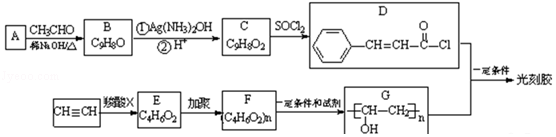
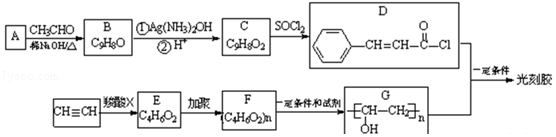
12.(18分)光刻胶是一种应用广泛的光敏材料,其合成路线如下(部分试剂、反应条件和产物已略去):
已知:
Ⅰ.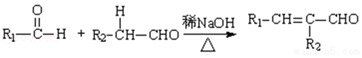 (R,R′为烃基或氢)
(R,R′为烃基或氢)
Ⅱ.![]() (R,R′为烃基)
(R,R′为烃基)
(1)写出A的结构简式 。
(2)B分子中所含官能团的名称为 。
(3)乙炔和羧酸X加成生成E,E的核磁共振氢谱为三组峰,且峰面积比为3:2:1,E能发生水解反应,则EF的化学方程式为 。
(4)由F到G的反应类型为 。
(5)D和G反应生成光刻胶的化学方程式为 。
(6)C的一种同分异构体满足下列条件:
①能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应
②苯环上的一氯取代产物只有两种。写出该同分异构体的结构简式: 。
(7)根据已有知识并结合相关信息,写出以CH3CHO为原料制备CH3COCOCOOH的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
CH3CH2BrCH3CH2OHCH3COOCH2CH3
2019年湖南师大附中高考化学模拟试卷(一)
参考答案与试题解析
一、选择题(共7小题,每小题3分,满分21分)
1.(3分)化学与生活,社会发展息息相关、下列有关说法不正确的是( )
A.“霾尘积聚难见路人”。雾霾所形成的气溶胶有丁达尔效应
B.“曾青(硫酸铜)涂铁,铁赤色如铜”过程中发生了置换反应
C.为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅胶
D.医用酒精体积分数是75%,用医用酒精菌消毒是使细菌、病毒蛋白质变性后死亡
【考点】14:物质的组成、结构和性质的关系.菁优网版权所有
【专题】56:化学应用.
【分析】A.烟云雾属于气溶胶;
B.铁赤色如铜,说明生成铜;
C.生石灰硅胶具有吸水性,不具有还原性;
D.酒精能够使蛋白质变性。
【解答】解:A.烟云雾属于气溶胶,胶体都具有丁达尔效应,故A正确;
B.铁赤色如铜,说明生成铜,为置换反应,故B正确;
C.为防止中秋月饼等富脂食品因被氧化而变质,应加入还原性物质,生石灰硅胶具有吸水性,不具有还原性,可以用于食品干燥,故C错误;
D.酒精能够使蛋白质变性,所以可以用酒精杀菌消毒,医用酒精体积分数是75%,故D正确;
故选:C。
【点评】本题考了常见有机物的结构和性质,熟悉相关物质的性质是解题关键,题目难度不大。
2.(3分)NA表示阿伏加德罗常数的数值,下列说法正确的是( )
A.在标准状况下.11.2L丙烷含有的极性键数目为5NA
B.7g锂在空气中完全燃烧时转移的电子数为NA
C.1mol葡萄糖(C6H12O6)分子含有的羟基数目为6NA
D.常温下,0.2L0.5mol/LNH4NO3溶液中含有的氮原子数小于0.2NA
【考点】4F:阿伏加德罗常数.菁优网版权所有
【专题】518:阿伏加德罗常数和阿伏加德罗定律.
【分析】A.丙烷分子中含有8个碳氢极性键;
B.锂燃烧生成氧化锂,1mol锂失去1mol电子;
C.1个葡萄糖含有5个羟基;
D.求出NH4NO3的物质的量,然后根据1mol硝酸铵中含2mol氮原子来分析。
【解答】解:A.在标准状况下.11.2L丙烷物质的量为0.5mol,含有的极性键数目为4NA,故A错误;
B.7g锂物质的量为:0.5mol,在空气中完全燃烧时转移的电子数为NA,故B正确;
C.1个葡萄糖含有5个羟基,1mol葡萄糖(C6H12O6)分子含有的羟基数目为5NA,故C错误;
D.溶液中NH4NO3的物质的量n=CV=0.5mol/L×0.2L=0.1mol,而1mol硝酸铵中含2mol氮原子,故0.1mol硝酸铵中含0.2mol氮原子即0.2NA个,故D错误;
故选:B。
【点评】本题考查阿伏加德罗常数的计算与判断,题目难度中等,注意掌握以物质的量为中心的各化学量与阿伏加德罗常数的关系,试题有利于提高学生灵活运用基础知识解决实际问题的能力。
3.(3分)工业酸性废水中的Cr2O72﹣可转化为Cr3+除去,实验室用电解法模拟该过程,结果如下表所示(实验开始时溶液的体积均为50mL,Cr2O72﹣的起始浓度、电压、电解时间均相同)。下列说法中,不正确的是( )
| 实验 | ① | ② | ③ |
| 电解条件 | 阴、阳极均 为石墨 | 阴、阳极均为石墨,滴 加1mL浓硫酸 | 阴极为石墨,阳极为铁, 滴加1mL浓硫酸 |
| Cr2O72﹣的去除率/% | 0.922 | 12.7 | 57.3 |
A.对比实验①②可知,降低pH可以提高Cr2O72﹣的去除率
B.实验③中,理论上电路中每通过6mol电子,就有1molCr2O72﹣被还原
C.实验②中,Cr2O72﹣在阴极放电的电极反应式是Cr2O72﹣+6e﹣+14H+=2Cr3++7H2O
D.实验③中,C2O72﹣去除率提高的原因是Cr2O72﹣+6Fe2++14H+=2Cr3++6Fe3++7H2O
【考点】DI:电解原理.菁优网版权所有
【专题】51I:电化学专题.
【分析】A.对比实验①②,这两个实验中只有溶液酸性强弱不同,其它外界因素都相同,且溶液的pH越小,Cr2O72﹣的去除率越大;
B.实验③中,Cr2O72﹣在阴极上得电子,且溶液中的亚铁离子也能还原Cr2O72﹣;
C.实验②中,Cr2O72﹣在阴极上得电子发生还原反应;
D.实验③中,Cr2O72﹣在阴极上得电子,且溶液中的亚铁离子也能还原Cr2O72﹣。
【解答】解:A.对比实验①②,这两个实验中只有溶液酸性强弱不同,其它外界因素都相同,且溶液的pH越小,Cr2O72﹣的去除率越大,所以降低pH可以提高Cr2O72﹣的去除率,故A正确;
B.实验③中,Cr2O72﹣在阴极上得电子,且溶液中的亚铁离子也能还原Cr2O72﹣,理论上电路中每通过6 mol电子,则有1 mol Cr2O72﹣在阴极上被还原,且溶液中还有0.5molCr2O72﹣被Fe2+还原,所以一共有1.5mol Cr2O72﹣被还原,故B错误;
C.实验②中,Cr2O72﹣在阴极上得电子发生还原反应,电极反应式为Cr2O72﹣+6e﹣+14H+═2Cr3++7H2O,故C正确;
D.实验③中,Cr2O72﹣在阴极上得电子,且溶液中的亚铁离子也能还原Cr2O72﹣,离子方程式为Cr2O72﹣+6Fe2++14H+═2Cr3++6Fe3++7H2O,所以导致Cr2O72﹣去除率提高,故D正确;
故选:B。
【点评】本题考查电解原理,为高频考点,明确离子放电顺序及电解原理是解本题关键,注意:活泼金属作阳极时,阳极上金属失电子而不是溶液中阴离子失电子,易错选项是B。
4.(3分)根据下列实验操作和现象所得到的结论正确的是( )
| 选项 | 实验操作和现象 | 实验结论 |
| A | 向苯酚浊液中加入Na2CO3溶液,溶液变澄清 | 酸性:苯酚>HCO3﹣ |
| B | 将少量Fe(NO3)2加水溶解后,滴加稀硫酸酸化,再滴加KSCN溶液,溶液变成血红色 | Fe(NO3)2已变质 |
| C | 氯乙烷与NaOH溶液共热后,滴加AgNO3溶液,生成白色沉淀 | 氯乙烷发生水解 |
| D | 在2mL 0.01mol•L﹣1的Na2S溶液中先滴入几滴0.01mol•L﹣1ZnSO4溶液有白色沉淀生成,再滴入0.01mol•L﹣1CuSO4溶液,又出现黑色沉淀 | Ksp(CuS)<Ksp(ZnS) |
A.AB.BC.CD.D
【考点】U5:化学实验方案的评价.菁优网版权所有
【专题】25:实验评价题.
【分析】A.苯酚浊液中加入Na2CO3溶液,生成苯酚钠、碳酸氢钠;
B.滴加稀硫酸酸化,亚铁离子、硝酸根离子发生氧化还原反应生成铁离子;
C.氯乙烷与NaOH溶液共热后,发生水解反应,在酸性条件下检验氯离子;
D.先滴入几滴0.01mol•L﹣1ZnSO4溶液有白色沉淀生成,再滴入0.01mol•L﹣1CuSO4溶液,又出现黑色沉淀,Na2S溶液过量,均为沉淀的生成。
【解答】解:A.苯酚浊液中加入Na2CO3溶液,生成苯酚钠、碳酸氢钠,则酸性:苯酚>HCO3﹣,故A正确;
B.滴加稀硫酸酸化,亚铁离子、硝酸根离子发生氧化还原反应生成铁离子,不能检验是否变质,检验是否变质时不能加酸酸化,故B错误;
C.氯乙烷与NaOH溶液共热后,发生水解反应,在酸性条件下检验氯离子,没有加硝酸至酸性,再加硝酸银,不能检验,故C错误;
D.先滴入几滴0.01mol•L﹣1ZnSO4溶液有白色沉淀生成,再滴入0.01mol•L﹣1CuSO4溶液,又出现黑色沉淀,Na2S溶液过量,均为沉淀的生成,不能比较Ksp(CuS)、Ksp(ZnS)的大小,故D错误;
故选:A。
【点评】本题考查化学实验方案的评价,为高频考点,把握酸性比较、氧化还原反应、离子检验、沉淀生成、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大。
5.(3分)体育竞技中服用兴奋剂既有失公平,也败坏了体育道德。某种兴奋剂的结构简式如图所示。有关该物质的说法中正确的是( )
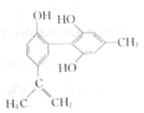
A.该物质与苯酚属于同系物,遇FeCl3溶液呈紫色
B.滴入酸性KMnO4溶液振荡,紫色褪去,能证明其结构中存在碳碳双键
C.该分子中的所有碳原子可能共平面
D.1mol该物质分别与浓溴水和H2反应时最多消耗Br2和H2分别为1mol和7mol
【考点】HD:有机物的结构和性质.菁优网版权所有
【专题】534:有机物的化学性质及推断.
【分析】A.苯酚的同系物含1个苯环,1个酚﹣OH,该物质含2个苯环、3个酚﹣OH;
B.酚﹣OH、碳碳双键均能被高锰酸钾氧化;
C.苯环、双键为平面结构,且直接相连;
D.酚﹣OH的邻对位与溴水发生取代反应,碳碳双键与溴水发生加成反应,苯环、双键均与氢气发生加成反应。
【解答】解:A.苯酚的同系物含1个苯环,1个酚﹣OH,该物质含2个苯环、3个酚﹣OH,结构不相似,不是苯酚同系物,含酚﹣OH,遇FeCl3溶液呈紫色,故A错误;
B.酚﹣OH、碳碳双键均能被高锰酸钾氧化,则紫色褪去,不能证明其结构中存在碳碳双键,故B错误;
C.苯环、双键为平面结构,且直接相连,则所有碳原子可能共平面,故C正确;
D.酚﹣OH的邻对位与溴水发生取代反应,碳碳双键与溴水发生加成反应,苯环、双键均与氢气发生加成反应,则1mol该物质分别与浓溴水和H2反应时最多消耗Br2和H2分别为4mol和7mol,故D错误;
故选:C。
【点评】本题考查有机物的结构与性质,为高频考点,把握有机物的官能团与性质、有机反应为解答的关键,侧重分析与应用能力的考查,熟练掌握常见有机物的性质,选项C为解答的难点,题目难度不大。
6.(3分)短周期主族元素A、B、C、D的原子序数依次增大。已知A、C的原子序数之差为8,A、B、C三种元素原子的最外层电子数之和为15,B元素原子的最外层电子数等于A元素原子的最外层电子数的一半,下列叙述正确的是( )
A.简单离子的半径:B>C>D>A
B.B与C形成的化合物在水溶液中能稳定存在
C.C与D都可形成具有漂白性的化合物,且漂白原理相同
D.B与D形成的化合物溶于水所得溶液显酸性
【考点】8F:原子结构与元素周期律的关系.菁优网版权所有
【专题】51C:元素周期律与元素周期表专题.
【分析】短周期主族元素A、B、C、D的原子序数依次增大,A、C的原子序数的差为8,说明A、C同主族,结合A、B、C 三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半,令B的最外层电子数为x,则x+2x+2x=15,解得x=3,再根据短周期元素A、B、C、D,原子序数依次递增,则A为氧元素,B为铝元素,C为硫元素,D为氯元素,以此解答该题。
【解答】解:A.A为氧元素,B为铝元素,离子核外电子排布相同,核电荷数越大,离子半径越小,所以离子半径A>B,故A错误;
B.B为铝元素,C为硫元素,二者形成的化合物在水溶液中易发生水解反应,故B错误;
C.C与D形成的具有漂白性的化合物分别为二氧化硫和次氯酸,二氧化硫可与有色物质发生化合反应生成不稳定的无色物质,次氯酸具有强氧化性,漂白原理不同,故C错误;
D.B为铝元素、D为氯元素,二者形成的化合物是氯化铝,氯化铝是强酸弱碱盐,铝离子水解溶液呈酸性,故D正确。
故选:D。
【点评】本题考查学生利用原子的结构和位置来推断元素,为高频考点,侧重于学生的分析能力的考查,明确半径、金属性非金属性、最高价氧化物对应水化物的酸性的比较规律,难度不大。
7.(3分)下列图示与对应的叙述相符的是( )
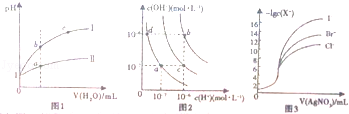
A.图1表示相同温度下pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强
B.图2中纯水仅升高温度,就可以从a点变到c点
C.图2中在b点对应温度下,将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,溶液显中性
D.用0.0100mol/L硝酸银标准溶液,滴定Cl﹣、Br﹣及I﹣且浓度均为0.1000mol/L的混合溶液,由图3曲线,可确定首先沉淀的是Cl﹣
【考点】D5:弱电解质在水溶液中的电离平衡;D6:水的电离;DH:难溶电解质的溶解平衡及沉淀转化的本质.菁优网版权所有
【专题】13:图像图表题.
【分析】A、醋酸是弱电解质,在水溶液里存在电离平衡,加水稀释促进醋酸电离,溶液的导电性与溶液中离子浓度成正比;
B、仅升温促进水的电离,氢离子浓度和氢氧根离子浓度增大,氢离子浓度和氢氧根离子浓度相同;
C、b点Kw=10﹣12,中性溶液pH=6;
D、根据﹣lgc(x﹣)越大,c(x﹣)越小,先形成沉淀的c(x﹣)越小.
【解答】解:A、醋酸是弱电解质,在水溶液里存在电离平衡,加水稀释促进醋酸电离,氯化氢是强电解质,完全电离,导致稀释过程中,醋酸中氢离子浓度大于盐酸,所以pH变化小的为醋酸,即II为醋酸,溶液的导电性与溶液中离子浓度成正比,a点导电能力大于b,故A错误;
B、仅升温促进水的电离,氢离子浓度和氢氧根离子浓度均增大,且氢离子浓度和氢氧根离子浓度相同,与图象不相符合,故B错误;
C、b点Kw=10﹣12,中性溶液PH=6;将pH=2的硫酸与pH=10的NaOH溶液等体积混合后,氢离子浓度和氢氧根离子浓度相同,等体积混合溶液呈中性,故C正确;
D、由图可知,c(I﹣)最小,先形成沉淀的是I﹣,故D错误;
故选:C。
【点评】本题涉及知识点较多,这些知识点都是学习的难点,也是考试热点,根据弱电解质溶液中的电离平衡、盐的水解等知识来分析解答,题目难度中等.
二、填空题(共5小题,每小题15分,满分79分)
8.(15分)亚硝酰氯(ClNO)是有机物合成中的重要试剂,红褐色液体或黄色气体,具有刺鼻恶臭味,遇水反应生成一种氢化物和两种氧化物。某学习小组在实验室用Cl2和NO制备ClNO并测定其纯度,相关实验(夹持装置略去) 如图1.请回答:
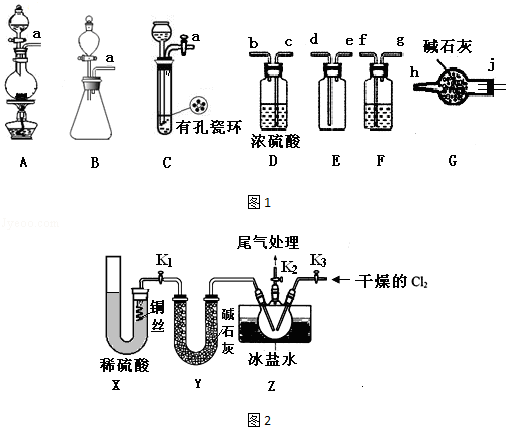
(1)制备Cl2发生装置可以 A(或B) (填大写字母),反应的离子方程式为 MnO2+4H++2Cl﹣Mn2++Cl2↑+2H2O(或2MnO4﹣+16H++10Cl﹣=2Mn2++5Cl2↑+8H2O) 。
(2)欲收集一瓶干燥的氯气,选择装置,其连接顺序为:a→ f→g→c→b→d→e→j→h (按气流方向,用小写字母表示),若用到F,其盛装药品为 饱和食盐水 。
(3)实验室可用图2装置制备亚硝酰氯(ClNO);
①实验室也可用B装置制备NO,X装置的优点为 排除装置内空气的干扰;可以随开随用,随关随停 。
②检验装置气密性并装入药品,打开k2,然后再打开 K3 (填“k1”“或“k3”),通入一段时间气体,(其目的为 排尽三颈烧瓶中的空气,防止NO和ClNO变质 ),然后进行其它操作,当Z有一定量液体生成时,停止实验。
③若无装置Y,则Z中ClNO可能发生反应的化学方程式为 2ClNO+H2O=2HCl+NO↑+NO2↑ 。
(4)取Z中所得液体m g溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用c mol•L﹣1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为22.50mL.(已知:Ag2CrO4为砖红色固体;Ksp(AgCl)=1.56×10﹣10,Ksp(Ag2CrO4)=1×10﹣12),则亚硝酰氯(ClNO)的质量分数为 100% (用代数式表示)。
【考点】U3:制备实验方案的设计.菁优网版权所有
【专题】546:无机实验综合.
【分析】(1)可用二氧化锰与浓盐酸加热制备Cl2,应选用装置A,也可以用高锰酸钾固体与浓盐酸反应,需要装置B,据此写出反应的离子方程式;
(2)制得的氯气中往往含有氯化氢和水蒸气,需要用饱和食盐水除去氯化氢,再用浓硫酸干燥,然后根据氯气的密度大于空气选用向上排空气法收集,氯气有毒,需要尾气处理,可用碱石灰吸收,据此分析装置连接顺序;
(3)①与之相比X装置,无需排除发生装置内空气的干扰,可以随开随用,随关随停;
②先打开K2,通入一段时间气体,排尽三颈烧瓶中的空气,防止NO、ClNO 变质,然后再打开K3;
③若无装置Y,Z中亚硝酰氯与水反应生成氯化氢、NO和二氧化氮,据此书写该反应的化学方程式;
(4)取Z中所得液体m g溶于水,配制成250mL溶液,取出的25.00mL中满足:n(NOCl)=n(Cl﹣)=n(Ag+)=c×0.0225L=0.0225cmol,则250mL溶液中,n(NOCl)=0.0225cmol0.225cmol,然后结合m=nM计算亚硝酰氯(ClNO)的质量分数。
【解答】解:(1)可用二氧化锰与浓盐酸加热制备Cl2,需要选用装置A,发生反应为:MnO2+4H++2Cl﹣Mn2++Cl2↑+2H2O,也可以用高锰酸钾固体与浓盐酸反应,需要装置B,发生反应为:2MnO4﹣+16H++10Cl﹣=2Mn2++5Cl2↑+8H2O,
故答案为:A(或B); MnO2+4H++2Cl﹣Mn2++Cl2↑+2H2O(或2MnO4﹣+16H++10Cl﹣=2Mn2++5Cl2↑+8H2O)
(2)制得的氯气中往往含有氯化氢和水蒸气,需要用饱和食盐水除去氯化氢,再用浓硫酸干燥,然后根据氯气的密度大于空气选用向上排空气法收集,氯气有毒,需要尾气处理,可用碱石灰吸收,则装置连接顺序为:a→f→g→c→b→d→e→j→h;F装置中盛放饱和食盐水,用于除去氯气中的HCl,
故答案为:f→g→c→b→d→e→j→h;饱和食盐水;
(3)①实验室也可用B装置制备NO,与之相比X 装置无需排除发生装置内空气的干扰,可以随开随用,随关随停,
故答案为:无需排除装置内空气的干扰;可以随开随用,随关随停;
②检验装置气密性并装入药品,打开K2、通入一段时间气体,排尽三颈烧瓶中的空气,防止NO、ClNO 变质,再打开K3,
故答案为:K3;排尽三颈烧瓶中的空气,防止NO和ClNO变质;
③若无装置Y,Z中亚硝酰氯与水反应,该反应的化学方程式为:2ClNO+H2O=2HCl+NO↑+NO2↑,
故答案为:2ClNO+H2O=2HCl+NO↑+NO2↑;
(4)取Z中所得液体m g溶于水,配制成250mL溶液,取出的25.00mL中满足:n(NOCl)=n(Cl﹣)=n(Ag+)=c×0.0225L=0.0225cmol,则250mL溶液中,n(NOCl)=0.0225cmol0.225cmol,
所以亚硝酰氯(ClNO)的质量分数为:100%100%,
故答案为:100%。
【点评】本题考查制备方案的设计,题目难度中等,明确“要达到实验目的→应该怎么做→要注意什么”的解题思路为解答关键,注意掌握化学实验基本操作方法,试题培养了学生的分析、理解能力及化学计算、化学实验能力。
9.(15分)锌钡白是一种白色颜料,工业上由ZnSO4与BaS溶液混合而成,BaS+ZnSO4=ZnS↓+BaSO4↓.请根据以下工业生产流程回答有关问题。
Ⅰ.ZnSO4溶液的制备与提纯:
有关资料:
a.菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等;
b.Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2;
(1)为了达到综合利用、节能减排的目的,上述流程步骤④中的CO2可以来自于步骤 ① (选填①、②、③或⑤)。
(2)若步骤中加入的氧化剂为H2O2,写出反应的离子方程式 2Fe2++2H++H2O2=2Fe3++2H2O 。
(3)滤渣2中主要成分为 Fe(OH)3、Cu(OH)2 (填化学式)。
(4)写出步骤④后产生滤渣3的反应的离子方程式 ZnO22﹣+2CO2+2H2O=Zn(OH)2↓+2HCO3﹣ 。
(5)滤液3中含碳粒子的浓度大小顺序为 HCO3﹣>H2CO3>CO32﹣ 。
Ⅱ.BaS溶液的制备
(6)写出“煅烧还原”反应的化学方程式 BaSO4(s)+4C(s)BaS(s)+4CO(g) 。BaSO4和BaCO3的Ksp数值接近,用平衡原理解释为什么BaCO3可溶于盐酸,而BaSO4难溶: BaCO3溶解生成的CO32﹣能被H+结合而减少,促使溶解平衡正向移动,而SO42﹣不会被H+结合,所以BaSO4不会溶于强酸中 。
Ⅲ.制取锌钡白
(7)如果上述工业生产流程中步骤⑤硫酸过量,则ZnSO4与BaS溶液混合制取锌银白产生的后果是 过量的酸与BaS溶液混合会产生有毒的H2S污染空气,而且会降低锌钡白的产率 。
【考点】U3:制备实验方案的设计.菁优网版权所有
【专题】546:无机实验综合.
【分析】由图或者流程可知,菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等,加硫酸,只有SiO2不反应,经过过滤进行分离,则滤渣1为SiO2,滤液1含有硫酸铜、硫酸亚铁、硫酸锌、剩余的硫酸,②加氧化剂将亚铁离子氧化为铁离子,再加过量的NaOH,Zn2+转化ZnO22﹣,使Cu2+、Fe3+转化为沉淀,通过过滤从溶液中除去,则滤渣2为Fe(OH)3、Cu(OH)2,滤液2中含有Na2ZnO2及过量的NaOH,④通二氧化碳将ZnO22﹣转化为沉淀,则滤渣3为Zn(OH)2,步骤⑤主要发生氢氧化锌与硫酸的反应,滤液3含有碳酸氢钠;
(1)上述各步骤中,只有步骤①中有二氧化碳生成;
(2)过氧化氢在酸性条件下将亚铁离子氧化成铁离子,根据得失电子守恒书写离子反应方程式;
(3)滤渣2为氢氧化铁和氢氧化铜,由此书写由化学式;
(4)④通二氧化碳将ZnO22﹣转化为沉淀,则滤渣3为Zn(OH)2,由此书写离子反应方程式;
(5)滤液3中含碳粒子是碳酸氢钠溶液,碳酸氢钠溶液呈碱性,水解程度大于电离程度,由此判断离子浓度的大小;
(6)煅烧发生反应:BaSO4+4CBaS+4CO↑,BaCO3溶解生成的CO32﹣能被H+结合而减少,促使溶解平衡正向移动,而SO42﹣不会被H+结合,所以BaSO4不会溶于强酸中,由此分析解答;
(7)步骤⑤中硫酸过量,过量的酸与BaS溶液混合会发生反应,产生有毒的H2S污染空气,而且会降低锌钡白的产率。
【解答】解:I.由图或者流程可知,菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等,加硫酸,只有SiO2不反应,经过过滤进行分离,则滤渣1为SiO2,滤液1含有硫酸铜、硫酸亚铁、硫酸锌、剩余的硫酸,②加氧化剂将亚铁离子氧化为铁离子,再加过量的NaOH,Zn2+转化ZnO22﹣,使Cu2+、Fe3+转化为沉淀,通过过滤从溶液中除去,则滤渣2为Fe(OH)3、Cu(OH)2,滤液2中含有Na2ZnO2及过量的NaOH,④通二氧化碳将ZnO22﹣转化为沉淀,则滤渣3为Zn(OH)2,步骤⑤主要发生氢氧化锌与硫酸的反应,滤液3含有碳酸氢钠。
(1)上述各步骤中,只有步骤①中有二氧化碳生成,故选:①;
(2)过氧化氢在酸性条件下将亚铁离子氧化成铁离子,反应的离子方程式为:2Fe2++2H++H2O2=2Fe3++2H2O,故答案为:2Fe2++2H++H2O2=2Fe3++2H2O;
(3)滤渣2为氢氧化铁和氢氧化铜,化学式为:Fe(OH)3、Cu(OH)2,故答案为:Fe(OH)3、Cu(OH)2;
(4)④通二氧化碳将ZnO22﹣转化为沉淀,则滤渣3为Zn(OH)2,反应方程式为:ZnO22﹣+2CO2+2H2O=Zn(OH)2↓+2HCO3﹣,故答案为:ZnO22﹣+2CO2+2H2O=Zn(OH)2↓+2HCO3﹣;
(5)滤液3中含碳粒子是碳酸氢钠溶液,碳酸氢钠溶液呈碱性,水解程度大于电离程度,所以含碳粒子的浓度大小顺序为HCO3﹣>H2CO3>CO32﹣,故答案为:HCO3﹣>H2CO3>CO32﹣;
Ⅱ.(6)煅烧发生反应:BaSO4+4CBaS+4CO↑,BaCO3溶解生成的CO32﹣能被H+结合而减少,促使溶解平衡正向移动,而SO42﹣不会被H+结合,所以BaSO4不会溶于强酸中,故答案为:BaSO4(s)+4C(s)BaS(s)+4CO(g);BaCO3溶解生成的CO32﹣能被H+结合而减少,促使溶解平衡正向移动,而SO42﹣不会被H+结合,所以BaSO4不会溶于强酸中;
Ⅲ.(7)步骤⑤中硫酸过量,过量的酸与BaS溶液混合会发生反应,产生有毒的H2S污染空气,而且会降低锌钡白的产率,
故答案为:过量的酸与BaS溶液混合会产生有毒的H2S污染空气,而且会降低锌钡白的产率。
【点评】本题考查物质制备工艺流程,涉及物质的分离提纯、对操作步骤及试剂的分析评价、电极反应式书写、热化学方程式书写等,理解工艺流程原理是解题关键,题目难度中等。
10.(16分)硫化氢(H2S)的转化是资源利用和环境保护的重要研究课题。
(1)H2S和CO混合加热可制得频基硫(COS),羰基疏可作粮食熏蒸剂,能防止其些昆虫、线虫和真菌的危害。反应方程式为CO(g)+H2S(g)=COS(g)+H2(g)。
①羰基硫的电子式为 ![]() 。
。
②下列能说明碳与硫两元素非金属性相对强弱的是 ac (填字母代号)。
a.相同条件下水溶液的pH:Na2CO3>Na2SO4
b.酸性:H2SO3>H2CO3
c.S与H2的化合比C与H2的化合更容易
(2)H2S具有还原性,在酸性条件下,能与KMnO4反应生成S、MnSO4、K2SO4和H2O,写出该反应的化学方程式 5H2S+2KMnO4+3H2SO4=5S↓+2MnSO4+K2SO4+8H2O 。
(3)H2S气体溶于水形成的氢硫酸是一种二元弱酸,25℃时,在0.10mol•L﹣1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2﹣)关系如图所示(忽略溶液体积的变化、H2S的挥发)。

①pH=13时,溶液中的c(H2S)+c(HS﹣)= 0.043 mol•L﹣1。
②某溶液含0.020mol•L﹣1Mn2+、0.10mol•L﹣1H2S,当溶液pH= 5 时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10﹣13]。
(4)H2S的废气可用烧碱溶液吸收,将烧碱吸收H2S后的溶液加入到如图所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应:S2﹣﹣2e﹣=S↓ (n﹣1)S+S2﹣⇌Sn2﹣写出电解时阴极的电极反应式: 2H++2e﹣=H2↑(或2H2O+2e﹣=H2↑+2OH﹣) 。
(5)一定温度下将NH4HS固体放入定容真空密闭容器中,可部分分解为硫化氢和氨气:
NH4HS(s)⇌H2S(g)+NH3(g)。
①可以判断上述分解反应已经达到化学平衡状态的是 BC (填字母代号)
A.v(H2S)=v(NH3) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
②当上述反应达平衡时:p(NH3)×p(H2S)=a(Pa2),则平衡时容器中的总压为 2 Pa( 用含a 的代数式表示)。[p(NH3)、p(H2S)分别代表NH3、H2S的压强,Pa为压强的单位]
【考点】CG:化学平衡状态的判断;CP:化学平衡的计算.菁优网版权所有
【专题】51E:化学平衡专题.
【分析】(1)①根据羰基硫分子结构和CO2相似,羰基硫分子中所有原子的最外层都满足8电子结构判断其电子式;
②利用氢化物稳定性、最高价氧化物水化物酸性及得电子能力比较非金属性;
(2)该反应中S元素化合价由﹣2价变为0价、+6价,Mn元素化合价由+7价变为+2价,根据转移电子守恒、原子守恒配平方程式;
(3)①pH=13时,c(S2﹣)=5.7×10﹣2mol/L,在0.10mol•L﹣1H2S溶液中根据硫守恒c(H2S)+c(HS﹣)+c(S2﹣)=0.10mol•L﹣1;
②当Qc=Ksp(MnS)时开始沉淀,由此求出硫离子的浓度,结合图象得出此时的pH;
(4)阳极上硫离子放电,电极反应式为S2﹣﹣2e﹣═S,阴极上氢离子放电生成氢气;
(5)①达到平衡时,正逆反应速率相等,各物质的浓度不变;
②发生反应为NH4HS=NH3+H2S,NH4HS分解生成等物质的量的硫化氢和氨气,NH3与H2S的分压相同,结合ρ氢气×ρ硫化氢=a(Pa2)计算。
【解答】解:(1)①羰基硫中分子中所有原子的最外层都满足8电子结构,碳原子能形成4个共价键,硫原子能形成2个共价键,氧原子能形成2个共价键,所以其电子式为![]() ,
,
故答案为:![]() ;
;
②a.相同条件下水溶液的pH:Na2CO3>Na2SO4,可知硫酸酸性大于碳酸,则非金属性S>C,故正确;
b.亚硫酸不是最高价含氧酸,则酸性:H2SO3>H2CO3,不能比较非金属性,故错误;
c.S与H2的化合比C与H2的化合更容易,则非金属性S>C,故正确;
故答案为:ac;
(2)该反应中S元素化合价由﹣2价变为0价、+6价,Mn元素化合价由+7价变为+2价,根据转移电子守恒、原子守恒配平方程式为5H2S+2KMnO4+3H2SO4=5S↓+2MnSO4+K2SO4+8H2O,
故答案为:5H2S+2KMnO4+3H2SO4=5S↓+2MnSO4+K2SO4+8H2O;
(3)①根据溶液pH与c(S2﹣)关系图pH=13时,c(S2﹣)=5.7×10﹣2mol/L,在0.10mol•L﹣1H2S溶液中根据硫守恒c(H2S)+c(HS﹣)+c(S2﹣)=0.10mol•L﹣1,所以c(H2S)+c(HS﹣)=0.1﹣5.7×10﹣2=0.043mol/L,
故答案为:0.043;
②当Qc=Ksp(MnS)时开始沉淀,所以c(S2﹣)mol/L=1.4×10﹣11mol/L,结合图象得出此时的pH=5,所以pH=5时锰离子开始沉淀,
故答案为:5;
(4)阳极上硫离子放电,电极反应式为S2﹣﹣2e﹣═S,阴极上氢离子放电生成氢气,电极反应式为2H++2e﹣=H2↑,
故答案为:2H++2e﹣=H2↑(或2H2O+2e﹣=H2↑+2OH﹣);
(5)①A.v(H2S)=v(NH3),不能判断正逆反应速率是否相等,不能说明达到平衡状态,故A错误;
B.反应前后气体体积不等,密闭容器中总压强不变,可说明达到平衡状态,故B正确;
C.反应前后气体的质量变化,密闭容器中混合气体的密度不变,可说明达到平衡状态,故C正确;
D.无论是否达到平衡状态,密闭容器中氨气的体积分数都不变,不能说明是否达到平衡状态,故D错误。
故答案为:BC;
②NH4HS=NH3+H2S,由NH4HS分解的反应方程式可知:生成等物质的量的硫化氢和氨气,则NH3与H2S的分压相同,故p硫化氢=p氨气Pa,所以,平衡后的总压为p硫化氢+p氨气=2Pa,
故答案为:2。
【点评】本题考查较综合,涉及化学平衡的家计算、化学键、非金属性比较、氧化还原反应等知识,为高考常见题型,题目综合性较强,注重化学反应原理的考查,把握相关反应原理为解答的关键,侧重分析与应用能力的考查,题目难度不大。
11.(15分)现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素同期表的前四周期,B的基态原子含有3个能级。且每个能级所含的电子数相同。D的原干核外有8个运动状态不同的电子;E与F处干同一周期相邻的族,它们的原子序数相差3,且E的基态原子有4个未成对电子。
请回答下列问题:
(1)请写出:D基资原子的价层电子排布图 ![]() ;F基态原子的价层电子排布式: 3d104s1
;F基态原子的价层电子排布式: 3d104s1
(2)下列说法错误的是 A、D 。
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点:SiO2>CO2
B.电负性顺序:B<C<D
C.N2与CO为等电子体,结构相似
D.稳定性:H2O>H2S,水分子更稳定的原因是水分子间存在氢键
(3)F离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点。向F的硫酸盐溶液中通入过量的C与A形成的气体X可生成[F(X)4]2+,该离子的结构式为 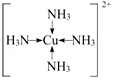 (用元素符号表示)。
(用元素符号表示)。
(4)某化合物与F(Ⅰ)(Ⅰ表示化合价为+1)结合形成图1所示的离子,该离子中碳原子的杂化方式有 sp2、sp3 。
(5)B单质的一种同素异形体的晶胞如图2所示,则一个晶胞中所含B原子数为 8 。
(6)D与F形成离子个数比为1:1的化合物,晶胞与NaCl类似,设D离子的半径为a pm,F离子的半径b pm,求该晶胞的空间利用率 100% 。
【考点】8J:位置结构性质的相互关系应用.菁优网版权所有
【专题】51C:元素周期律与元素周期表专题.
【分析】A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素同期表的前四周期,B的基态原子含有3个能级,即1s、2s、2p,且每个能级所含的电子数相同,则B的核外电子排布式为1s22s22p2,所以B为C,D的原子核外有8个运动状态不同的电子,原子核外每一个电子的运动状态都不同,即没有波函数相同的电子,说明D含有8个核外电子,则D为O,所以C只能为N,E与F处干同一周期相邻的族,它们的原子序数相差3,且E的基态原子有4个未成对电子,则E的核外电子排布式为[Ar]3d64s2,所以E为Fe,F为Cu,A为H,据此分析,
(1)D为O,价电子排布式为2s22p4,F为Cu,价电子排布式为3d104s1;
(2)A.SiO2是原子晶体,CO2是分子晶体,原子晶体熔沸点高于分子晶体;
B.B为C,C为N,D为O;
C.等电子体是指原子总数相同,价电子总数相同的粒子;
D.形成氢键是导致沸点升高;
(3)向F的硫酸盐溶液中通入过量的C与A形成的气体X可生成[F(X)4]2+,即为Cu(NH3)42+;
(4)根据结构简式分析,C存在的形式有单键和双键;
(5)B为C,根据晶胞结构分析,顶点粒子占,面心粒子占,内部粒子为整个晶胞所有;
(6)D与F形成离子个数比为1:1的化合物,为CuO,晶胞与NaCl类似,空间利用率为。
【解答】解:(1)D为O,价电子排布式为2s22p4,则价层电子排布图为:![]() ,
,
F为Cu,价电子排布式为3d104s1,
故答案为:![]() ;3d104s1;
;3d104s1;
(2)A.SiO2是原子晶体,CO2是分子晶体,原子晶体熔沸点高于分子晶体,不是因为二氧化硅的相对分子质量比二氧化碳大,所以沸点:SiO2>CO2,故A错误;
B.B为C,C为N,D为O,则电负性大小为:B<C<D,故B正确;
C.等电子体是指原子总数相同,价电子总数相同的粒子,N2与CO为等电子体,结构相似,故C正确;
D.形成氢键是导致沸点升高,不是因为水分子更稳定的原因是水分子间存在氢键导致稳定性:H2O>H2S,故D错误,
故答案为:A、D;
(3)向F的硫酸盐溶液中通入过量的C与A形成的气体X可生成[F(X)4]2+,即为Cu(NH3)42+,则该离子的结构式为: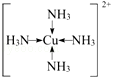 ,
,
故答案为: ;
;
(4)根据结构简式分析,C存在的形式有单键和双键,所以N的杂化方式有sp2、sp3,
故答案为:sp2、sp3;
(5)B为C,根据晶胞结构分析,顶点粒子占,面心粒子占,内部粒子为整个晶胞所有,所以一个晶胞中含有B的数目为8个,
故答案为:8;
(6)D与F形成离子个数比为1:1的化合物,为CuO,晶胞与NaCl类似,则1个晶胞中含有4个CuO,设D离子的半径为a pm,F离子的半径b pm,V球,根据几何关系,则晶胞的边长为l=2(a+b)pm,所以晶胞的体积为V晶胞=l3=8(a+b)3,所以晶胞的空间利用率为100%,
故答案为:100%。
【点评】本题主要考查物质的结构与性质,涉及核外电子排布、电负性、等电子体、晶体类型与性质、配合物、杂化理论、晶胞计算等,难点是晶胞的计算,明确各个字母的含义,题目难度中等。
12.(18分)光刻胶是一种应用广泛的光敏材料,其合成路线如下(部分试剂、反应条件和产物已略去):
已知:
Ⅰ.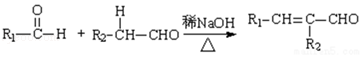 (R,R′为烃基或氢)
(R,R′为烃基或氢)
Ⅱ.![]() (R,R′为烃基)
(R,R′为烃基)
(1)写出A的结构简式 ![]() 。
。
(2)B分子中所含官能团的名称为 碳碳双键、醛基 。
(3)乙炔和羧酸X加成生成E,E的核磁共振氢谱为三组峰,且峰面积比为3:2:1,E能发生水解反应,则EF的化学方程式为 nCH3COOCH=CH2![]() 。
。
(4)由F到G的反应类型为 水解(或取代)反应 。
(5)D和G反应生成光刻胶的化学方程式为 ![]() 。
。
(6)C的一种同分异构体满足下列条件:
①能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应
②苯环上的一氯取代产物只有两种。写出该同分异构体的结构简式:  。
。
(7)根据已有知识并结合相关信息,写出以CH3CHO为原料制备CH3COCOCOOH的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
CH3CH2BrCH3CH2OHCH3COOCH2CH3 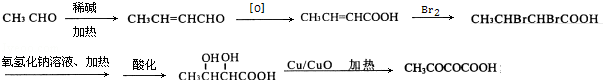
【考点】HC:有机物的合成.菁优网版权所有
【专题】534:有机物的化学性质及推断.
【分析】由D的结构可知,A中含有苯环,A与CH3CHO反应得到B,由物质的分子式及信息Ⅰ,可推知A为![]() ,B为
,B为![]() ,B与银氨溶液发生氧化反应、酸化得到C,则C为
,B与银氨溶液发生氧化反应、酸化得到C,则C为![]() ,C发生取代反应生成D.乙炔和羧酸X加成生成E,E发生加聚反应得到F,则E分子中含有C=C双键,结合分子式可知,X为CH3COOH,E的核磁共振氢谱为三组峰,且峰面积比为3:2:1,E能发生水解反应,故E为CH3COOCH=CH2,F为
,C发生取代反应生成D.乙炔和羧酸X加成生成E,E发生加聚反应得到F,则E分子中含有C=C双键,结合分子式可知,X为CH3COOH,E的核磁共振氢谱为三组峰,且峰面积比为3:2:1,E能发生水解反应,故E为CH3COOCH=CH2,F为![]() ,G与D发生信息Ⅱ的反应得到光刻胶,则光刻胶的结构简式为:
,G与D发生信息Ⅱ的反应得到光刻胶,则光刻胶的结构简式为: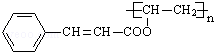 ,
,
(7)以CH3CHO为原料制备CH3COCOCOOH,可以先将发生题中流程里的第一步反应得CH3CH=CH2CHO,再经过氧化、与溴的加成、水解、氧化可得产品。
【解答】解:(1)由以上分析可知A为![]() ,故答案为:
,故答案为:![]() ;
;
(2)B为![]() ,含有碳碳双键、醛基,故答案为:碳碳双键、醛基;
,含有碳碳双键、醛基,故答案为:碳碳双键、醛基;
(3)E为CH3COOCH=CH2,在催化作用下发生加聚反应生成![]() ,反应的化学方程式为nCH3COOCH=CH2
,反应的化学方程式为nCH3COOCH=CH2![]() ,
,
故答案为:nCH3COOCH=CH2![]() ;
;
(4)F为![]() 含有酯基,可发生生成G,故答案为:水解(或取代)反应;
含有酯基,可发生生成G,故答案为:水解(或取代)反应;
(5)G与D发生信息Ⅱ的反应得到光刻胶,则光刻胶的结构简式为: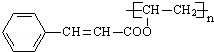 ,该反应方程式为:
,该反应方程式为:![]() ,
,
故答案为:![]() ;
;
(6)C的一种同分异构体满足下列条件:
①能发生银镜反应,说明有醛基,其水解产物之一能与FeCl3溶液发生显色反应,说明水解后产生酚羟基;
②苯环上的一氯取代产物只有两种,说明苯环对位上有两个取代基,符合条件的同分异构体的结构简式为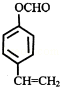 ,
,
故答案为: ;
;
(7)以CH3CHO为原料制备CH3COCOCOOH的合成路线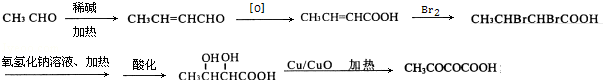 ,
,
故答案为: 。
。
【点评】本题考查有机物的推断,为高考常见题型,明确有机物的结构和性质是解本题关键,侧重考查学生分析推断及知识迁移能力,注意把握同分异构体的判断以及合成路线的设计,题目难度不大。
声明:试题解析著作权属菁优网所有,未经书面同意,不得复制发布
日期:2019/4/10 15:39:19;用户:tp;邮箱:lsgjgz137@xyh.com;学号:21474120