
湖南省醴陵二中、醴陵四中2016-2017学年高二下学期期中联考化学试卷
03月05日
![]()
![]() 哈尔滨师大附中、东北师大附中、辽宁省实验中学
哈尔滨师大附中、东北师大附中、辽宁省实验中学
2018年高三第一次联合模拟考试
理综化学
7、下列说法不正确的是
A.SiO2 能与HF 反应,因此可用HF 刻蚀玻璃
B.向NaSiO3溶液中逐滴加入稀盐酸制备硅酸凝胶
C.氮化硅是一种重要的结构陶瓷材料,化学式为Si3N4
D.石英是良好的半导体材料,可以制成光电池,将光能直接转化成电能
8.设NA 为阿伏加德罗常数的值,下列叙述正确的是
A.7.1gCl2与足量的Fe反应,转移电子数目为0.2 NA
B.12.0g NaHSO4晶体中阳离子和阴离子总数为0.3 NA
C.标准状况下,11.2L CCl4所含的碳原子数等于0.5NA
D.足量Cu 与400mL 10mol L HNO3充分反应,生成NO2的分子数目为NA
9、下列说法正确的是
A.联二苯(( ![]() )的二氯取代物有12种
)的二氯取代物有12种
B.乙醇与浓硫酸混合加热制乙烯需加碎瓷片,目的是为了迅速升温至170℃
C.汽油、柴油和植物油都是碳氢化合物,完全燃烧只生成CO2 和H2O
D.由苯制溴苯和由乙烯制1,2—二溴乙烷均发生了取代反应
l0、a、b、c、d 为原子序数依次增大的短周期主族元素,a 原子核外电子总数是其次外层电子数的4倍,b、c、d的最高价氧化物的水化物能两两反应生成盐和水,d 与a同族。下列叙述正确的是
A 简单离子半径:d>b>c>a
B.a、d 形成的简单氢化物的沸点:d>a
C.由a、b、c 形成的化合物的水溶液可能呈碱性
D.工业上利用电解熔融的c的氧化物来冶炼c。
11、一种突破传统电池设计理念的Mg-Sb液态金属储能电池,其工作原理如下图所示。该电池所用液体密度不同,在重力作用下分为三层,工作时中间层熔融盐的组成及浓度不变。该电池工作一段时间后,可由太阳能电池充电。下列说法不正确的是
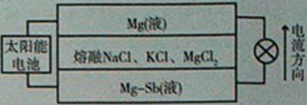
A.放电时,Mg(液)层的质量减小
B.放电时,正极反应式为:Mg2++2e-=Mg
C.充电时,Mg-Sb(液)层发生还原反应
D.充电时,C1-向中层和下层分界面处移动
12、室温下,下列叙述正确的是
A.若V1 LpH=11的NaOH溶液与V2LpH=3的HA溶液混合后显中性,则V1≤V2
B.等体积、等物质的量浓度的NaCl溶液中离子总数大于NaClO溶液中离子总数
C.等体积、等物质的量浓度的Na2CO3 和NaHCO3溶液混合:![]() <
<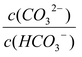
D.将CH3COOH溶液与NaOH溶液混合,若混合后的溶液中c(CH3COO-)+c(CH3COOH )=2c(Na+),且溶液显酸性,则c(OH-)+c(CH3COO-)=c(CH3COOH)+c(H+)
13、下列实验现象的解释或结论正确的是
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 向NaAlO2溶液中滴加NaHCO3溶液 | 出现白色沉淀 | NaAlO2与NaHCO3水解相互促进 |
| B | 向1mL淀粉溶液中滴加3~4滴稀硫酸,水浴加热,冷却后再滴加碘水 | 溶液呈无色 | 淀粉已完全水解 |
| C | 用浓HCl浸泡红砖粉末一段时间,取上层清液于试管中,滴加几滴酸性KMnO4溶液 | KMnO4溶液褪色 | 红砖中含有FeO |
| D | 向3mL0.lmol/L AgNO3溶液中先加入4~5滴0.Imol/L NaCl溶液,再滴加4~5滴0.1mol/LNaI溶液 | 先出现白色沉淀,后出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
26、(14分)某化学实验室以一种工业上的废渣(废渣主要含有MgCO3、MgSiO3和少量Fe、Al的氧化物)为原料,制备MgCO3·3H2O。实验流程如下图所示:
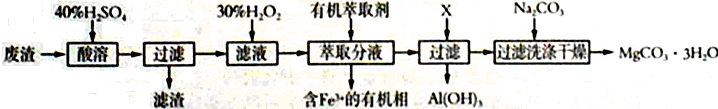
(1)为了加快废渣的酸溶速率,可采取的办法有_________(任写一点),酸溶时废渣中主要成分发生反应的离子方程式为___________________________________。
(2)加入30%H2O2的目的是__________________________________。
(3)用萃取分液的方法除去溶液中的Fe3+
①加入30%H2O2后,检验溶液中是否含有Fe2+的最佳试剂是__________________________。
②萃取分液完成后,检验水相中是否含有Fe3+的最佳试剂是______________________________。
(4)室温下,除去MgSO4溶液中的A13+(使Al3+浓度小于1×10-6mol/L)而不引入其它杂质,应加入的试剂X为__________,应调节pH的范围为_________________。
已知:①Ksp[Al(OH)3]=1.0×10-33 ②pH=8.5 时,Mg(OH)2开始沉淀
(5)向滤液中加入Na2CO3溶液生成MgCO3沉淀并用蒸馏水洗涤,确认沉淀洗净的操作及现象是____________________________。
(6)右图为不同反应温度下所得水合碳酸镁的X射线衍射谱图。由图可知,干燥时需控制温度范围为___________________,温度较高时MgCO3·3H2O发生转化的化学方程式为_______________________________。

 (1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2 和H2O。已知CH4 和S的燃烧热分别为890.3 kJ /mol 和297.2 kJ /mol,CH4和SO2反应的热化学方程式为______________________。
(1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2 和H2O。已知CH4 和S的燃烧热分别为890.3 kJ /mol 和297.2 kJ /mol,CH4和SO2反应的热化学方程式为______________________。
(2)用H2还原SO2生成S的反应分两步完成,如图1所示,该过程中相关物质的物质的量浓度随时间的变化关系如图2 所示:
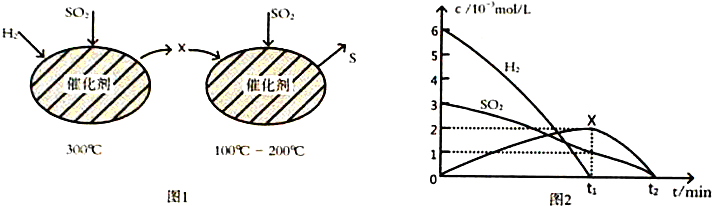
①分析可知X为____________(写化学式),0~t1时间段的温度为_________________,0~t1时间段用SO2 表示的化学反应速率为________________________________。
②总反应的化学方程式为_______________________________。
(3)焦炭催化还原SO2 生成S2,化学方程式为:
2C(s)+2SO2(g) S2(g)+2CO2(g),恒容容器中, lmol/L SO2与足量的焦炭反应,SO2的转化率随温度的变化如图3 所示。

①该反应的ΔH_______________0 (填“>”或“<”)
.②计算a点的平衡常数为_______________________。
(4)工业上可用Na2SO3溶液吸收SO2,该反应的离子方程式为__________________________,25℃时用1mol/L的Na2SO3 溶液吸收SO2,当溶液pH=7 时,溶液中各离子浓度的大小关系为__________________。
已知:H2SO4 的电离常数K1=1.3×10-2,K2=6.2×10-8
28、(15 分)硫代硫酸钠晶体(Na2S2O3·5H2O)又称海波,呈无色透明状,易溶于水,不溶于乙醇,常用作棉织物漂白后的脱氯剂、定量分析中的还原剂。
Ⅰ. Na2S2O3·5H2O的制备
Na2S2O3·5H2O的制备方法有多种,其中亚硫酸钠法是工业和实验室中的主要方法:
Na2SO3+S+5H2O![]() Na2S2O3·5H2O
Na2S2O3·5H2O
制备过程如下:
①称取12.6g Na2SO3于100mL烧杯中,加50mL 去离子水搅拌溶解。
②另取4.0g硫粉于200mL烧杯中,加6mL乙醇充分搅拌均匀将其润湿,再加入Na2SO3溶液,隔石棉小火加热煮沸,不断搅拌至硫粉几乎全部反应。
③停止加热,待溶液稍冷却后加2g活性炭,加热煮沸2分钟(脱色)。
④趁热过滤,得滤液至蒸发皿中,_________________、____________________。
⑤过滤、洗涤,用滤纸吸干后,称重,计算产率。
(1)加入的硫粉用乙醇润湿的目的是____________________________。
(2)步骤④趁热过滤的原因_____________________,空格处应采取的操作是_________________、____________________。
(3)步骤⑤洗涤过程中,为防止有部分产品损失,应选用的试剂为__________________________。
(4)滤液中除Na2S2O3 和未反应完全的Na2SO3外,最可能存在的无机杂质是________________,生成该杂质的原因可能是____________________________。
Ⅱ.产品纯度的测定
准确称取1.00g产品(硫代硫酸钠晶体的摩尔质量为248g/mol),用适量蒸馏水溶解,以淀粉作指示剂,用0.000mol/L I2的标准溶液滴定,反应的离子方程式为:2S2O32-+I2=S4O62-+2I-,记录数据如下:
| 滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
| 1 | 0.30 | 21.32 |
| 2 | 0.36 | 22.56 |
| 3 | 0.10 | 21.08 |
(5)计算所得产品的纯度为___________(保留三位有效数字),该数据的合理解释可能是__________(不考虑实验操作引起的误差)。
Ⅲ.产品的应用
(6)Na2S2O3 常用于脱氯剂,在溶液中易被Cl2 氧化为SO42-,该反应的离子方程式为 ____________________________________。
35、[化学一选修3:物质结构与性质] (15 分)
铜元素位于元素周期表中第ⅠB族,在化合物中其化合价可以呈现+1、+2 价。铜的单质及其化合物在很多领域有重要的应用。
Ⅰ.CuSO4 和Cu(NO3)2是常见的+2价铜的化合物,有较为广泛的应用。
(1)向CuSO4溶液中滴加氨水,最后可以得到深蓝色的[Cu(NH3)4]SO4溶液。
①N、O、S 三种元素的第一电离能由大到小的顺序为______________________________。
[Cu(NH3),](填
②比较NH3 和[Cu(NH3)4] 2+中H一N一H键角的大小:NH3___________[Cu(NH3)4] 2+(填“>”或“<”), 并 说明理由________________________。
(2)制备Cu(NO3)2的一种方法是在N2O4的乙酸乙酯溶液中加入铜,反应一段时间后,加热即可得到Cu(NO3)2。
①NO3- 的立体构型的名称为_______________,N 原子的杂化方式为________________。NO3- 的一种等电子体为________________________。
②N2O4会发生类似于水的自偶电离N2O4NO++NO3- ,制备无水Cu(NO3)2的化学__________________________________________。
Ⅱ.CuCl 是较为常见的十1价铜的化合物。
(3)基态Cu+ 的价层电子排布式为________________________。
(4)CuCl 的晶胞结构如右图所示,C1原子位于立方体的顶点和面心, Cu 原子位于Cl 原子构成的四面体体心。
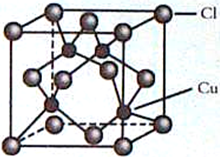
①每个Cl原子周围距Cl原子最近且等距离的Cu原子数目为________________。
②设NA 为阿伏加德罗常数的值,晶体的密度为ρg/cm3,CuCl 的摩尔质量为M g/mol,计算晶胞中距离最近的两个Cu原子间的距离为___________pm。
36、【化学一选修5:有机化学基础】(15 分)
化合物Ⅰ是有机合成中的一种重要中间体,具体合成过程如下(部分产物及条件略去):
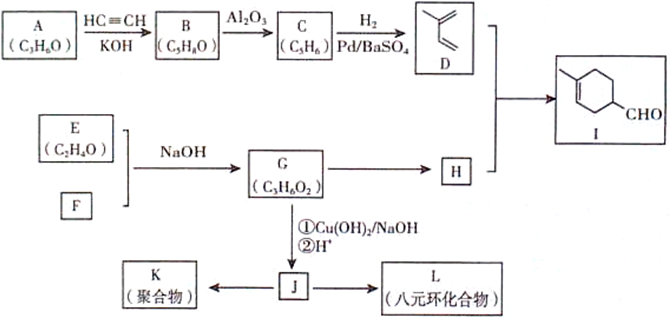
①
②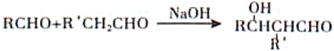
③![]()
④化合物A的一氯代物只有一种
(1)I分子中含有的官能团名称为________________________________。
(2)A→B的反应类型为__________________,G→H 的反应类型为___________________________。
(3)D的化学名称为___________________________。
(4)C的结构简式为_________________,L的结构简式为_______________。
(5)G→J 中过程①的化学方程式为_________________________,J→K的化学方程式为___________________________。
(6)同时满足下列条件的I的同分异构体有_________种(不考虑立体异构,不包括I)。
①与具有相同的官能团 ②具有六元碳环结构 ③分子中有一个甲基
| 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| D | A | A | C | C | B | B |
26.(14分)
(1) 升高温度、搅拌、提高硫酸浓度等(1分,答案合理即给分)
MgCO3+2H+=Mg2++H2O+CO2↑ MgSiO3+2H+=Mg2++H2SiO3 (2分,各1分)
(2)将Fe2+氧化为Fe3+ ,便于除去 (1分)
(3) ①K3[Fe(CN)6]溶液 (1分) ②KSCN 溶液 (1分)
(4)MgO、Mg(OH)2、MgCO3或Mg2(OH)2 CO3 (1分,任写一种即可)
5.0 (5) 取少量最后一次的洗涤过滤液于试管中,向其中滴加盐酸酸化的氯化钡溶液,若不产生白色沉淀,则表明已洗涤干净 (2分) △
5MgCO3·3H2O === Mg5 (OH)2 (CO3)4· 4H2O+CO2↑+10H2O (2分)
27.(14分)
(1)CH4 (g)+2SO2 (g)=== CO2 (g)+2S (s)+2H2O(l) △H=-295.9 kJ/mol (2分)
催化剂
(2)① H2S (1分) 300℃(1分) 2×10-3/t1 mol/(L· min)(1分)△
② 2H2+SO2 === S+2H2O (2分,条件不正确扣1分)(3)① < (2分) ② 36.45 mol/L (2分,不写单位扣1分)
(4)SO32- +SO2 + H2O === 2HSO3-(1分)
c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)(2分)
28.(15分)
Ⅰ.(1)增大亚硫酸钠与硫粉的接触面积,加快反应速度 (1分)
(2)防止温度降低,产品析出而损失(2分) 蒸发浓缩、冷却结晶(2分,各1分)
(3)乙醇(1分)
(4)Na2SO4(2分) Na2SO3被空气中的O2氧化 (1分,答Na2S2O3被O2氧化也可)
Ⅱ.(5)104%(2分) 产品中有未反应的Na2SO3也会与I2发生反应,且相同质量的Na2SO3消耗I2更多 (2分,其它合理答案均可)
Ⅲ.(6)S2O32-+ 4Cl2 + 5H2O == 2SO42- + 8Cl- + 10H+ (2分)
35.(15分)
Ⅰ.(1)①N>O>S (2分)
②< (1分) 因为NH3 提供孤对电子与Cu2+ 形成配位键后,N-H成键电子对受到的排斥力减小,所以H-N-H键角增大 (2分)
(2)①平面三角形(2分) sp2杂化(1分) CO32-、SO3(1分,答案合理即可)
②Cu+2N2O4![]() Cu(NO3)2+2NO↑(2分)
Cu(NO3)2+2NO↑(2分)
Ⅱ.(3)3d10 (1分)
(4)①4 (1分)
②![]()
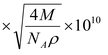 (2分)
(2分)
36.(15分)
(1)醛基、碳碳双键 (2分,各1分)
(2)加成 (1分) 消去(1分)
(3)2-甲基-1,3-丁二烯 (1分)
(4) (2分) (2分)
(5)HOCH2CH2CHO + 2Cu(OH)2 + NaOH HOCH2CH2COONa + Cu2O↓ + 3H2O (2分)
(2分,条件写催化剂也可)
(6)16种 (2分)
欢迎访问“”——