
湖南省醴陵二中、醴陵四中2016-2017学年高二下学期期中联考化学试卷
03月05日
![]() 人大附中2017-2018学年下学期高三第二次测试卷
人大附中2017-2018学年下学期高三第二次测试卷
理科综合化学
注意事项:
1.答题前,先将自己的姓名、准考证号填写在试题卷和答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置。
2.选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,写在试题卷、草稿纸和答题卡上的非答题区域均无效。
3.非选择题的作答:用签字笔直接答在答题卡上对应的答题区域内。写在试题卷、草稿纸和答题卡上的非答题区域均无效。
4.考试结束后,请将本试题卷和答题卡一并上交。
可能用到的相对原子质量:H 1 C 12 N 14 O 16
第Ⅰ卷
一、选择题:本大题共13小题,每小题6分。在每小题给出的四个选项中,只有一项是符合题目要
求的。
7.化学与生活、社会发展息息相关,下列有关说法不正确的是
A.“熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应
B.为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅胶
C.“霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应
D.“外观如雪,强烧之,紫青烟起”,该过程中利用了焰色反应
8.NA为阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,2.24LCCl4含碳原子数目为0.1NA
B.常温下56g铁片投入足量浓H2SO4中生成1.5NA个SO2分子
C.常温下,22gCO2和N2O混合气体中,含有的原子数目为1.5NA
D.pH=1的H3PO4溶液中,含有0.1NA个H+
9.下列选项中的操作、现象与结论完全一致的是
| 选项 | 操作 | 现象 | 结论 |
| A | 向滴有酚酞的NaOH 溶液中通入Cl2 | 溶液褪色 | HClO有漂白性 |
| B | 无水乙醇与浓硫酸共热至170℃,将产生气体通入溴水 | 溴水褪色 | 乙烯和溴水发生加成 |
| C | 向浓度、体积都相同的Na2CO3和NaHCO3溶液中各滴加1滴酚酞 | 变红,前者红色深 | 结合H+能力: CO32->HCO32- |
| D | 用发光小灯泡分别做HCl和CH3COOH导电性实验 | 发光强度:HCl强于CH3COOH | CH3COOH是弱电解质 |
10.下列关于正丁烷(b)、2-甲基丙烷(d)、甲苯(p)的说法中正确的是
A.b与d互为同系物
B.b、d、p的一氯代物种数分别为2、3、4
C.b、d、p均不能使酸性高锰酸钾溶液褪色
D.b、d、p中只有d的所有碳原子不能处于同一平面
11.用甲醇燃料电池作电源,用铁作电极电解含Cr2O72-的酸性废水,最终可将Cr2O72-转化成Cr(OH)3沉淀而除去,装置如下图。下列说法正确的是
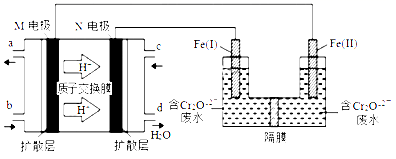
A.Fe(II)为阳极
B.M电极的电极反应式为CH3OH+8OH--6e-= CO32-+6H2O
C.电解一段时间后,在Fe(Ⅰ)极附近有沉淀析出
D.电路中每转移6 mol电子,最多有1 mol Cr2O72-被还原
12.X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,X与Z可形成常见的XZ或XZ2型分子,Y与M形成的气态化合物质量是相同条件下同体积氢气的8.5倍,W是原子半径最大的短周期元素。下列判断正确的是
A.最高价含氧酸酸性:X<Y B.X、Y、Z可形成离子化合物
C.W可形成双原子分子 D.M与W形成的化合物含极性共价键
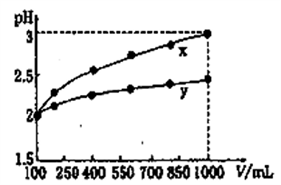
13.下列说法正确的是
A.0.1 mol·L-1pH为4的NaHB溶液中:c (HB-)>c(H2B)>c(B2-)
B.如左下图表示25℃时,用0.1mol·L-1盐酸滴定20mL 0.1mol·L-1NaOH溶液时,溶液的pH随加入酸体积的变化
C.在pH=2的NaHSO4溶液中c(H+)=c(OH-)+ c(SO42-)
D.pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如右下图所示,分别滴加NaOH溶液(c=0.1mol·L-1)至pH=3,消耗NaOH溶液的体积为Vx、Vy,则x为强酸,y为弱酸且Vx>Vy

26.碘是人类必需的生命元素,在人体的生长发育过程中起着重要作用,实验小组进行碘单质的制备。
【查阅资料】碱性条件下,I2会发生歧化反应生成I-和IO3-,酸性条件下,I-和IO3-又会发生归中反应生成I2;碘在水中的溶解度为0.029g。
【碘的制取】以海带为原料,按照以下步骤进行实验。
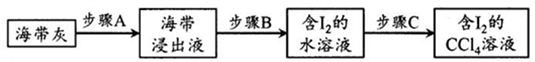
(1)将海带灼烧成灰后再用水浸取,目的是_______________。
(2)步骤B发生的反应是“氧化”,这一操作中可供选用的试剂: ①Cl2;②Br2;③稀硫酸和H2O2,从无污染角度考虑,你认为合适试剂是______(填编号),反应中I-转化为I2的离子反应方程式为_______________。
(3)步骤C中使用的起到分离作用的仪器是_____________,使用该仪器时,第一步操作是_______________。
(4)有同学查资料后发现CCl4有毒,提议用乙醇代替,请判断该提议是否可行,原因是___________________________________________________。
【碘的分离】得到含I2的CCl4溶液后,利用下图装置进行碘的提取并回收溶剂。
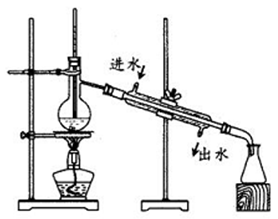
(5)图中有两处明显错误,分别是①_________;②_________。
(6)对实验装置的错误改正之后进行分离操作。预期锥形瓶中得到无色的CCl4,实验结果锥形瓶中得到紫红色液体,请分析出现该实验结果的原因_____________________________,为了保证实验成功,请提出改进方案:_____________________________________________。
27.“一碳化学”是指以含一个碳原子的化合物(如:CO2、CO、CH4、CH3OH等)为初始反应物,合成一系列重要的化工原料和燃料的化学。
(1)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应I:2NH3(g)+CO2(g)==NH2COONH4(s) △H1
反应II:NH2COONH4(s)==CO(NH2)2(s)+H2O(g) △H2=+72.49kJ/mol
总反应:2NH3(g)+CO2(g)==CO(NH2)2(s)+H2O(g) △H3=-86.98kJ/mol
请回答下列问题:
①反应I的△H1=______ kJ/mol
②反应II一般在_________(填“高温”或“低温”)情况下有利于该反应的进行。
③一定温度下,在体积为固定的密闭容器中按计量比进行反应I,下列能说明反应达到了平衡状态的是__________(填序号)。
A.混合气体的平均相对分子质量不再变化 B.容器内气体总压强不再变化
C.2v正( NH3)=v逆(CO2) D.容器内混合气体的密度不再变化
④环境为真空时,在一敞开容器(非密闭容器)中加入NH2COONH4固体,足够长时间后,反应是否建立平衡状态? ___________(填“是”或“否”)
(2)将CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。测得CH3OH的物质的量随时间的变化如下图。
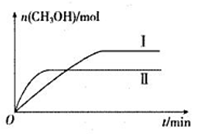
①曲线I、II对应的平衡常数大小关系为KI_______KII(填“ >”“<”或“=”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | amol CO2、bmol H2、cmol CH3OH(g)、cmolH2O(g)(a、b、c均不为零) |
若甲容器平衡后气体的压强为开始的0.8倍,则甲容器平衡混合气体中CH3OH(g)的体积分数为_______,要使平衡后乙容器与甲容器中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,乙容器中c的取值范围为________。
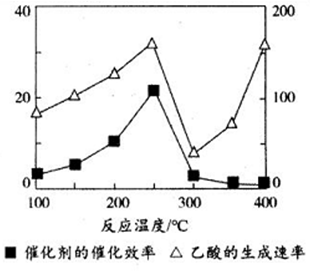
(3)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系如下图,乙酸的生成速率主要取决于温度影响的范围是________________。
28.硫酸锌可用于制造锌钡白、印染媒染剂等。用锌白矿(主要成分为ZnO,还含有FeO、CuO、SiO2等杂质)制备ZnSO4·7H2O的流程如下。
已知:Ksp[Fe(OH)3]=4.0×10−38,Ksp[Cu(OH)2]=2.2×10−20
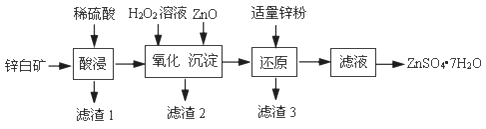
(1)“滤渣1”的主要成分是_______(填化学式)。“酸浸”过程中,为了提高锌元素浸出速率,可采取的措施有:①适当提高酸的浓度,②_______(填一种)。
(2)“氧化”过程中,发生氧化还原反应的离子方程式是_____________________________。
(3)“沉淀”过程中,加入ZnO产生Fe(OH)3沉淀的原因是____________________________。
(4)加入适量ZnO固体,若只析出Fe(OH)3沉淀而未析出Cu(OH)2沉淀,且测得沉淀后的溶液中c(Fe3+)=4.0×10−14mol/L,此时溶液中c(Cu2+)的取值范围是_______mol/L。
(5)加入适量锌粉的作用是__________________________。
(6)由滤液得到ZnSO4•7H2O的操作依次为____________、_______________、过滤、洗涤、干燥。实验室中过滤操作需要使用的玻璃仪器有烧杯、_________、_________。
35.硫和钙的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)基态Ca原子中,核外电子占据最高能层的符号是________,该能层为次外层时最多可以容纳的电子数为_________。元素Ca和S相比,第一电离能较大的是______(填元素符号)。
(2)钙元素的焰色反应呈砖红色,其中红色对应的辐射与钾元素的焰色反应对应颜色的辐射波长,较短的是_______(填元素符号)。
(3)H2S和H2O分子构型都为V形,中心原子的杂化形式都是______,但H2O分子键角大于H2S分子,原因是________________________________________________________。
(4)钙元素和锰元素属于同一周期,且核外最外层电子构型相同,但金属钙的熔点、沸点等都比金属锰低,原因是______________________________________。
(5)Ca、Mn、Mg的氧化物和硫化物都是NaCl型结构的离子晶体,其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得它们的晶胞参数如下表:
| 氧化物晶体 | MgO | MnO | CaO |
| a/nm | 0.421 | 0.444 | 0.480 |
| 硫化物晶体 | MgS | MnS | CaS |
| a/nm | 0.520 | 0.520 | 0.568 |
由表可知:r(S2-)_______r(O2-)(填“>”或“<”),r(Mg2+)、r(Ca2+)、r(Mn2+)由大到小的的顺序是____________________________,r(S2-)为_____nm,r(Ca2+)为_____nm。
36.氰基烯酸酯在碱性条件下能快速聚合为 ,从而具有胶黏性,某种氰基丙烯酸酯(H)的合成路线如下:
,从而具有胶黏性,某种氰基丙烯酸酯(H)的合成路线如下:
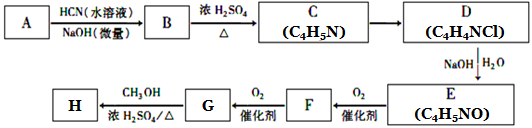
已知:①A的相对分子量为58,氧元素质量分数为0. 276,核磁共振氢谱显示为单峰;
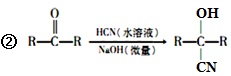
回答下列问题:
(1)A的化学名称为____________。
(2)C的结构简式为________________,F中的含氧官能团名称是________________。
(3)由E生成F的反应类型为_____________,由G生成H的反应类型为_____________。
(4)由G生成H的化学方程式为________________________________。
(5)写出A的能够发生银镜反应的同分异构体的结构简式______________。
化学答案
一、选择题:本大题共13小题,每小题6分。在每小题给出的四个选项中,只有一项是符合题目要
求的。
7.【答案】B
【解析】A.“熬胆矾铁釜,久之亦化为铜”,该过程铁与硫酸铜发生了置换反应,A正确;B.生石灰或硅胶是常用的干燥剂,没有抗氧化能力。为防止中秋月饼等富脂食品因被氧化而变质,应加入抗氧化剂,B不正确;C.“霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应,C正确;D.“外观如雪,强烧之,紫青烟起”,该过程中某些化合物在灼烧时发生了焰色反应,D正确。本题选D。
8.【答案】C
【解析】A.标况下,四氯化碳为液态,故不能根据气体摩尔体积来计算其物质的量,故A错误;B.56g铁的物质的量为1mol,常温下由于铁与浓硫酸能够发生钝化,阻止了反应的进行,无法计算反应生成二氧化硫的物质的量,故B错误;C.CO2和N2O的摩尔质量均为44g/mol,故22gCO2和N2O的物质的量为0.5mol,而CO2和N2O均为三原子分子,故0.5mol混合气体含1.5mol原子,个数为1.5NA,故C正确;D.未告知溶液的体积,无法计算pH=1的H3PO4溶液中含有的H+数目,故D错误;故选C。
9.【答案】C
【解析】A.氯气与NaOH反应,溶液的碱性减弱,酚酞也可褪色,不能判断是HClO的漂白性,故A错误;B.无水乙醇与浓硫酸共热至170℃,发生氧化还原反应,能够反应生成二氧化硫,二氧化硫也能与溴水反应,不能确定乙烯与溴水发生加成反应,故B错误;C.水解程度越大,对应酸的酸性越弱,则由现象可知结合H+能力:CO32->HCO3-,故C正确;D.导电性与离子浓度有关,浓度未知,不能判断电离出离子浓度及电解质的强弱,故D错误;故选C。
10.【答案】D
【解析】A.b与d的分子组成相同,结构不同,互为同分异构体,不互为同系物,故A错误;B.b、d、p的一氯代物种数分别为2、2、4,故B错误;C.p能使酸性高锰酸钾溶液褪色,故C错误;D.b、d、p中只有d的所有碳原子不能处于同一平面,故D正确。故选D。
11.【答案】C
【解析】A.H+向右移动,表明M电极是负电极,Fe(II)为阴极,故A错误;B.酸性溶液中没有大量OH-,M电极的电极反应式为CH3OH+H2O-6e-= CO2↑+6H+,故B错误;C. Fe(I)产生Fe2+,6Fe2++Cr2O72-+14H+==6Fe3++2Cr3++7H2O,电解一段时间后,Fe(II)产生的OH-大量移向阳极区,在Fe(I)极附近产生Fe(OH)3、Cr(OH)3沉淀析出,故C正确;D. 6Fe2+~Cr2O72-,电路中每转移6 mol电子,最多有0.5mol Cr2O72-被还原,故D错误。故选C。
12.【答案】A
【解析】首先结合题意判断出X、Y、Z、M、W五种元素,X与Z可形成常见的XZ或XZ2型分子,应该是C和O元素,则Y为N元素,Y与M形成的气态化合物质量是相同条件下同体积氢气的8.5倍可推出M为H,W是原子半径最大的短周期元素则为Na。H2CO3
13.【答案】C
【解析】A.由于0.1mol/L NaHB溶液pH为4,所以NaHB在水溶液中既能电离又能水解,但其电离作用大于其水解作用,所以在该溶液中c(HB-)>c(B2-)>c(H2B),A不正确;B.分析左图曲线,在滴定终点pH=7附近没有出现明显的突变,可以判断B不正确; C.在pH=2的NaHSO4溶液中,由电荷守恒c(H+)+ c(Na+)=c(OH-)+ 2c(SO42-),因为c(Na+)= c(SO42-),所以c(H+)=c(OH-)+ c(SO42-),C正确;D.pH=2的两种一元酸x和y,体积均为100 mL,稀释到1000mL时,x的pH分别变为3而y小于2.5,所以x是强酸、y是弱酸。因为它们起始时pH相同,所以弱酸y的物质的量浓度远远大于强酸x,所以在分别滴加NaOH溶液(c=0.1mol·L-1)至pH=3过程中,y可以继续电离,因此消耗NaOH溶液的体积为Vx
26.【答案】(1) 破坏有机物质,使I-充分溶解
(2) ③ 2I-+2H++H2O2=2H2O+I2 (3)分液漏斗 检漏
(4) 不行,乙醇与溶剂水互溶,不能用于萃取碘水中的碘单质
(5) 温度计水银球插入太深,没有在蒸馏烧瓶的支管处 冷却水进出口接反了
(6) 加热蒸馏过程中碘也会发生挥发(升华) 改进方案一:用水浴加热法进行蒸馏(减压蒸馏),改进方案二:向含I2的CCl4溶液加入氢氧化钠溶液,反应之后向水层中加入硫酸,将反应得到的固体过滤即得到碘单质。(或者其他的合理答案)
【解析】(1)将海带灼烧成灰,破坏有机物质,便于用水浸取时使碘离子溶解,故答案为:破坏有机物质,使I-充分溶解;
(2)步骤B的目的是氧化碘离子生成碘分子,由于①Cl2;②Br2;都能污染环境,而③稀硫酸和H2O2,的还原产物为水,因此从无污染角度考虑,应该选择③,反应中I-转化为I2 的离子反应方程式为2I-+2H++H2O2=2H2O+I2,故答案为:③;2I-+2H++H2O2=2H2O+I2;
(3)步骤C为萃取和分液,用到的仪器主要是分液漏斗,使用该仪器时,首先需要检查是否漏液,故答案为:分液漏斗;检漏;
(4) 乙醇与溶剂水互溶,不能用于萃取碘水中的碘单质,故答案为:不行,乙醇与溶剂水互溶,不能用于萃取碘水中的碘单质;
(5)根据装置图,图中两处明显错误分别是:①蒸馏实验中温度计测量的是蒸汽的温度,因此温度计水银球插入太深,没有在蒸馏烧瓶的支管处,②为了提高冷却效果,常常采用逆流原理,即冷却水下进上出,因此冷却水进出口接反了,故答案为:温度计水银球插入太深,没有在蒸馏烧瓶的支管处;冷却水进出口接反了;
(6) 加热蒸馏过程中碘也会发生挥发,使得锥形瓶中得到紫红色液体;为了避免该现象的出现,可以用水浴加热法进行蒸馏,故答案为:加热蒸馏过程中碘也会发生挥发;用水浴加热法进行蒸馏等。
27.【答案】(1) -159.47 (2) 高温
(3) BD (4) 否 (5) >
(6) 12.5% (7) 0.4
【解析】(1)①反应Ⅰ:2NH3(g)+CO2(g)=NH2CO2NH4(s)△H1=a kJ•mol-1,反应Ⅱ:NH2CO2NH4(s) =CO(NH2)2(s)+H2O(g)△H2=+72.49kJ•mol-1,总反应Ⅲ:2NH3(g)+CO2(g) =CO(NH2)2(s)+H2O(g)△H3=-86.98kJ•mol-1,由盖斯定律总反应Ⅲ-反应Ⅱ,得到2NH3(g)+CO2(g)=NH2CO2NH4(s)△H1=a=-159.47kJ•mol-1,故答案为:-159.47;
②反应Ⅱ:NH2CO2NH4(s) =CO(NH2)2(s)+H2O(g)△H2=+72.49kJ•mol-1,反应前后气体体积增大,△S>0,焓变分析可知是吸热反应,△H>0,所以依据反应自发进行的判断依据△H-T△S<0,需要在高温下反应自发进行,故答案为:高温;
③A.反应I中反应物为气体,生成全部为固体,所以在反应前后,混合气体的平均相对分子质量保持不变,所以不能作为平衡状态的判断标志,故A错误;B.反应I中,气体的物质的量减小,所以反应的压强减小,所以容器内气体总压强不再变化时,说明反应处于平衡状态,故B正确;C.反应处于平衡状态时v正( NH3)=2v逆(CO2),故C错误;D.反应I中,容器体积不变,气体质量减小,所以当容器内混合气体的密度不再变化时,说明反应处于平衡状态,故D正确;故选BD;
④环境为真空时,在一敞开容器(非密闭容器)中加入NH2COONH4固体,发生NH2COONH4(s) CO(NH2)2(s)+H2O(g),水蒸气进入环境中,浓度近似为0,无论经过多长时间,反应都不会建立平衡状态,故答案为:否;
(2)①II平衡时间小于I,说明II反应速率大于I,且平衡时II中CH3OH的物质的量小于I,说明平衡向逆反应方向移动,则只能是升高温度,即II的温度大于I,温度越高,平衡向逆反应方向移动,导致化学平衡常数越小,所以KⅠ>KⅡ,,故答案为:>;
②设二氧化碳反应量为x
CO2(g)+3H2(g) CH3OH(g)+H2O(g)
初始量(mol): 1 3 0 0
转化量(mol): x 3x x x
平衡量(mol):1-x 3-3x x x
甲中平衡后气体的压强为开始时的0.8倍,即![]() =0.8 ,解得x=0.4mol,甲容器平衡混合气体中CH3OH(g)的体积分数=物质的量分数=
=0.8 ,解得x=0.4mol,甲容器平衡混合气体中CH3OH(g)的体积分数=物质的量分数=![]() ×100%=12.5%;依题意:甲、乙为等同平衡,且起始时维持反应逆向进行,所以全部由生成物投料,c的物质的量为1mol,c 的物质的量不能低于平衡时的物质的量0.4mol,所以c的物质的量为:0.4<c<1mol,故答案为:12.5%;0.4<c<1;
×100%=12.5%;依题意:甲、乙为等同平衡,且起始时维持反应逆向进行,所以全部由生成物投料,c的物质的量为1mol,c 的物质的量不能低于平衡时的物质的量0.4mol,所以c的物质的量为:0.4<c<1mol,故答案为:12.5%;0.4<c<1;
(3)①温度超过250℃时,催化剂的催化效率降低,在300℃时失去活性,故以后乙酸的生成速率升高是由温度升高导致的,故乙酸主要取决于温度影响的范围为300℃~400℃,故答案为:300℃~400℃。
28.【答案】(1) SiO2粉碎锌白矿或充分搅拌浆料或适当加热等
(2) 2Fe2++H2O2+2H+=2Fe3++2H2O
(3) Fe3+在溶液中存在水解平衡: Fe3++3H2OFe(OH)3+3H+,加入ZnO 后,与H+反应,H+浓度减小,水解平衡正向进行,生成Fe(OH)3沉淀
(4)<2.2×10-4 (5) 除去溶液中的Cu2+
(6) 蒸发浓缩 冷却结晶 漏斗 玻璃棒
【解析】本题主要考查用锌白矿制备ZnSO4·7H2O的流程的评价。
(1)“滤渣1”的主要成分是不溶于稀硫酸的SiO2。“酸浸”过程中,为了提高锌元素浸出速率,可采取的措施有:①适当提高酸的浓度,②粉碎锌白矿或充分搅拌浆料或适当加热等。
(2)“氧化”过程中,发生氧化还原反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O。
(3)“沉淀”过程中,加入ZnO产生Fe(OH)3沉淀的原因是Fe3+在溶液中存在水解平衡: Fe3++3H2OFe(OH)3+3H+,加入ZnO 后,与H+反应,H+浓度减小,水解平衡正向进行,生成Fe(OH)3沉淀。
(4)c(OH-)≥(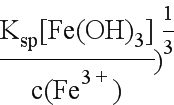 =10-8mol/L,此时溶液中c(Cu2+)=
=10-8mol/L,此时溶液中c(Cu2+)=![]() <2.2×10-4mol/L。
<2.2×10-4mol/L。
(5)加入适量锌粉的作用是除去溶液中的Cu2+。
(6)由滤液得到ZnSO4•7H2O的操作依次为蒸发浓缩、冷却结晶、过滤、洗涤、干燥。实验室中过滤操作需要使用的玻璃仪器有烧杯、漏斗、玻璃棒。
35.【答案】(1) N 18 S (2) K
(3) sp3杂化 O元素电负性大于S元素,分子中O-H键电子对的电子云更偏向中心O原子,使斥力增大,键角增大
(4) 钙的原子半径较大且价电子数较少,金属键较弱
(5) >r(Ca2+)>r(Mn2+)>r(Mg2+) 0.184 0.100
【解析】(1)Ca是20号元素,核外有4个电子层,核外电子占据最高能层的符号是N,根据核外电子排布的规律,次外层不超过18个电子;第一电离能S>Mg>Ca,第一电离能较大的是S,故答案为:N;18;S;
(2)钙元素的焰色反应呈砖红色,钾元素的焰色反应为紫色,紫色的辐射波长比红色短,故答案为:K;
(3)H2S和H2O分子构型都为V形,中心原子的杂化轨道数目都是4,都采用sp3杂化;O元素电负性大于S元素,分子中O-H键电子对的电子云更偏向中心O原子,使斥力增大,键角增大,导致H2O分子键角大于H2S分子,故答案为:sp3杂化;O元素电负性大于S元素,分子中O-H键电子对的电子云更偏向中心O原子,使斥力增大,键角增大;
(4) 钙的原子半径较大且价电子数较少,金属键较弱,使得金属钙的熔点、沸点等都比金属锰低,故答案为:钙的原子半径较大且价电子数较少,金属键较弱;
(5) 由表可知,相同金属的晶胞参数中,氧化物的都小于硫化物的,因此r(S2-)>r(O2-);根据不同金属氧化物的晶胞参数,r(Mg2+)、r(Ca2+)、r(Mn2+)由大到小的的顺序为r(Ca2+)>r(Mn2+)>r(Mg2+);因为S2-是面心立方最密堆积方式,面对角线是S2-半径的4倍,即4r=![]() ×0.520,解得r=
×0.520,解得r=![]() ×0.520nm=0.184nm;CaS也属于NaCl型结构,根据晶胞的结构,晶胞参数=2r(S2-)+2r(Ca2+),则r(Ca2+)=
×0.520nm=0.184nm;CaS也属于NaCl型结构,根据晶胞的结构,晶胞参数=2r(S2-)+2r(Ca2+),则r(Ca2+)=![]() =0.100nm;故答案为:>; r(Ca2+)>r(Mn2+)>r(Mg2+);0.184;0.100。
=0.100nm;故答案为:>; r(Ca2+)>r(Mn2+)>r(Mg2+);0.184;0.100。
36.【答案】(1) 丙酮 (2) ![]() 醛基
醛基
(3) 氧化反应 取代反应(酯化反应)
(4)![]() + CH3OH
+ CH3OH![]()
![]() + H2O
+ H2O
(5) CH3CH2CHO
【解析】(1)A的相对分子量为58,氧元素质量分数为0.276,则氧原子个数是58×0.276÷16=1,再根据商余法42÷12=3…6,A的分子式是C3H6O,核磁共振氢谱显示为单峰,A是CH3COCH3;(2)A是CH3COCH3,根据信息②,可知B是![]() ;B在浓硫酸作用下生成C,根据C的分子式C4H5N,可知C是
;B在浓硫酸作用下生成C,根据C的分子式C4H5N,可知C是![]() ;H是氰基丙烯酸酯,结合G在浓硫酸条件下与甲醇反应生成H,则H是
;H是氰基丙烯酸酯,结合G在浓硫酸条件下与甲醇反应生成H,则H是![]() ;逆推G是
;逆推G是![]() ;F是
;F是![]() ;E是
;E是![]() ;D是
;D是![]() 。
。
解析:根据以上分析,(1)A是CH3COCH3,化学名称为丙酮。
(2)C的结构简式为![]() ,F是
,F是![]() 含氧官能团是-CHO,名称是醛基。
含氧官能团是-CHO,名称是醛基。
(3)由![]() →
→![]() 的反应类型为氧化反应,
的反应类型为氧化反应,![]() 在浓硫酸条件下与甲醇反应生成
在浓硫酸条件下与甲醇反应生成![]() 的反应类型为酯化反应。
的反应类型为酯化反应。
(4)![]() 在浓硫酸条件下与甲醇反应生成
在浓硫酸条件下与甲醇反应生成![]() 的反应方程式为
的反应方程式为![]() + CH3OH
+ CH3OH![]()
![]() + H2O。
+ H2O。
(5)能够发生银镜反应说明含有醛基,CH3COCH3含有醛基的同分异构体的结构简式是CH3CH2CHO。
欢迎访问“”——