 四川省乐山市2018届高三第一次调查研究考试
四川省乐山市2018届高三第一次调查研究考试
理综化学
可能用到的相对原子质量:H-1 O-16 A1-27 S-32 Fe-56 Cu-64
7、化学与生产、生活密切相关,下列物质的性质和用途均正确且有因果关系的是
| 选项 | 用途 | 性质 |
| A | 糖类、油脂、蛋白质均能水解 | 供给人体营养 |
| B | 维生索C易被氧气氧化 | 可用作食品抗氧化剂 |
| C | Fe3+具有氧化性 | 硫酸铁可用作净水剂 |
| D | SO2具有漂白性 | 可用SO2漂白食品 |
8、下列说法正确的是
A.面巾纸的主要成分属于高分子化合物
B.酸性高锰酸钾溶液和溴水都既能鉴别出甲烷和乙烯,又能除去甲烷中混有的乙烯并经干燥得到纯净气体
C.3一氯戊烷的同分异构体共有6种
D.甲烷和Cl2的反应类型与乙烯和Br2的反应类型相同
9、下列实验方案能达到实验目的的是
| 选项 | 实验目的 | 实验方案 |
| A | 证明Mg(OH)2 沉淀可以转化为Fe(OH)3 | 向2mL1mol/LnaOH溶液中先加入
3滴1mol/L MgCl2溶液,再加入3滴1mol/LFeCl3 |
| B | 比较氯和碳的非金属性强弱 | 将盐酸滴入碳酸氢钠溶液中 |
| C | 配制100mL1.0mol/LcuSO4溶液 | 将25gCuSO4·5H2O溶于100mL蒸馏水中 |
| D | 验证氧化性:Fe3+>I2 | 将KI和FeCl3溶液在试管中混合后,加入CCL4,
振荡,静置,观察下层液体是否变成紫色 |
10、用NA 表示阿伏加德罗常数的值,下列有关说法正确的是
A.2.0gH182O与D2O的混合物中所含中子数为NA
B.标准状况下,22.4L二氯甲烷的分子数约为NA个
C.1mol H2与足量O2反应生成的H2O中含有的共价健总数为NA
D.在11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4反应中,6mol CuSO4能氧化白磷的分子数为1.1NA
11、短周期元素W、X、Y、Z的原子序数依次增大,W、Z同主族。X2-与Y+离子的电子层结构相同,W的最高价氧化物的水化物为强酸。下列说法错误的是
A.原子半径:X
B.简单氢化物的稳定性:X>W>Z
C.Z的最高价氧化物对应的水化物为弱碱
D.X与Y形成的两种二元化合物中,阴、阳离子数之比均为1:2
12、我国预计在2020年前后建成自己的载人空间站,为循环利用人体呼出的CO2 并提供氧气。我国科学家设计了一种装置(如图所示),实现“太阳能→电能→化学能”转化,总反应为2CO2=2CO+O2,下列有关说法不正确的是

A.该装置属于电解池
B.X极发生氧化反应,Y极发生还原反应
C.人体呼出的水蒸气参与Y极反应:CO2+H2O+2e-=CO+2OH-
D.X极每产生标准状况下22.4L气体,有2mol的OH-从Y极移向X极
13、常温下,向20mL 0.0lmol/L CH3COOH 溶液中逐滴加入0.01mol/L的NaOH溶液,溶液中水电离出的c(H+)随加入NaOH溶液的体积变化示意图如图所示,下列说法不正确的是
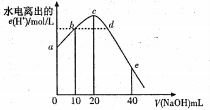
A.从a到c,醋酸的电离始终受到促进
B.b、d两点溶液的pH相同
C.c点所示溶液中c(Na+)>c(CH3COO- )>c(OH- )>c(H+ )
D.c 点所示溶液中,c(Na+)=2c(CH3COO- )+2c(CH3COOH)
27、(14分)纳米材料一直是人们研究的重要课题,例如纳米级Fe粉表面积大,具有超强的磁性,高效催化性等优良的性质。
I、实验室采用气相还原法制备纳米级Fe,其流程如图所示:
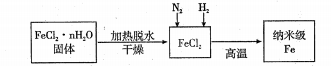
- 纳米级Fe和稀盐酸反应的离子方程式为__________。
- 如何将FeCl3·nH2O固体加热脱水制得无水FeCl2_______(用简要文字描述)。
- 生成纳米级Fe的化学方程式为_________________。
II:查阅资料:在不同温度下,纳米级Fe粉与水蒸气反应的固体产物不同,温度低于570℃时生成FeO,高于570℃时生成Fe3O4。甲同学用如图甲装置所示进行纳米级Fe粉与水蒸气反应的实验,乙同学用图乙所示的装置进行纳米级Fe粉与水蒸气的反应并验证产物。
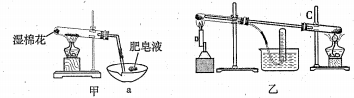
- 甲装置中纳米级Fe粉与水蒸气反应的化学方程式是_______________。
- 甲装置中仪器a的名称为________________。
- 乙同学为探究实验结束后试管内的固体物质成分,进行了下列实验:
| 实验步骤 | 实验操作 | 实验现象 |
| I | 将反应后得到的黑色粉末
X(假定为均匀的),取出少量
放入另一试管中,加入少量盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;
有少量气泡产生 |
| II | 向实验I得到的溶液中滴
加几滴KSCN溶液,振荡 | 溶液没有出现红色 |
根据以上实验,乙同学认为该条件下反应的固体产物为FeO。
丙同学认为乙同学的结论不正确,他的理由是______(用简要文字措述)。 - 丁同学称取5.60gFe粉,用乙装暨反应一段时间后,停止加热。将试管内的固体物质在干燥器中冷却后,称得质量为6.88g,则丁同学实验后的固体物质中氧化物的质量分数为____(结果保留三位有效数字)。
28.(15分)氮及其化合物在工农业生产生活中有着重要应用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。
- 已知:N2(g)+O2(g)==2NO(g) △H =+180.5kJ·mol-1
C(s)+O2(g)=CO2(g) △H =-393.5kJ·mol-1
2C(s)+O2(g)=2CO(g) △H =-221kJ·mol-1
若某反应的平衡常数表达式为:k=[c(N2)·c2(CO2)]/[c2(NO)·c(CO)],请写出此反应的热化学方程式_______。 - N2O6在一定条件下可发生分解:2N2O6(g) 4NO2(g)+O2(g),某温度下测得恒容密闭容器中N2O6浓度随时间的变化如表:
| t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
| C(N2O6)/(mol/L) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
①反应开始时体系压强为p0,第3.00 min时体系压强为p1,则p1:p0=_______;2min~5.00min 内,O2 的 平 均反应速率为_____________。
②一定温度下,在恒容密闭容器中充人一定量N2O6进行该反应,能判断反应已达到化学平衡状态的是___。
a.NO2 和O2 的浓度比保持不变 b.容器中压强不再变化
c.2v正(NO2)= v逆(N2 O6 ) d.气体的平均相对分子质量为43.2,且保持不变 - 将2molN2 和4mo1H2 置于lL的恒容密闭容器中反应。测得不同温度、不同时间段内合成NH3 反应中N2 的转化率,得到数据如下表:

表中a、b、25%三者由大到小的顺序为_____,理由是_____。 - 将(3)中实验得到的混合气体通入醋酸溶液中并恢复到25℃,当两者恰好反应时,生成的CH3COONH4溶被呈中性,则25℃时NH3·H2O的电离平衡常数Kb=______(已知:25℃时0.18mol/LCH3COOH 溶液中c(H+)=1.8×10-3mol/L)。
29、(14分)以铬铁矿(主要成份为FeO·Cr2O3,还含有Al2O3、MgO等杂质)为主要原料生产二水合重铬酸钠(Na2Cr2O7·2H2O),其主要工艺流程如下图所示。
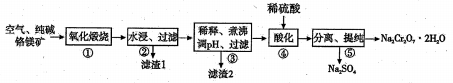
回答下列问题:
- 二水合重铬酸钠(Na2Cr2O7·2H2O)中Cr的化合价为________________。
- 已知:步骤①中涉及的主要反应是FeO·Cr2O3+Na2CO3+O2
 Na2CrO4+Fe2O3+CO3( 未配平),该反应中氧化剂和还原剂的物质的量比为_____________。
Na2CrO4+Fe2O3+CO3( 未配平),该反应中氧化剂和还原剂的物质的量比为_____________。 - 滤渣1的主要成分为MgO和_____(填化学式);滤渣2的成分是______(填物质名称)。
- 步骤④,向滤液中加入稀硫酸,溶液由黄色变为橙色,得到Na2Cr2O7和Na2SO4的混合溶液,发生反应的离子方程式为_______________。
- 经步骤④酸化后的溶液中获得Na2Cr2O7·2H2O晶体的操作依次是蒸发浓缩、____、过滤、洗涤、干燥。
- 该工艺的酸性废液中含有Cr2O72-,可向废液中加入绿矾(FeSO4·7H2O)还原处理。若处理20m3的Cr2O72-酸性废液,需要绿矾166.8g,则原废液中Cr2O72-的物质的量浓度为_____mol /L。
30、(15分)铝(熔点660℃)是一种应用广泛的金属,工业上用Al2O3(熔点2045℃)和冰晶石(Na3AlF6,六氟合铝酸钠)混合熔融后电解制得。回答下列问题:
- 铝属于活泼金属却能在空气中稳定存在,原因是____(用化学用语及相关文字说明)。
- 将0.1mo/LalCl3溶液和10%NH4F溶液混合制取Na3AlF6。该实验所用试管及盛装NeF溶液的试剂瓶均为塑料材质,原因是____(用离子方程式表示)。
- 下列关于氧化铝的叙述正确的是_____。
A.氧化铝可以治疗胃酸过多 B.氧化铝因为熔点高,可以作耐火材料
C.氧化铝是铝热剂的成分之一 D.氧化铝是天然蓝宝石的主要成分 - 以Al 和NiO(OH)为电极,NaOH 溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是________。
- 某工厂排放出有毒物质NOC1,它遇水就会生成NO3-。NOCl 分子中各原子均满足8电子稳定结构,则NOCl的电子式为____。水源中的NO3-对人类健康会产生危害,为了降低水源中NO3-的浓度,有研究人员建议在碱性条件下用铝粉将NO3-还原为N2,该反应的离子方程式为____。

一、选择题
7-13:BADACDB
27、(14 分)
(1)Fe+2H+=Fe2+ + H2 ↑(2分)
(2)在干燥的HC1气流中加热(2 分)
(3)FeCl2+H2 Fe+2HCl(2 分)
Fe+2HCl(2 分)
(4)Fe+H2O(g)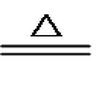 FeO+H2(2 分)
FeO+H2(2 分)
(5)燕发皿(2分)
(6)加入KSCN溶液,溶液没有出现红色,也可能是因为Fe过量,与生成的Fe3+反应转化为Fe2+(2 分)
(7)67.4%(2 分)
28、(15 分)
- 2NO(g)+ 2CO(g) N2(g)+2CO2(g) △H =-746.5kJ·mol-1(2 分)
- ①1.975:1(2 分) 0.055 mol·L-1·min-1 (2分) ②2b(2 分)
- 25%>a=b(2分);升高温度,化学反应速率加快,在小于3h时已达平衡,故a=b。又因该反应正向放热,升温平衡逆向移动N2 的转化率下降,故25%>a=b。(2分)
- 1.8×10-5mol/L(3 分)
29、(14分)
- +6 (2分) (2)7 :4 (2 分) (3)Fe2O3(2 分);Al(OH)2(2 分)
(4)2H++2CrO42-2H2O + Cr2O72-(2 分)
(5)冷却结晶(2分) (6)5×10-6(2分)
30、(15 分)
- 4Al+3O2=2Al2O3,在空气中铝的表面能够形成一层致密的氧化膜(3分)
- F-+H2OHF+OH-(2 分)
- BD(2 分)
- Al+3NiO(OH)+H2O==NaAlO2+3Ni(OH)2(3 分)
 (2分);10Al+6NO3-+4OH-==3N2+10AlO2-+2H2O (3 分)
(2分);10Al+6NO3-+4OH-==3N2+10AlO2-+2H2O (3 分)
欢迎访问“”——

![]() 四川省乐山市2018届高三第一次调查研究考试
四川省乐山市2018届高三第一次调查研究考试






![]() Fe+2HCl(2 分)
Fe+2HCl(2 分)![]() FeO+H2(2 分)
FeO+H2(2 分)