
湖南省醴陵二中、醴陵四中2016-2017学年高二下学期期中联考化学试卷
03月05日
![]() 舒城一中2018届高三寒假模拟(二)
舒城一中2018届高三寒假模拟(二)
理科综合试卷化学部分
第I卷
注意事项
可能用到的相对原子质量:H-1 C-12 N-14 O-16Na-23 Mg-24 Si-28 P-31
Cl-35.5 Ti-48 Fe-56
一、选择题:本题共13小题,在每小题所给的四个选项中,只有一项是符合题目要求的。
7. 化学与生活、社会密切相关。下列说法正确的是( )
A.加碘盐的溶液遇淀粉变蓝B.汽油和乙烯均为石油分馏得到的产品
C.CaO可用作工业废气的脱硫剂D.蔗糖、淀粉、油脂水解均能生成电解质
8. 下列各组离子在指定溶液中均能大量共存的是( )
A.含有大量Fe2+的溶液:Na+、SO42+、NH4+、Fe(CN)63-
B.使甲基橙变红的溶液:NH4+、CH3COO-、SO42+、Mg2+
C.某无色溶液:OH-、K+、ClO-、Ba2+
D.含有大量NO3-的溶液:K+、I-、NH4+、H+
9. 设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,1L C2H5OH完全燃烧后生成的CO2分子个数约为NA/11.2
B.将lmol Cl2通人水中,HC1O、Cl-、C1O-粒子数之和为2NA
C.含3.0g HCHO的水溶液中原子总数为0.4NA
D.3.4gNH3中共用电子对数为0.6NA
10.25℃时,用蒸馏水稀释1 mol/L醋酸,下列各项始终保持增大趋势的是( )
A.![]() B.
B.![]() C.
C.![]() D.c(H+)·c(CH3COO-)
D.c(H+)·c(CH3COO-)
11.X、Y、Z、W是原子序数依次增大的四种短周期元素。Y和Z位于同一周期,可组成中学常见的共价化合物YZ和YZ2,X和Z的原子最外层电子数之和等于W的原子最外层电子数,25℃时0.01mol/L X和W形成化合物的水溶液pH为2。下列说法正确的是( )
A.Y元素含氧酸的酸性比W的弱
B.Z和W在自然界均能以游离态存在
C.YZ和YZ2均可以被NaOH溶液吸收
D.X和Y能形成既含极性键又含非极性键的分子
12.近年我国科学家在青蒿素应用领域取得重大进展,如利用下述反应过程可以制取治疗疟疾的首选药青蒿琥酯。下列有关说法正确的是( )
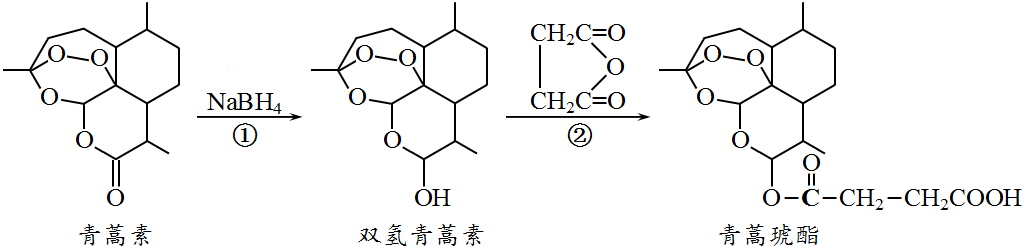
A.青蒿素分子中所有碳原子在同一平面内
B.反应①属于还原反应,反应②理论上原子利用率可达100%
C.双氢青蒿素属于芳香化合物
D.青蒿琥酯可以发生水解、酯化以及加聚反应
13.利用图示装置进行实验,若装置I中反应物充足,则装置II中实验现象正确的是( )
| ① | ② | ③ | Ⅱ | 实验装置 | |
| A | 浓盐酸 | 碳酸钙 | 滴有酚酞的稀碳酸钠溶液 | 溶液由红色最终变为浅红色 |  |
| B | 浓氨水 | 氧化钙 | 氯化铝溶液 | 先产生白色沉淀,后沉淀溶解 | |
| C | 冰醋酸 | 乙醇 浓硫酸 | 饱和碳酸钠溶液 | 溶液分层,上层为油状液体 | |
| D | 浓硝酸 | 铜 | 硅酸钠溶液 | 有胶状物生成 |
27.(15分)硫酸亚铁铵[(NH4)2Fe(SO4)2]是一种重要的工业原料,能溶于水,不溶于乙醇,其工业制法如下。请回答:

(1)步骤①中碱液洗涤的目的是____________________。若将碱液换为酸液,可能产生的问题是____________________。
(2)步骤②中B可以是_________(填字母),加人少量B的目的是_____________________。
a.CuCl2b.CuOc.Cu(NO3)2d.CuSO4
(3)步骤⑥中要用到少量乙醇洗涤,其目的是____________________________________。
(4)用硫酸亚铁铵晶体配制溶液时,需加入一定量硫酸,目的是_______________________。工业上常用酸性KMnO4溶液通过滴定的方法测定硫酸亚铁铵样品的纯度,反应的离子方程式为________________________________________________。准确量取硫酸亚铁铵溶液时,硫酸亚铁铵溶液应盛放于_________(填“酸式”或“碱式”)滴定管中。
(5)硫酸亚铁铵晶体的样品中可能含有的杂质离子是_____________,实验室的检验方法是________________________________________________。
28.(14分)氨分解产生的氢气可作为燃料供给氢氧燃料电池,这是极具吸引力的燃料电池供氢方法。
(1)已知:1molH-H键、lmo1N-H键、1molN≡N键断裂时分别需要吸收436kJ、39IkJ、946kJ的能量,则氨分解反应2NH3(g) N2(g)+3H2(g)的ΔH=________________。
(2)向体积均为2L的容器A和B中同时分别充入2molNH3(两容器装有催化剂)发生上述反应。在反应过程中,A保持温度和容积不变;B保持温度和压强不变。
①反应2分钟后,A容器内压强变为原来的1.2倍,则2分钟内用氨气表示的平均反应速率为_____________mol/(L·min)。
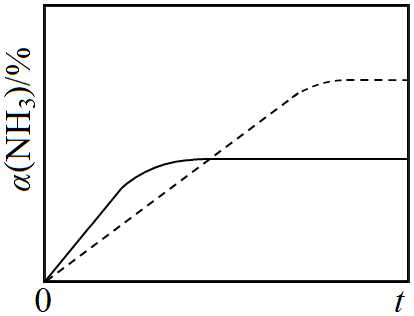
②图1为A容器中NH3的转化率随时间变化的α(NH3)-t曲线,请在图1中画出B容器中相应α(NH3)-t曲线的示意图,并简要说明理由___________________________________。
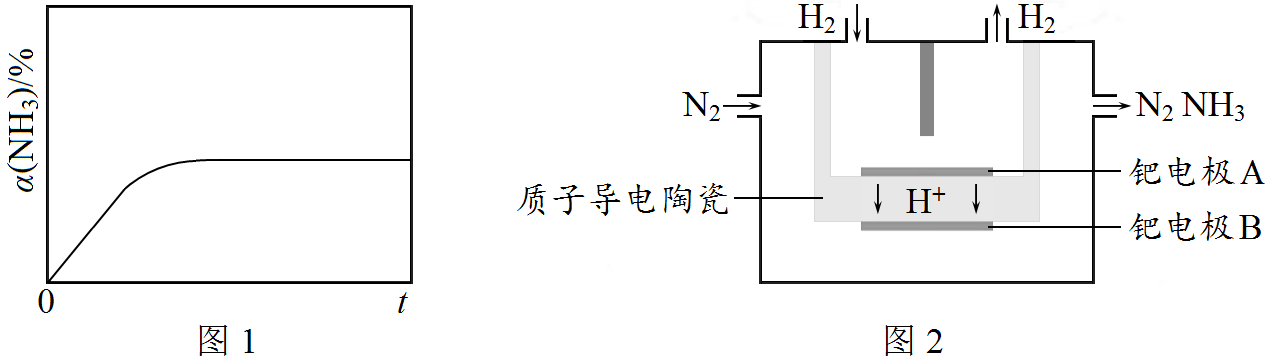
(3)利用图2实验装置可以合成氨,钯电极B的电极反应式为________________________。
(4)室温时,将cmol/L HF溶液与0.01mol/L NaOH溶液等体积混合,反应后溶液呈中性,则HF的电离常数Kα=_____________(请用含c的代数式表示).
(5)肼(N2H4)的性质类似于NH3,可与水反应生成一种二元弱碱N2H4·2H2O,其水溶液显示碱性的原因是_________________________________________(用电离方程式表示)。
29.(14分)Na2SO3是一种重要的化工原料,但较易变质。
(1)某小组同学欲在实验室测定某Na2SO3样品的纯度,利用下列装置进行实验。

方案一:选择装置①和③进行实验时,为使结果更精确还应选择装置______________,装置①的分液漏斗中添加______________(填物质名称)较理想;装置①中反应前后通入N2的目的是__________________________________________。
方案二:选择装置②和④进行实验时,还应选择装置______________,此装置中应盛装______________(填物质名称),装置②中a管的作用是__________________________。
(2)将20.0g Na2SO3固体溶于120mL水配成溶液,再将足量硫粉用少许乙醇和水浸润,加入上述溶液,混合加热可制得Na2S2O3。
①硫粉用少许乙醇和水浸润的目的是______________(填字母)。
A.增加反应体系的pHC.降低反应的活化能
B.增大反应物接触而积D.加快反应速率
②已知:70℃时,Na2S2O3的溶解度为212g,饱和溶液的密度为1.17g/cm3。设Na2SO3完全反应,将上述反应液经过滤、蒸发、浓缩后,冷却至70℃时,溶液恰好达到饱和,请列式计算此时溶液的体积约为________________________。(结果精确到0.1)
30.从下面两题中任选一题作答
【化学——选修3:物质结构与性质】(15分)
铁、钴、镍等金属及其化合物在工业上有重要用途。请回答:
(l)基态Fe3+的M层电子排布式为________________________。
(2)配合物Fe(CO)n常温下为液态,推测其晶体属于______________(填晶体类型)。写出两种与配体CO互为等电子体的离子_____________________(填化学式)。
(3)Co2+、Co3+都能形成配离子。用KCN处理含Co2+的盐溶液,生成的[Co(CN)6]4-有强还原性,加热时能与水反应生成[Co(CN)6]3-,该反应的离子方程式为__________________________;Co3+的另一种配合物Co(NH3)5BrSO4溶于水,加入BaCl2溶液无明显现象,该化合物在水中的电离方程式为__________________________。
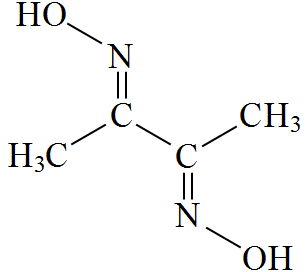
(4)自然界的镍矿中含有大量氧化镍,其晶体结构与NaCl相同,该晶体中Ni2+的配位数为________;实验室常利用丁二酮肟检验Ni2+,其结构如图,分子中σ键与π键的数目比为___________,其中碳原子的杂化类型为_________________。
(5)金属镍为面心立方最密堆积,密度为ρg/cm3,镍的原子半径是_________________(用字母表示)。
【化学——选修5:有机化学基础】(15分)
阿斯巴甜(APM)是一种较适合糖尿病患者食用的蔗糖代替品,其一种合成路线如下,其中A、B、C、D、E均为有机物,部分反应条件和产物已略去。

已知:①A是由C、H、O三种元素组成的二元羧酸,相对分子质量为116,其羧基连接在不同碳原子上,且核磁共振氢谱有两个面积相等的吸收峰。
②C、D所含官能团相同;D为单取代芳香化合物,是大豆蛋白水解的最终产物之一,其分子式为C9H11NO2,且分子中不含甲基。
回答下列问题:
(1)A的分子式为_________________,结构简式为_________________。
(2)反应①的化学方程式为__________________________________。C中所含官能团的名称为_________________。
(3)D通过酯化反应生成E,反应的化学方程式为__________________________________。
(4)APM是一种二肽,上述过程中APM可能的结构简式为________________________________和________________________________。
(5)D物质的同分异构体有多种,能同时满足下列条件的共有___________种(不含立体异构)。
①苯环上有两个取代基②分子中含有硝基
参考答案
理综(二)
化学部分:7~13:C C D A D B D
27.(15分)
28.(14分)
 (1)+92kJ/mol(2分)
(1)+92kJ/mol(2分)
(2)①0.1(2分) ②如右图(2分)
B容器体积增大,反应过程中压强较A小,反应速率慢,平衡正向移动,NH3转化率大(2分)
(3)N2+6H++6e-=2NH3(2分) (4)![]() (2分)
(2分)
(5)N2H4·2H2ON2H5·H2O++OH-(2分)
29.(14分)
30.选修题
【化学―选修3:物质结构与性质】(15分)
(1)3s23p63d5(1分) (2)分子晶体(1分) CN-、C22-(2分)
(3)2[Co(CN)6]4-+2H2O![]() 2[Co(CN)6]3-+H2↑+2OH-(2分)
2[Co(CN)6]3-+H2↑+2OH-(2分)
Co(NH3)5BrSO4=[Co(NH3)5SO4]++Br-(2分)
(4)6(1分) 15︰2(2分) sp2和sp3(2分) (5)![]() (2分)
(2分)
【化学―选修5:有机化学基础】(15分)
(1)C4H4O4(1分) HOOC-CH=CH-COOH(2分)
(2)HOOC-CH=CH-COOH+3NH3![]() H4NOOCCH(NH2)CH2COONH4(2分)
H4NOOCCH(NH2)CH2COONH4(2分)
氨基、羧基(2分)
(3)![]() (2分)
(2分)
(4)![]() (2分)
(2分)
![]() (2分)
(2分)
(5)15(2分)
欢迎访问“”——