
湖南省醴陵二中、醴陵四中2016-2017学年高二下学期期中联考化学试卷
03月05日


7.化学与生产和生活密切相关,下列有关说法正确的是
A.刚玉硬度仅次于金刚石,熔点也相当高,刚玉坩埚可用于熔融KHSO4
B.CO2是大量使用的灭火剂,但着火的镁条在CO2中继续燃烧说明它也可以助燃
C.人血清中的血浆铜蓝蛋白相对分子质量为151000,是人工合成的高分子化合物
D.三氯化铁易形成水合晶体,加热Fe2O3·6H2O晶体,可获得纯净的FeC13
8.设NA为阿伏加德罗常数的值,下列说法正确的是
C.2.0gH218O与D2O的混合物中所含中子数为NA
D.密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA
9.下列有关有机物说法不正确的是
A.CH3CH(OH)CH2COOH系统命名法命名3-羟基丁酸
B.四苯基乙烯(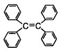 )中所有碳原子一定处于同一平面
)中所有碳原子一定处于同一平面
C.lmol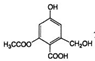 分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种违章的物质的量分别是3mol、4mol、1mol
分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种违章的物质的量分别是3mol、4mol、1mol
D.在一定条件下,苯与液溴、浓硝酸生成溴苯、硝基苯的反应都属于取代反应
l0.高铁电池是一种可充电电池,其设计图如下所示:负极材料是Zn,氧化产物是Zn(OH)2,正极材料是K2FeO4(易溶盐),还原产物是Fe(OH)3,电解质溶液是KOH水溶液。下列有关说法正确的是
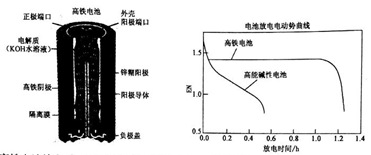
A.高铁电池放电时正极反应为:Zn+2OH--2e-=Zn(OH)2
B.高铁电池充电时阴极反应为Fe(OH)3+5OH--3e-=FeO42-+4H2O
C.高铁电池放电时的总反应为:2FeO42-+8H2O+3Zn=2 Fe(OH)3+3 Zn(OH)2+4OH-
D.高能碱性电池比高铁电池工作电压更稳定
11.用0.1000mol/L的标准盐酸分别滴定20.00 mL的0.1000mol/L氨水和20.00mL的0.1000mol/L氢氧化钠溶液的滴定曲线如图所示,横坐标为滴定百分数(滴定用量/总滴定用量),纵坐标为滴定过程中溶液pH,甲基红是一种酸碱指示剂,变色范围为4.4-6.2,下列有关滴定过程说法正确的是
A.滴定氨水溶液当滴定分数为50%时,各离子浓度间存在关系:c(NH4+)+c(H+)=c(OH-)
B.滴定分数为100%时,即为滴定过程中反应恰好完全的时刻
C.从滴定曲线可以判断,使用甲基橙作为滴定过程中的指示剂准确性更佳
D.滴定氨水溶液当滴定分数为150%时,所得溶液中离子浓度有大小关系c(Cl-)>c(H+)
12. a、b、c、d为四种短周期元素,a的原子M电子层有l个电子,b是地壳中含量最多的金属元素,c的最高化合价为最低化合价绝对值的3倍,c与d同周期,d的原子半径小于c。关于这四种元素下列叙述错误的是
C.a是短周期中金属性最强的元素
D.工业上是通过电解b、d形成的化合物制取b单质
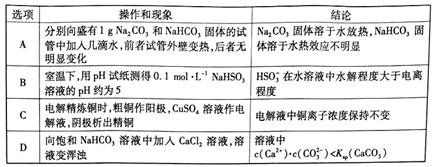
l3.根据下列操作和现象所得到的结论正确的是
26.(14分)
硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]是透明、浅蓝绿色晶体,易溶于水而不溶于酒精等有机溶剂,在空气中一般比较稳定,不易被氧化。制备步骤如下:
步骤1.称取还原铁粉0.4g,炭粉0.3g,放入50mL 锥形瓶中,加入3.5 mL2mol·L-1硫酸置于60℃ 热水浴中加热(如下左图),待反应完全,取出冷却,再加入6 mol·L-1的硫酸2 mL。
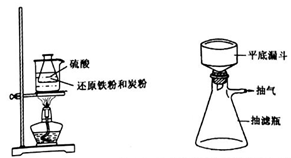
步骤2.在上述反应液中加入浓氨水0.8 mL,振荡混匀,抽滤(如上右图)。向滤液中加入10mL无水乙醇,静置,大量晶体析出,倾析,再次抽滤。
步骤3.取出晶体,用干净的滤纸吸干,称量并分析样品。
请回答下列问题:
(1)步骤1中炭粉的作用是_______,加人6 mol·L-1硫酸的作用是____________。
(2)向滤液中加人无水乙醇目的是_________________。
(3)产品中金属阳离子的检验方法及现象________________。
(4)称取获得的硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](摩尔质量为392g·mol-1)1.9600 g 配成100mL溶液,取出20.00mL滴加稀H2SO4酸化后用0 . 0100 mol·L-1KMnO4标准溶液进行滴定,消耗KMnO4溶液为18.00mL 。
下列有关滴定的操作正确的是_(填字母编号)。
a.滴定过程中眼睛注视滴定管中液面变化
b.滴定完成后取下滴定管握住中部防止掉落
c.读数过程中保持滴定管自然悬垂
d.读数时视线与刻度线、凹液面最低处切线相平齐
滴定过程中反应离子方程式为____________,制得硫酸亚铁钱样品的纯度为__________。
27.(14分)
2016年10月17日7点30分,神舟十一号载人飞船发射升空。制造航天飞船的主要材料是铝,工业上制铝时用冰晶石(Na3AlF6)做助熔剂,冰晶石制备流程有如下两种:
方案一:以纯碱和萤石(CaF2)为主要原料
![]()
方案二:以碳酸氢铵和六氟合硅酸为主要原料
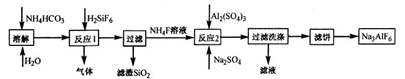
(1)方案一中B可作为建筑材料,化合物A 是________,写出由C制备冰晶石的化学方程式____________________________。
(2)方案二中反应1产生的气体是_____________,反应2后滤液中主要成分的用途_________。
(3)方案二中反应2化学方程式________________________。
(4)工业电解制铝的阴极反应式为_________________,以石墨为电极维持电流180千安电解5小时生成铝270千克,则电流效率η(η=实际产量/理论产量)为_______。(法拉第常数F = 96500 C·mol-1)
28.(15分)
NOx会引起光化学烟雾等环境问题,在催化剂存在条件下,以NH3或尿素将尾气中NOx
还原为N2的技术,即NH3或尿素-SCR技术,是去除NOx最为有效且应用最广的技术之一,其中最重要的催化剂体系是钒基催化剂。
(1)NH3去除尾气中的NOx,当v(NO):v(NO2)=l:1时称为“快速SCR 反应”,该反应化学方程式为___________。
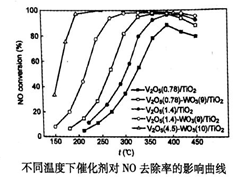
(2)不同钒含量的催化剂(V2O5/TiO2)添加WO3对NO去除率的影响如下图,从图中可以得出其它条件相同时添加WO3,对NO去除率的影响是_____(填“增大”、“减小”或“无影响”)。根据图中所示,随着温度升高NO去除率的变化趋势为_____,该变化趋势的一种可能原因是___________。
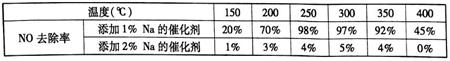
(3)在制备钒基催化剂时,添加的各种成型助剂中碱金属或碱土金属(如Na、K、Ca)能够使催化剂中毒(催化性能下降), K、Ca的毒化作用与Na相似。下列适合做成型助剂有_。$来&源:
A.Li B.Mg C.酸性铝溶胶 D.酸性硅溶胶
请设计实验研究添加金属K对催化剂活性的影响(只需写出实验思路,不需要具体实验
操作)_____________。
(4)在NOx催化去除过程中,NH3储罐存在危险性,更多应用为尿素-SCR技术。在该技术过程中,发生如下两个反应:
① CO(NH2)2=NH3+HNCO
② HNCO(g)+H20(g)====NH3(g)+CO2(g)
在此过程中一分子尿素可以生成两分子NH3,因此尿素被视为是NH3的有效储存源。反应②的平衡常数表达式为_______。目前商用的尿素溶液浓度为32.5%(密度为1.05g/mL),常称为“Ad Blue ”。1L该商用尿素溶液发生“快速SCR反应”, 理论上最多可消除NO和NO2在标准状况下的体积为______L。
35.【选做题-选修3:物质结构与性质】(15分)
Zn(OH)2可溶于氨水生成[Zn(NH3)4]2+: Zn(OH)2+4NH3·H2O=Zn(NH3)4]2++4H2O+2OH-
(1)原子序数比Zn元素小1的元素符号为____,该元素原子基态核外电子排布式为______。
(2)NH3、H2O的沸点均高于同族元素氢化物的沸点,是因为________。
(3)NH3中N原子轨道的杂化类型是______。
(4)与H2O分子互为等电子体的分子为_____。
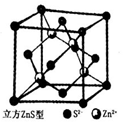
(5)闪锌矿是一种自然界含Zn元素的矿物,其晶体结构属于立方晶体(如右图所示),则在立方ZnS晶体结构中S2-的配位数为________。Zn2+的分数坐标为(l/4,l/4,l/4)、(3/4, 3/4,l/4)、(3/4,l/4,3/4)、(1/4,3/4,3/4),则S2-的分数坐标为______。
36.【选做题-选修5:有机化学基础】(15分)
已知:①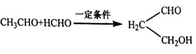 ②
②![]()
现用丙二酸等物质合成含有小环的有机物K,合成路线如下:
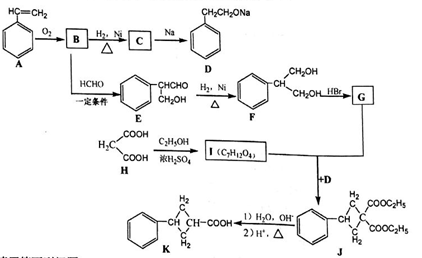
请回答下列问题:
(1)A的名称是_______,E中含氧官能团的名称是_____。
(2)B→C 的反应类型是_______ ,F→G的反应类型是____。
(3)G和I的结构简式分别为_______、________。
(4)写出F和H在一定条件下合成高分子化合物的化学反应方程式:_______。
(5)同时满足下列条件的E的同分异构体数目为_种。
① 能发生银镜反应;② 能发生水解反应,其水解产物之一能与FeCl3溶液发生显色反应。
(6)请写出以H2C=CHCH2Br为原料制备![]() ,参考本题题干写出制备的合成线路流程图(无机试剂任选)。
,参考本题题干写出制备的合成线路流程图(无机试剂任选)。

7-13:BCBCB DA
26.(1)为了形成原电池加快反应速率,加入硫酸抑制Fe2+的水解
(2)降低硫酸亚铁铵的溶解度有利于结晶析出
(3)取少量产品于试管中滴加KSCN无现象,滴加氯水后溶液显红色(取少量产品于试管中加水溶解,滴加氢氧化钠溶液后,有白色沉淀生成,迅速转变为灰绿色,最终变为红褐色或取少量产品于试管中加水溶解,滴加铁氰化钾有蓝色沉淀生成)(其他合理答案也可)
(4)cd, 5Fe2++ MnO4-+8H+ = 5Fe3++Mn2++4H2O, 90%
27.(1)浓硫酸;12HF+3Na2CO3+2Al(OH)3=2Na3AlF6+3CO2+9H2O
(2)CO2;用作氮肥
(3)12NH4Cl+Al2(SO4)3+Na2SO4= 2Na3AlF6↓+(NH4)2SO4
(4)Al3++3e-=Al,89.4%
28.(1)2NH3+NO+NO2= 2N2+3H2O;
(2)增大;减小; ①低温阶段,温度升高反应速率加快导致NO去除率增大;高温阶段,温度升高平衡逆向移动导致NO去除率下降;②低温阶段,温度升高反应速率加快导致NO去除率增大;高温阶段,发生NH3的非选择性氧化NOx反应。③低温阶段,温度升高反应速率加快导致NO去除率增大;高温阶段,催化剂活性下降。(其它合理答案均可)
(3)C、D;分别向催化剂中添加1%K、2%K,并控制与(3)题中相同实验条件下,然后测定不同温度下的NO去除率,绘制成图表。
(4)[c(NH3)・c(CO2)]/[c(HNCO)・c(H2O)];254.8
35.(1)Cu, 1s22s22p63s23p63d104s1(或[Ar]3d104s1) ;(2)NH3、H2O均存在分子间氢键;(3)sp3杂化;(4)H2S;(5)4,(0,0,0),(1/2,1/2,0)、(1/2,0,1/2)、(0,1/2,1/2)。
36.(1)苯乙烯(1分)醛基和羟基(1分)(2)加成反应(或还原反应)(1分)取代反应(1分)
(3)![]() (2分)
(2分)![]() (2分)
(2分)
(4)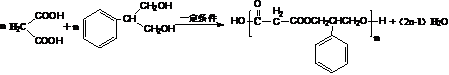 (2分)
(2分)
(5)9(2分)
(6)![]() (3分,每步1分,其它合理答案也可)资*源%库 资*源%库
(3分,每步1分,其它合理答案也可)资*源%库 资*源%库