湖北省沙市中学2018届高三1月月考理综化学试题
- 化学与生产、生活、社会密切相关,下列说法错误的是
A.绚丽缤纷的烟花中添加了含钾、钠、钙、铜等金属元素的化合物
B.臭氧、高锰酸钾溶液、次氯酸钠溶液、乙醇溶液均可用于消毒杀菌,且原理相同
C.食用植物油的主要成分是高级脂肪酸甘油酯,是人体所需营养物质
D.PM2.5 是指大气中直径小于或等于2.5微米的颗粒物,与肺癌等疾病的发生相关
8、标准状况下,下列说法正确的是
A.等体积CH4和HF 所含的电子数相同
B.pH=12 的Na2CO3 溶液中c(OH-)=10-2mol/L
C.2.5gMg-Zn 合金与足量的盐酸反应,放出的气体体积可能为2.24L
D.由H2O2 制2.24LO2 转移的电子数目为0.4NA
9、己知烯烃X 与氢气反应的热化学方程式为X (g)十H2 (g)=Y (g) △H<0,其中烃Y 的键线式为“王”字,下列有关说法不正确的是
A.烯烃X 只有一种结构
B.烯烃X的摩尔质量为126g/mol
C.烃Y的一个氢原子被C4H9取代,所得产物有12 种
D.降温可以使该反应在较短时间内得到更多产物
10、实现下列实验目的,依据下表提供的主要仪器,所用试剂合理的是
| 选项 | 实验目的 | 主要仪器 | 所用试剂 |
| A | 检验石蜡油的分解产物 | 硬质试管、酒精灯 | 石蜡油、石棉 |
| B | 鉴别葡萄糖和蔗糖 | 试管、酒精灯 | 葡萄糖溶液、蔗糖溶液、新制氢氧化铜悬浊液 |
| C | 测盐酸的浓度 | 滴定管、锥形瓶、烧杯 | 标准氢氧化钠溶液、待测盐酸溶液、待测盐酸溶液、石蕊溶液 |
| D | 铝热反应 | 试管、酒精灯 | 铝粉、氧化铁 |
- 质子交换膜燃料电池(简称: PEMFC),又称固体高分子电解质燃料电池,是一种以含氢燃料与空气作用
产生电力与热力的燃料电池,膜极组和集电板串联组合成一个燃料电池堆。目前,尤以氢燃料电池倍受电源研究开发人员的注目。它的结构紧凑,工作温度低(只有80℃),启动迅速,功率密度高,工作寿命长。工作原理如图,下列说法正确的是
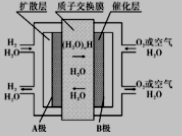
A.可用一氧化碳代替图中氢气形成质子交换膜燃料电池
B.B 极的电极反应式为O2+4H++4e-=2H2O
C.用该电池作为精炼铜的电源时,A 极与粗铜电极相连
D.当外电路中转移0.1mole-时,通过质子交换膜的H+ 数目为0.2NA
12、下表为元素周期表的一部分,其中A、C、D、E 为短周期元素,最外层电子数之和为23,下列说法正确的是
A.元素A 对应的氢化物,常温下一定是气态
B.元素B、E 的原子序数相差19
C.与金属钠的反应中,1molC 原子和1molE 原子得电子数目一定相等
D.A、C、D 均可形成18e-分子
13、已知常温下,几种物质的电离平衡常数,下列反应的离子方程式正确的有几种?| 弱酸 | HCOOH | HCN | H2CO3 | HCIO | 苯酚 |
K
25℃ | K=1.77×10-4 | K=4.9×10-10 | K1=4.3×10-7
K2=5.6×10-11 | K=2.98×10-8 | K=1.1×10-10 |
①向苯酚钠溶液中通入少量的CO2:2C6H5O++CO2+H2O→2C6H5OH+CO32-
②次氯酸钙溶液中通入少 量二 氧 化碳 :Ca2++2ClO-+CO2+ H2O=CaCO3↓ +2HClO
③次氯酸钠溶液中通入少量二氧化碳: 2C1O-+ H2O+CO2=2HClO+CO32-
④次氯酸钠溶液中通入少量二氧化硫: 3ClO-+SO2+H2O=SO42-+2HClO+Cl-
⑤纯碱溶液中滴加少量甲酸: 2HCOOH+CO32-=2HCOO-+ H2O+CO2↑
⑥碳酸钠溶液中通入过量氯气: Cl2+ H2O+2CO32-= 2HCO3-+Cl-+ClO-
⑦NaCN 溶液中通入少量的CO2: CN-+CO2+ H2O=HCO3-+HCN
A.2种 B.3 种 C.4 种 D.5 种
26、(15 分)冬季是流感多发季节,最近我校许多学生得了流感,表现症状为发热头痛等,乙酰苯胺是磺胺类药物具有很好退热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称。其制备原理如下:

己知:①苯胺易被氧化:
②乙酰苯胺、苯胺和醋酸的部分物理性质如下表:| 物质 | 熔点 | 沸点 | 溶解度(20℃) |
| 乙酰苯胺 | 114.3℃ | 305℃ | 0.46 |
| 苯胺 | -6℃ | 184.4℃ | 3.4 |
| 醋酸 | 16.6℃ | 118℃ | 易溶 |
注: 刺形分馏柱的作用相当于二次蒸馏,用于沸点差别不太大的混合物的分离。
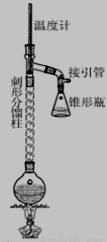
实验步骤如下:
步骤1: 在50mL烧瓶中加入9mL(0.10mol)苯胺、15mL(0.27mol)冰醋酸及少许锌粉,依照上图装置组装仪器。步骤2: 控制温度计示数约105℃,小火加热回流1h。
步骤3: 趁热将反应混合物倒入盛有100mL冷水的烧杯中,冷却后抽滤,洗涤,得到粗产品。
步骤4: 将步骤3所得粗产品进一步提纯后,称得产品质量为10.8g。
请回答下列问题:
(1) 步骤1中加入锌粉的作用是________________________________。
(2) 步骤2 加热可用_________________ (填“水浴”或“油浴”)
(3) 锥形瓶所接的蒸馏物是______________(填化学式)。实验这样设计的目的是__________________。
(4) 步骤2中,控制温度计读数在105℃左右的原因_______________,得到的粗产品需进一步提纯,该提纯方法是________________________________________________________。
(5) 纯净的乙酰苯胺为无色片状晶体,对无色片状晶体进行干燥,判断晶体干燥完全的实验方法是___________________________________________。
(6) 请计算所得到乙酰苯胺的产率是_________________________________________________。
27、(14 分) 我国钒钛磁铁矿分布广泛,储量丰富,不仅是铁的重要来源,其中伴生的钛、钒、铝等多种成分还具有很高的利用价值。其尾矿是工业提取钛的重要来源
I.钒钛磁铁矿的尾矿( 主要成分为FeTiO3,还含有少量FeO、Al2O3、SiO2 等杂质) 经选矿后得到钛精矿过一系列反应制得TiO2:
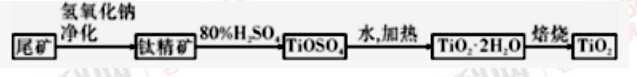
- 氢氧化钠净化尾矿的目的是_________________________________。
- 写出钛精矿中FeTiO3 与80%硫酸溶液反应的化学方程式:______________________________。
II.以TiO2 为原料制备金属钛,流程如下: TiO2→TiCl4→Ti - 已知反应: TiO2(s) 十2Cl2(g) =TiCl4(l) 十O2(g) △H= 十151kJ/mol,但不能由TiO2和Cl2 直接反应(即氯化反应) 来制取TiCl4试解释原因:___________________________________。
- 当往氯化反应体系中加入碳后,使得该反应在高温条件下能顺利制得TiCl4,从化学平衡的角度解释其原因___________________________________________。
- 己知碳的燃烧热394kJ/mol,请写出TiO2 与Cl2、C 反应制取TiCl4的热化学方程式_____________。
III.以TiO2 为原料可以制备Li4Ti5O12(一种锂离子电池的电极材料),过程如下:
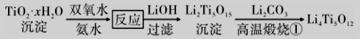
- 不同温度下,TiO2·xH2O 与双氧水、氨水反应达到平衡所得实验结果如下表所示:
| 温度/℃ | 30 | 35 | 40 | 45 | 50 |
| TiO2·xH2O 的转化率 | 80% | 90% | 97% | 93% | 82% |
该过程的理想温度为_______________,分析表中数据,解释TiO2·xH2O 的转化率随温度变化的原因:_______________________________________,该反应的离子方程式为________________________。
28、(14 分) 2017 年5 月18 日,中国国土资源部地质调查局宣布,我国在南海进行的可燃冰试采获得成功,成为全球第一个海域试采可燃冰成功的国家,可燃冰即天然气水合物,甲烷含量占80%至99.9%。化工生产中用甲烷和水蒸气反应得到以CO 和H2为主的混合气体,这种混合气体可用于生产甲醇或合成氨,回答下列问题:
- 对甲烷而言,有如下两个主要反应:
①CH4(g) +1/2O2(g)=CO(g) +2H2(g) △H1=-36kJ·mol-1
②CH4(g) +H2O(g)=CO(g) +3H2(g) △H2=+216kJ·mol-1
若不考虑热量耗散,物料转化率均为100%,最终炉中出来的气体只有CO、H2,为维持热平衡,每生产lmolCO,转移电子的数目为__________。 - 甲醇是一种用途广泛的化工原料,工业上常用下列两种反应制备甲醇:
CO(g) + 2H2(g)= CH3OH(g) △H1=-90kJ·mol-1K1
CO2(g) +3H2(g)= CH3OH(g) +H2O(l) △H2K2
己知: CO(g) + H2O(g) = CO2(g) +H2(g ) △H3=-41.1kJ·mol-1K3
H2O(l)= H2O(g) △H4=+44.0kJ·mol-1K4
则△H2=______ K2=_______ (用含K1、K3、K 4的代数式表示) - 在一恒温恒容密闭容器中充入1molCO2和3molH2模拟工业合成甲醇的反应:
CO2(g)十3H2(g ) CH3OH(g)十H2O(g)
①下列能说明该反应已达到平衡状态的是______________________。
A.混合气体平均相对分子质量不变 B.混合气体密度不变
C.容器内压强恒定不变 D.反应速率满足以下关系: V正(CO2)=3V逆(H2)
E.CO2、H2、CH3OH、H2O物质的量浓度之比为1:3:1:1
F.单位时间内断裂3NAH-H 键的同时形成2molH-O键
②模拟过程中测得CO2和CH3OH(g)浓度随时间变化如图所示,若此时容器内压强为P,则用平衡分压代替平衡浓度表示的化学平衡常数KP为_____________(用含P的代数式表示,数值保留两位小数),若此时再向容器内充入0.25molCO2 和0.25molCH3OH 的混合气体,则平衡______(填“正向“逆向“不”) 移动。(已知: 气体分压=气体总压×体积分数)
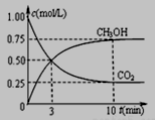
- 甲醇可在电解银催化作用下制甲醛,从贵金属阳极泥中可提取“粗银”“粗银”(含Ag、Cu、Au) 可用电解槽电解精炼,纯银作阴极,采用AgNO3 和稀HNO3 的混合液作电解液,阴极的主要电极反应式为_____。阴极还有少量副反应发生,产生的气体遇空气迅速变为红棕色,该副反应的电极反应式为_______。硝酸浓度不能过大,其原因是___________________________________________。
35、【化学选修3: 物质结构与性质】 (15分)
铝、铁在生活、生产中有着广泛的用途,请回答下列问题。
(1) Fe2+的最外层电子排布式____________。元素Fe 与Mn 的第三电离能分别为I3(Fe )、I3(Mn) ,则
I3(Fe)______I3(Mn) (填“>”、“<")。
(2)第四周期中,与Al原子未成对电子数相同的金属元素有____种。气态氯化铝的分子组成为(AlCl3)2,其中Al、Cl均达8e-稳定结构,Al 原子的杂化方式为__________。根据等电子原理,AlO2-的空间构型为_____。
(3)Fe(CO)5 的熔点为-20℃,沸点为103℃,易溶于乙醚,其晶体类型为______,晶体中σ键和π键的数目之比为______。
(4)科学家们发现某些含铁的物质可催化尿素合成肼(N2H4),沸点:N2H4>C2H6 的主要原因为____________。
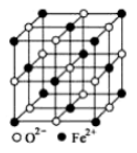
(5)FeO 晶体的晶胞如图所示,己知: FeO 晶体的密度为p g/cm3,NA代表阿伏伽德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为_____;Fe2+与O2-最短核间距为______pm(用p 和NA表示)。
36、【化学选修5: 有机化学基础】(15分)
芳香族化合物A 是一种降血脂药物,A 不能与Na反应。其合成路线如下:
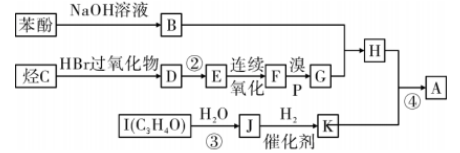
已知:
I.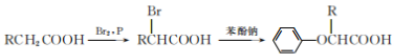
II.RCH==CH2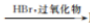 RCH2CH2Br
RCH2CH2Br
III.烃C的核磁共振氢谱只有两组峰,它的质谱图如图所示:
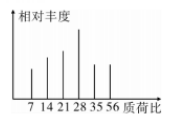
IV.K 的结构具有对称性: I能发生银镜反应且1molI 能与2molH2 发生加成反应。试回答下列问题:
(1) 烃C 的化学名称为_______________________。
(2) H 分子中含有的官能团名称为_____________;反应的条件为____________________。
(3) 写出J 与新制银氨溶液发生反应的化学方程式:______________________________________。
(4) 反应④的化学方程式为:____________________________________________。
(5) 符合下列3 个条件的H 的同分异构体有____ 种,其中氢原子共有五种不同环境的是(写结构简式)__________________________________________。
①能与FeCl溶液显色;②苯环上只有2 个取代基;③1mol 该物质最多可消耗1molNaHCO3。
7-13:BCDBBDB
- (15 分) (1) 防止苯胺被氧化(2分) (2)油浴(1分) (3)H2O; (2 分) 提高产率(2分)
(4)温度过高,未反应的乙酸蒸出,降低反应物的利用率。温度过低,又不能除去反应生成的水。(2 分)
重结晶(2 分) (5)两次所得质量相等(2分) (6)80%(2 分) - (14分) (1) 除去Al2O3、SiO2 等可与氢氧化钠反应的杂质(2 分)
(2)2H2SO4 十FeTiO3 =TiOSO4 十FeSO4 十2H2O (2分)
(3)ΔH>0、ΔS<0得ΔG>0,反应难发生(2 分)
(4)碳与氧气反应,减少了生成物的浓度,平衡正向移动,使得反应顺利进行(1分)
(5)TiO2 (s) 十2Cl2 (g) 十C (s)=TiCl4(s)十CO2 (g) ΔH=-243kJ/mol (2 分)
(6)40℃ (1分) 30℃到40℃温度升高,TiO2·xH2O的转化率提高,说明该反应是放热反应; 40℃到50℃,温度升高,TiO2·xH2O 的转化率降低,因为双氧水不稳定易分解(2分)
5TiO2·xH2O+ 4H2O2+ 2NH3·H2O==Ti5O152-+ 2NH4+ + (5x+5)H2O(2 分) - (14分)
(1)6NA (2 分) (2)-93.0kJ/mol (2 分) K1/K3K4 (1分) (3)A、C(2 分)33.33/P2 (2 分) 正向(1分)
(4)Ag++e-=Ag (1分) NO3-+4H++3e-=NO+2H2O(2 分) 防止生成的银被硝酸溶解
35、(15 分,其余每空2 分)
(1)3s23p63d6(1分)<(1分) (2)4(1分) sp3(1分) 直线形 (1 分)
(3)分子晶体 1:1 (4) 前者可形成分子间氢键,后者只有范德华力
(5) 12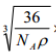 ×1010
×1010
36、(1)2一甲基丙烯(2分) (2)羧基、醚键(1分) 氢氧化钠水溶液、加热(1分)
(3)HO-CH2-CH2-CHO + 2[Ag( NH3)2]OH HO-CH2-CH2-COONH4+ 2Ag↓+ 3NH3+H2O(3 分)
HO-CH2-CH2-COONH4+ 2Ag↓+ 3NH3+H2O(3 分)
(4)2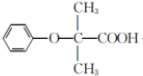 + HOCH2CH2CH2O
+ HOCH2CH2CH2O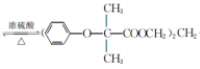 +2H2O(3 分)
+2H2O(3 分)
(5)15种(3分) 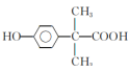 (2分)
(2分)







![]()
![]() RCH2CH2Br
RCH2CH2Br
![]() ×1010
×1010![]() HO-CH2-CH2-COONH4+ 2Ag↓+ 3NH3+H2O(3 分)
HO-CH2-CH2-COONH4+ 2Ag↓+ 3NH3+H2O(3 分)![]() + HOCH2CH2CH2O
+ HOCH2CH2CH2O![]() +2H2O(3 分)
+2H2O(3 分) (2分)
(2分)