
湖南省醴陵二中、醴陵四中2016-2017学年高二下学期期中联考化学试卷
03月05日
芒市第一中学2015秋季学期高一期中考试
化学试卷
班级:__________姓名:_______座位号:________
(命题人:陈志娟 审题人:张建华 时间90分钟 总分100分)
可能用到的相对原子质量:
H:1 C:12 N:14 O:16 Na:23 Cl:35.5 S:32 Cu:64
一.选择题(每小题均有一个选项符合题意,每小题3分,共60分)
C.质量分数(w) D.摩尔质量(M)
3.下列说法正确的是( )
A.摩尔是用来衡量微观粒子多少的一种物理量
B.在一定的温度和压强下,各种气体的摩尔体积相等
C.阿伏伽德罗常数的数值是0.012kg14C所含的原子数
D.若气体摩尔体积为22.4L/mol,则所处条件为标准状况
5、下列关于胶体的叙述不正确的是( )
A.胶 体 区 别 于其 他 分 散 系 的 本质特征是分散质的微粒直径在10-9 m~ 10-7m之间
B.光线透过胶体时,胶体中可发生丁达尔效应
C.用聚光手电筒照射NaCl溶液和Fe(OH)3胶体时,产生的现象相同
D.Fe(OH)3胶体能够吸附水中悬浮的固体颗粒并沉降,达到净水目的
6.由空气中的自由电子附着在分子或原子上形成的空气负离子被称为“空气维生素”,![]()
![]() 就是一种空气负离子,则
就是一种空气负离子,则![]()
![]() 的摩尔质量为( )
的摩尔质量为( )
A.32 g B.32 g/mol C.34 g D.34 g/mol
7、用NA表示阿伏德罗常数,下列叙述正确的是( )
A.标准状况下,22.4LH2O含有的分子数为 NA
B.常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA
C.通常状况下,NA个CO2分子占有的体积为22.4L
D.物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl- 个数为 NA
8.关于2mol二氧化碳的叙述中,正确的是( )
A.体积为44.8L B.质量为88g
C.分子数为6.02×1023D.含有4mol原子
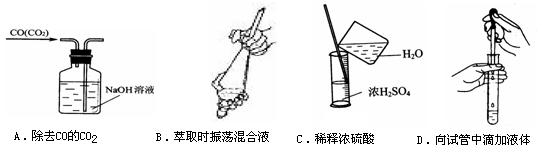
9. 从平时学生实验中我们发现,同学们在进行实验时,出现许多不正确的操作方式,希望同学们在今后的实验中,应该克服不规范的操作。请找出下列图示中正确的实验操作( )
10、某同学在实验报告中记录下列数据,其中正确的是( )
B.用托盘天平称量8.75g食盐
C.用500ml的容量瓶配制450ml溶液
D.用广范pH试纸测得某融合也的pH为3.5
A.溶液 B.悬浊液 C.乳浊液 D.胶体
13.下列属于钠盐的是( )
A.Na2O B.NaOH C.NaHSO4D.Na2O2
14.关于容量瓶的四种叙述:①是配制准确浓度溶液的仪器;②不宜贮存溶液;③不能用来加热;④使用之前检查是否漏水。这些叙述中正确的是( )
A.①②③④ B.②③ C.①②④ D.②③④
15. 将饱和FeCl3溶液分别滴入下列液体中,能形成胶体的是( )
A.冷水 B.沸水 C.NaOH溶液 D.NaCl溶液
16.下列所含原子数最多的是( )
A.7.5gC2H6B.14gN2 C.7gCO D.24gO2
A.200ml 0.1mol/LFeCl3溶液
B.100ml 0.1mol/L MgCl2溶液
C.200ml 0.1mol/L NaCl溶液
D.100ml 0.4mol/L BaCl2溶液
19.在碱性溶液中能大量共存且溶液为无色透明离子组的是( )
C.Na+、H+、NO3-、SO42-D.Fe3+、Na+、Cl-、SO42-
20. 下列叙述正确的是( )
A.同温同压下,相同体积的物质,其物质的量一定相等
B.任何条件下,等体积的甲烷和一氧化碳所含的分子数一定相等
C.1L一氧化碳气体一定比1L氧气的质量小
D.相同条件下的一氧化碳气体和氮气,若体积相等,则质量一定相等
二、填空题(27分)
属于非电解质的是________________________;
导电的是_________________________。(用序号填写)
(2)写出 ⑥⑧反应的离子反应方程式式 。
(3)Al2(SO4)3在水中的电离方程式为 ,1mol Al2(SO4)3溶于水配成250mL溶液,
SO42-的物质的量为
SO42-的粒子数为 ,
SO42-的物质的量浓度为 。
____________(填“是”或“否”,如果“否”,请说明理
由。)原因是:_______________________ _______ ;
步骤③和④可否颠倒____________。
(5)若先用盐酸再进行操作⑤,将对实验结果产生影响,其原因是:
三、实验题(7分)
芒市中学2015秋季学期高一期中考试
化学试卷答案
(命题人:陈志娟 审题人:张建华 时间90分钟 总分100分)
 一、选择题答题栏(共20×3=60分)
一、选择题答题栏(共20×3=60分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | A | B | B | C | C | B | B | B | B | C |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | C | D | C | A | B | A | A | B | B | D |
二.填空题(共27分)
21.(10分)
(1)属于电解质的是__③__⑥__⑦__⑧____⑨_____________;属于非电解质的是______⑤_⑩______;能导电的是_①②_④_________(用字母序号填写)。
(2)⑥⑧反应的离子反应方式H++OH-=H2O。(2分)
(3)Al2(SO4)3= 2Al3++3SO42-(2分)3mol、1.806×1024,4mol/L。,
22.(8分)
(1)D;
(2)、①苯、CCl4、煤油、不能(填“能”或“不能”);
②CCl4、无色、橙色;
③不能、______水与酒精混溶_______。
23.(9分,每空1分)
(9分)(1)取第②步后的上层清液1~2滴于点滴板上(或取少量上层清液于试管中),再滴入1~2滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量(合理答案皆可)
(2)Ca2+ + CO32- = CaCO3↓; Ba2+ + CO32- = BaCO3↓
(3)NaOH 过滤 (4)否;过量的BaCl2必须要用Na2CO3除去,步骤复杂; 是 ;(5)会有部分沉淀溶解,从而影响制得精盐的纯度
三、实验题(共7分)
(3)加速溶解;(4)_保证溶质全部转移到容量瓶______
(5)CD、BE