
湖南省醴陵二中、醴陵四中2016-2017学年高二下学期期中联考化学试卷
03月05日
南安一中2017~2018学年上学期高三年第二次阶段考
化学科试卷
命题者:蒋新征
本试卷考试内容为:化学实验基础知识、元素及化合物、化学家眼中的物质世界、氧化还原反应、离子反应、微观结构与物质的多样性、晶胞、反应原理部分。分第I卷(选择题)和第II卷,共8页,满分100分,考试时间90分钟。
注意事项:
1.答题前,考生务必先将自己的姓名、准考证号填写在答题纸上。
2.考生作答时,请将答案答在答题纸上,在本试卷上答题无效。按照题号在各题的答题区域内作答,超出答题区域书写的答案无效。
3.答案使用0.5毫米的黑色中性(签字)笔或碳素笔书写,字体工整、笔迹清楚(英语科选择题答案使用2B铅笔填涂,如需改动,用橡皮擦干净后,再选涂其它答案标号)。
4.保持答题纸纸面清洁,不破损。考试结束后,将本试卷自行保存,答题纸交回。
可能用到的原子量:Na-23 Cl-35.5 O-16 S-32 Ba-137 Ag-108 C-12 H-1 K—39
N-14 Fe-56 Al-27 Pb-207
第I卷(选择题 共40分)
一.选择题(共20小题,每小题2分,共40分。在每小题给出的四个选项中,只有一个选项符合题目要求)
1.“一带一路”贸易使国外的特色产品走入百姓的日常生活,下列商品的主要成分所对应的材料类型不正确的是( )
| A | B | C | D |
 泰国银饰 |  埃及棉制品 |  捷克水晶饰品 |  土耳其彩瓷 |
| 金属材料 | 天然高分子材料 | 合成高分子材料 | 无机非金属材料 |
2. 下列关于硅及其化合物的说法不正确的是( )
A.高纯硅具有良好的半导体性能,可制成硅芯片、光电池等
B.二氧化硅能与氢氧化钠反应,可用氢氧化钠刻蚀玻璃
C.向硅酸钠溶液中滴加稀盐酸有不溶物生成,实验室可用该方法制备硅酸
D.“硅胶”由硅酸凝胶经干燥、脱水制得,常用作食品、药品等的干燥剂
3. 下列反应原理,错误的是 ( )
A.84消毒液的漂白原理:NaClO+CO2+H2O=NaHCO3+HClO
B. 误食亚硝酸钠会将Fe(II)氧化为铁(III)而中毒,可用维生素C解毒:2NO2-+C6H8O6= C6H6O6+2NO↑+2OH-
C.电子工业常用30%FeCl3溶液腐蚀铜箔:2Fe3++Cu=2Fe2++Cu2+
D.金属钛的冶炼:2Mg+TiCl4![]() 2MgCl2+Ti
2MgCl2+Ti
4.NA表示阿伏伽德罗常数的值,下列说法不正确的是
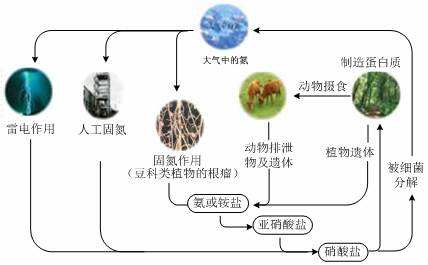
被细菌分解
植物遗体
雷电作用
人工固氮
氨或铵盐
硝酸盐
亚硝酸盐
固氮作用(豆科)
动物排泄物及遗体
物
制造蛋白质
大气中的氮
动物摄食
放电
水浴
加热
a
 9. 右图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法中不正确的有( )
9. 右图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法中不正确的有( )浓氨水
氢氧化钙和氯化铵固体
11. 下面是实验室制取氨气的装置和选用的试剂,其中错误的是( )氧化钙
浓氨水
碱石灰
氯化铵固体
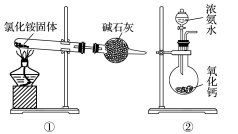
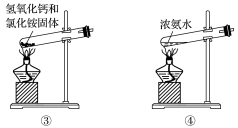
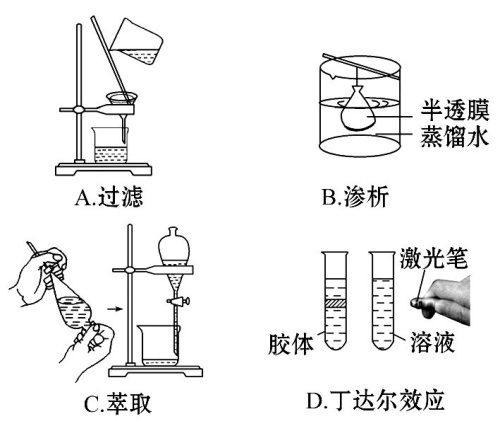 12. 下列实验与物质微粒大小无直接关系的是( )
12. 下列实验与物质微粒大小无直接关系的是( )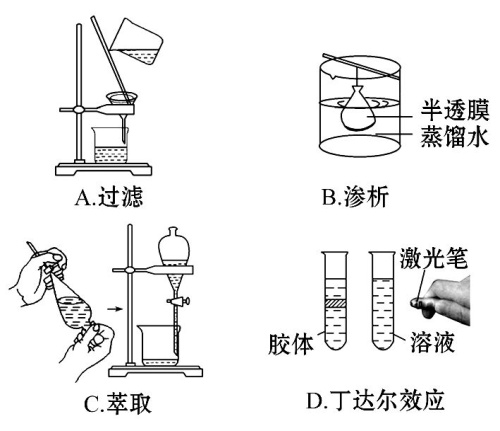
D.丁达尔效应
B.渗析
A.过滤
C.萃取 分液
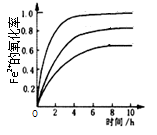 13. 酸性溶液中,Fe2+会被空气缓慢氧化为Fe3+。不同条件下,一定浓度的Fe2+的氧化率随时间变化关系如右图所示。下列有关说法不正确的是( )
13. 酸性溶液中,Fe2+会被空气缓慢氧化为Fe3+。不同条件下,一定浓度的Fe2+的氧化率随时间变化关系如右图所示。下列有关说法不正确的是( ) 14. 已知含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示,则下列判断不正确的是( )
14. 已知含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示,则下列判断不正确的是( )| t/min | 0[] | 1 | 2 | 5 | 10 |
| n(HCl)/mol | 0 | 0.12 | 0.20 | 0.32 | 0.32 |
17. H2O2分解速率受多种因素影响。实验测得70℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是( )
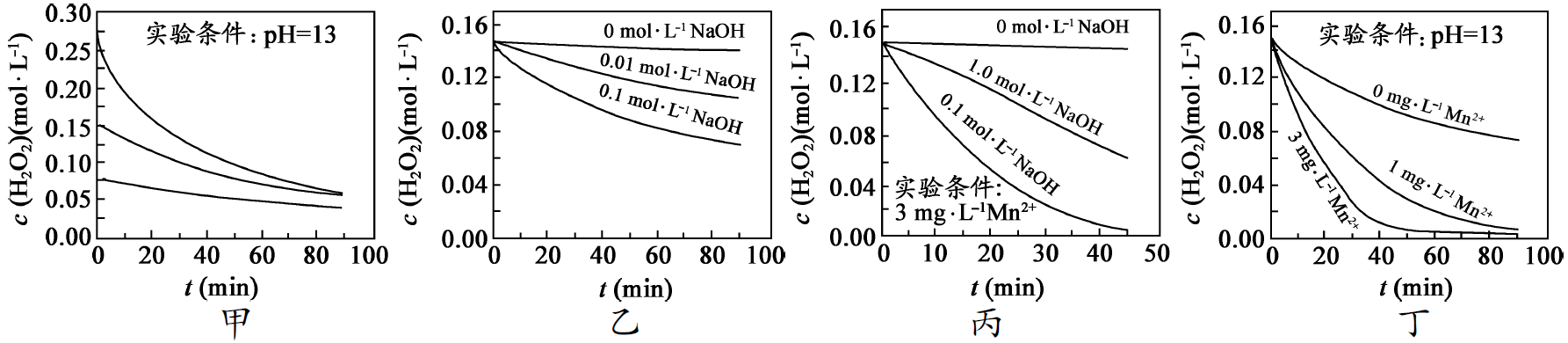
A.图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B.图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
C.图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快
D.图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
18. 碘单质的制备流程如图,下列说法正确的是( )

A.“煮沸”的时间越长,越有利于I-的完全溶解
B.“反萃取、分液”的步骤中发生的氧化还原反应:5I-+IO3-+6H+=3I2+3H2O
C.滴加45%硫酸时,发现溶液上方有紫色气体,说明I-被45%硫酸氧化为I2
D.海带灰中还含有的硫酸盐、硝酸盐、碳酸盐等无机盐在“萃取、分液”的步骤中除去
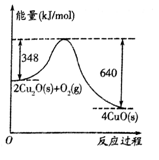 19. 已知:l.0 g C(s)燃烧生成CO放出9.2kJ的热量;氧化亚铜与氧气反应的能量变化如图所示。下列叙述正确的是( )
19. 已知:l.0 g C(s)燃烧生成CO放出9.2kJ的热量;氧化亚铜与氧气反应的能量变化如图所示。下列叙述正确的是( )
A. 足量炭粉与CuO反应生成Cu2O的热化学方程式为:C(s)+2CuO(s)=Cu2O(s) +CO(g) △H=+35.6kJ·mol-1
B. 1mol CuO分解生成Cu2O放出73kJ的热量
C. 反应2Cu2O(s)+O2(g)=4CuO(s)的活化能为292 kJ·mol-1
D. 碳C(s)的燃烧热△H= -110.4kJ·mol-1
20.聚合氯化铝晶体是一种水溶性无机高分子聚合物,其化学式可表示为[Al2(OH)aCl6-b·bH2O]x。为了测定化学式,称取mg晶体粉末,加热至质量不再变化为止,称量为m1g,另取mg晶体粉末,溶于水,加足量硝酸银溶液,过滤,洗涤,烘干,称量为m2g。下列叙述错误的是( )
A.a=b B. 该聚合物的分子量为![]()
C.b = ![]() D. a =
D. a = ![]()
第II卷(非选择题,共60分)
二.本大题共4大题,共60分。
21.(16分) 硫酸亚铁铵的制备。硫酸亚铁铵又称摩尔盐,是浅绿色的晶体,在空气中比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇。
下表为某些物质在水中的溶解度(g/100g):
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| FeSO4·7H2O | 15.65 | 20.51 | 26.5 | 32.9 | 40.2 | 48.6 | … |
| (NH4)2SO4 | 70.6 | 73.0 | 75.4 | 78.0 | 81.0 | … | 88.0 |
| FeSO4·(NH4)2SO4·6H2O | … | 12.5 | … | … | 33.0 | 40.0 | … |
制备流程如图:
(1)根据以上表格分析制备摩尔盐的实验原理是
(2)操作I是 ;
操作II是 ,所使用的热源为水浴加热,操作II需要的仪器除了水浴加热装置外,还有铁架台、铁圈、 (只填一种主要仪器),加热至溶液出现
时,移去热源;
操作III是 。
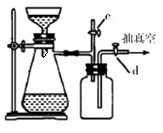 (3)减压过滤操作如图所示:整套装置由布氏漏斗、抽滤瓶、安全瓶构成,抽滤过程中使用抽气泵抽真空前,关闭活塞c,抽滤结束打开活塞c恢复体系压强,抽滤过程还需用 洗涤晶体(填写“a”或“b”或“c”)。
(3)减压过滤操作如图所示:整套装置由布氏漏斗、抽滤瓶、安全瓶构成,抽滤过程中使用抽气泵抽真空前,关闭活塞c,抽滤结束打开活塞c恢复体系压强,抽滤过程还需用 洗涤晶体(填写“a”或“b”或“c”)。
a.95%乙醇水溶液 b.冷水 c.热水
(4)设计实验方案检验产品中NH4+离子
(5)硫酸亚铁铵中铁含量的测定。准确称取摩尔盐0.7995g于250mL锥形瓶中,加入3mol/LH2SO4溶液5.0mL,20.0mL蒸馏水,使试样完全溶解后,立即用0.02000mol/L的酸性KMnO4溶液滴定,至终点时消耗了高锰酸钾溶液20.00mL。
①滴定至终点时出现的现象为
②写出滴定原理的离子反应方程式
③试计算出该摩尔盐的纯度为 %。(保留小数点后2位)
22.(10分)常温下,酸性溶液A中可能含有NH4+、K+、Na+、Fe2+、Al3+、Fe3+、CO32-、NO3-、Cl-、I-、SO42-中的几种,现取该溶液进行有关实验,实验结果如下图所示:

请回答下列问题:
(1)溶液A中一定不存在的离子有___________________
(2)生成气体丙的离子方程式为__________________
某小组同学通过讨论后认为:溶液A中可能含有的离子有NH4+、K+、Na+、Cl-、SO42-。为进一步确认溶液中存在的离子,分别取100mL溶液A又进行了如下图所示的三组实验:
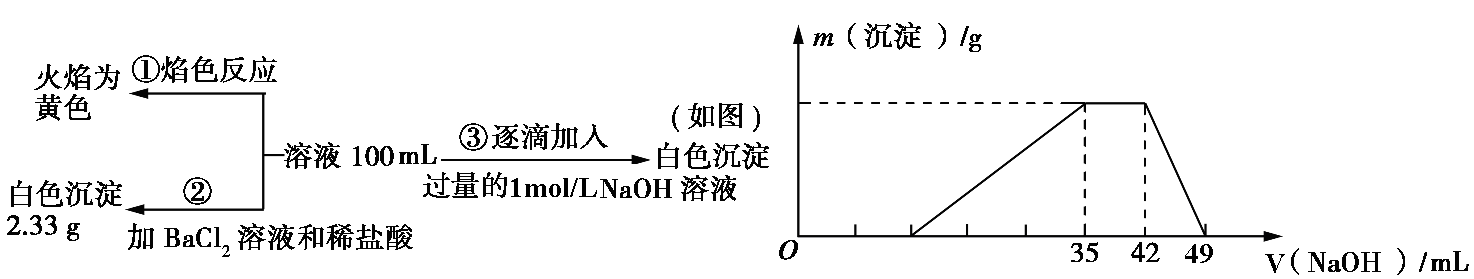
(3)根据上述实验可进一步确定NH4+、K+、Na+、Cl-、SO42-中一定存在的离子有 ,(4)沉淀溶解时发生反应的离子方程式为
(5)再经过进一步实验确定溶液A中没有K+和Cl-,计算溶液A中c(NO3-)= mol/L
 23.(20分)图示表示燃料电池和太阳能电池模式之间的转换。其中铱的配位物为燃料电池和太阳能电池两种模式的共同催化剂。
23.(20分)图示表示燃料电池和太阳能电池模式之间的转换。其中铱的配位物为燃料电池和太阳能电池两种模式的共同催化剂。
(1)请写出太阳能电池模式的负极反应式
(2)请写出燃料电池的总反应式
(3)“Cathode”发生的是 反应(填“氧化”或“还原”)
(4)电子流向 (填“Anode→Cathode”或“Cathode→Anode”)
(5)利用该电池电解可制得金属铅。将PbO溶解在HCl和NaCl的混合溶液中,得到含[PbC14]2-的电解液。用惰性电极电解Na2[PbCl4]溶液制得金属Pb,装置如下图所示。
稀硫酸 Na2[PbCl4]溶液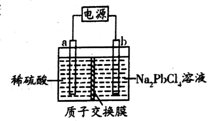
a电极的名称是__________,b电极的电极反应式为______________________,该生产过程中可以循环利用的物质是____________________。
(6)铅蓄电池是一种用途广泛的二次电池。铅蓄电池的电池反应通常表示如下:
Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O。铅蓄电池充电时,二氧化铅电极应与外接电源的_________________(填“正极”或“负极”)相连接,该电极的电极反应式为_________________。
2PbSO4+2H2O。铅蓄电池充电时,二氧化铅电极应与外接电源的_________________(填“正极”或“负极”)相连接,该电极的电极反应式为_________________。
(7)用PbS熔炼铅的过程中会有如下反应发生:
2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) △H1= a kJ·mol-1
PbS(s) +2O2(g) =PbSO4(s) △H2= b kJ·mol-1
PbS(s) +2PbO(s) =3Pb(s) +SO2(g) △H3= c kJ·mol-1
写出PbS与PbSO4反应生成Pb和SO2的热化学方程式____________________。
24.(14分)钴的化合物在磁性材料生产、电池制造、催化剂制备等方面应用非常广泛。
(1)Co2+基态核外电子排布式为 。
(2)制备[Co(H2O)6]2+反应为(NH4)2[Co(SCN)4]+6H2O=[Co(H2O)6](SCN)2+2NH4SCN。
①配合物[Co(H2O)6]2+中与Co2+形成配位键的原子是 (填元素符号);
SCN-的空间构型为 (用文字描述)。
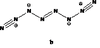
②NH4SCN在180~190℃分解并制得胍(结构简式如题图1所示),胍分子中碳原子杂化轨道类型为 ;1mol胍中含σ键数目为 。
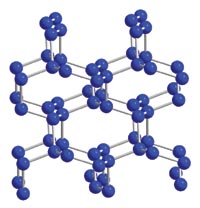
(3)一种钴的化合物可用作石油脱硫的催化剂,其晶胞结构如题图2所示,则晶体中与每个O2-紧邻的O2-有 个,与Ti紧邻的O个数为 (填数字)。
(4)该晶体具有钙钛矿型的立体结构,边长为a pm,Ti与O间的最短距离为 nm。
南安一中2017~2018学年上学期高三年第二次阶段考
化学科试卷
参考答案及评分标准
(40分)1.C 2.B 3.B 4.B 5.C 6. D 7.A 8.B 9A 10.B 11.D 12.C 13.B 14.A 15.B 16.A 17.D 18.D 19.A 20.D
21. (16分)(1)FeSO4·(NH4)2SO4·6H2O的溶解度比(NH4)2SO4和FeSO4·7H2O的溶解度较小的特点,从(NH4)2SO4和FeSO4·7H2O混合液中析出FeSO4·(NH4)2SO4·6H2O复盐晶体(2分)
(2)过滤(1分);蒸发浓缩(1分),蒸发皿(1分),晶膜(1分);冷却结晶(1分)
(3)a(1分)
(4)取少量晶体于试管中,加入适量的NaOH溶液,并加热,在试管口上方放置红色石蕊试纸或pH试纸,若红色石蕊试纸变蓝或黄色pH试纸变绿,说明有NH4+离子(2分)
(5)①溶液刚好出现粉红色或淡红色或紫红色,且半分钟内不褪色 (2分)
②5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O(2分)
③98.06(2分)
22. (10分)(1)Fe2+、Fe3+、CO32-、I-(2分)
(2)3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O(2分)
(3)NH4+、Na+、SO42-(2分) Al(OH)3+OH-=AlO2-+2H2O(2分) 0.22(2分)
23. (20分)(1)2H2O-4e-=O2↑+4H+(2分)
(2)2H2+O2=2H2O(2分)
(3)还原(2分)
(4)Anode→Cathode(2分)
(5)阳极(2分) PbCl42-+2e-=Pb+4Cl-(2分) HCl和NaCl(2分)
(6)正极(2分) PbSO4-2e-+2H2O==PbO2+4H++ SO42-(2分)
(7)PbS(s) +PbSO4(s)=2Pb(s)+2SO2(g) △H =[2(a+c)-3b]/3 kJ·mol-1(2分)
24.(14分)
(1)1s22s22p63s23p63d7或[Ar]3d7(2分)
(2)①O(2分) 直线形(2分)②sp2 (2分) 8NA(2分)
(3)8(2分) 12(2分)
(4)![]() 或 7.07a
或 7.07a![]() 10-4(2分)
10-4(2分)