
湖南省醴陵二中、醴陵四中2016-2017学年高二下学期期中联考化学试卷
03月05日
2018-2019学年广东省深圳中学高三(上)第一次月考化学试卷
一、选择题(共7小题,每小题6分,满分42分)
1.(6分)化学与生产、生活密切相关。下列说法不正确的是( )
A.还原铁粉和生石灰均可用作食品包装袋内的还原剂
B.SO2可用于制作葡萄酒的添加剂
C.食盐可用作食品调味剂和防腐剂
D.制造普通玻璃的原料是石灰石、纯碱和石英
2.(6分)设 NA阿伏加德罗常数的值,下列说法正确的是( )
A.1molH2O2中含有的阴离子数为 NA
B.0.1molH2和0.1molI2于密闭容器中充分反应,其分子总数为 0.2NA
C.22.4L(标准状况)Cl2与Na2SO3溶液完全反应转移电子数目为NA
D.pH=1的稀硫酸中,含有 H+总数为 0.1NA
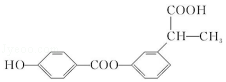
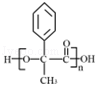
3.(6分)某有机物结构简式如图,下列关于该有机物的说法正确的是( )
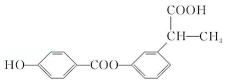
A.1 mol 该有机物含有 6 mol 碳碳双键
B.1 mol 该有机物完全燃烧可生成 9molH2O
C.1 mol 该有机物可电离生成 2molH+
D.1 mol 该有机物最多可与 6molH2发生加成反应
4.(6分)垃圾假单胞菌株能够在分解有机物的同时分泌物质产生电能,其原理如图所示。下列 说法正确的是( )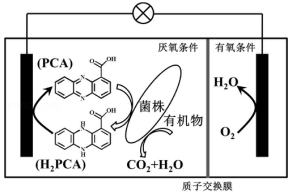
A.电流由左侧电极经过负载后流向右侧电极
B.放电过程中,正极附近pH变小
C.若 1molO2参与电极反应,有 4molH+穿过质子交换膜进入右室
D.负极电极反应为:H2PCA+2e﹣=PCA+2H+
5.(6分)短周期元素 W、X、Y、Z 的原子序数依次增大,四种元素的原子最外层电子数总和为17.W 原子的最外层电子数是其内层电子数的 2 倍,X、Y 的简单离子的电子层结构相 同,Z 的单质为淡黄色固体,且 Z 能与 X 形成多种化合物。下列说法正确的是( )
A.原子半径:Y>Z>X>W
B.简单氢化物的稳定性:X<Z
C.非金属性:Z<W
D.Y 的某种氧化物能与 W 的氧化物相互反应得到单质 X
6.(6分)根据下列实验操作和现象,所得到的结论正确的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 向2支盛有2mL等浓度银氨溶液的试管中分别加入2滴等浓度的NaCl和NaI溶液 | 一只试管中产生黄色沉淀,另一支中无明显现象 | Ksp(AgI)<Ksp(AgCl) |
| B | NaAlO2溶液与NaHCO3溶液混合 | 有白色絮状沉淀生成 | 两者水解相互促进生成Al(OH)3沉淀 |
| C | FeCl3和BaCl2混合溶液中通入足量SO2 | 溶液变成浅绿色且有白色沉淀生成 | Fe3+被还原为Fe2+,沉淀为BaSO4和BaSO3 |
| D | 向KBrO3溶液中通入少量Cl2,然后再加入少量苯 | 有机相呈橙红色 | 氧化性:Cl2>Br2 |
A.AB.BC.CD.D
7.(6分)25℃时,H2CO3的Kal=4.2×10﹣7,Ka2=5.6×10﹣11.室温下向10mL 0.1mo1•L﹣1Na2CO3溶液中逐滴加入0.1mo1•L﹣1HCl溶液.如图是溶液中含碳元素微粒物质的量分数随pH降低而变化的图象(CO2因有逸出未画出).下列说法错误的是( )
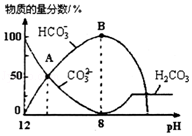
A.A点所示溶液的pH<11
B.B点所示溶液:c(Na+)=c(HCO3﹣)+c(CO32﹣)+c(H2CO3)
C.A点→B点发生反应的离子方程式为CO32﹣+H+═HCO3﹣
D.分步加入酚酞和甲基橙,用滴定法可测定Na2CO3与NaHCO3混合物的组成
二、填空题(共3小题,每小题14分,满分43分)
8.(14分)无水四氯化锡(SnCl4)常用作有机合成的氯化催化剂。实验室可用熔融的锡(熔点231.9℃)与 Cl2反应制备 SnCl4,装置如图所示。回答下列问题
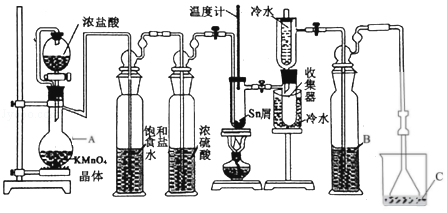
已知:①SnCl4在空气中极易水解生成 SnO2•xH2O
②
| 物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
| SnCl2 | 无色晶体 | 246 | 652 |
| SnCl4 | 无色液体 | ﹣33 | 114 |
(1)仪器 A 的名称是 ,其中发生反应的离子方程式是 。
( 2 ) 点 燃酒精灯 前需排 尽装置中 的空气,否则 会发生副 反应,化 学方 程式是 、 。
(3)试剂 B、C 依次为 、 ,试剂 B的作用是 。
(4)Cl2和锡的反应产物有 SnCl4和 SnCl2,为防止产品中带入 SnCl2,可采取的措施是 、 。
(5)碘氧化法滴定分析产品中2价Sn(II)的含量。准确称取 m g 产品于锥形瓶中,用蒸馏水溶解,淀粉﹣KI 溶液做指示剂,用cmol•L﹣1碘标准溶液滴定至终点,消耗碘标准溶液VmL,计算产品中Sn(II)的含量 (用含 c、m、V 的代数式表示)。
9.(15分)锌锰干电池是最早的实用电池。现用下列工艺回收正极材料中的金属(部分条件未给出)。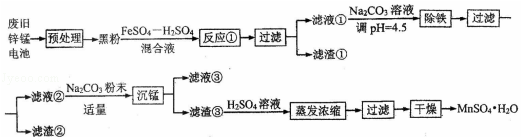
(1)碱性锌锰电池反应为:Zn+2MnO2+2H2O=Zn(OH)2+2MnO(OH),电解质是 KOH,该电池的负极材料为 (填化学式),MnO(OH)中Mn的化合价为: ,正极反应式为: 。
(2)黑粉的主要成份为 MnO2 和石墨,写出反应①的化学方程式: 。
(3)MnO2的转化率与温度的关系如下表:
| 温度/℃ | 20 | 40 | 60 | 80 | 100 |
| 转化率/℃ | 86.0 | 90.0 | 91.3 | 92.0 | 92.1 |
生产中常选反应温度为 80℃,其理由是: 。
(4)“沉锰”过程中生成碱式碳酸锰[MnCO3•6Mn(OH)2•5H2O],写出其离子反应方程式: ,检验沉淀是否洗净的操作是: 。滤液③中可回收的物质为: (填化学式)。
(5)“预处理”时,废旧锌锰电池经过拆解、筛分得到炭包,其中含MnO2为34.8%. 称取5.000g 炭包,经处理得到3.211g MnSO4•H2O,计算锰的回收率为: 。
10.(14分)工业上采用高温活性炭催化CO与C12合成光气(COCl2))。
(1)COCl2中的原子最外层都达到 8电子稳定结构,光气分子的电子式为 。
(2)工业上利用天然气(CH4)与CO2进行高温重整制备CO的反应为:
CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+247.3 kJ•mol﹣1
已知:C﹣H、C≡O、H﹣H键的键能依次为 413kJ•mol﹣1、1076kJ•mol﹣1、436kJ•mol﹣1,则 C=O键的键能为 kJ•mol﹣1。
(3)光气为窒息性毒剂,极易水解生成氯化氢,泄露后可用水雾吸收,化学方程式 为: 。
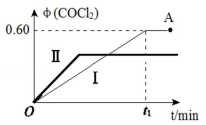
(4)某温度下,在 2L恒容密闭容器中充入2molCO(g)、2mol Cl2(g)和适量的活性炭,发生反应:Cl2(g)+CO(g)⇌CO Cl2(g)△H=﹣108kJ•mol﹣1,测得在混合气中 COCl2的体积分数φ(COCl2)和时间 t 的关系如图曲线Ⅰ所示。
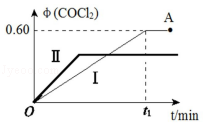
①下列情况不能表明该反应达到平衡状态的是 (填字母标号)。
A.CO 的体积分数不改变 B.Cl2的消耗速率与 COCl2的生成速率相等
C.体系中不改变 D.混合气体的平均相对分子质量不再变化
②按曲线Ⅰ,平衡常数 K= 。A点时,向容器中加入等物质的量CO和Cl2,再次达到平衡时,光气的体积分数会 (填“增大”、“减小”或“不变”。
③曲线Ⅱ相对曲线Ⅰ改变的条件可能是 (填字母标号)。
A.恒容通入惰性气体B.通入 CO C.增大压强D.升高温度。
三、【选修题】[化学一选修3:物质结构与性质](15分)
11.(15分)C60具有完美的球形结构。之后 Si60、N60等球形分子被不断制备出来。回答下列问题:
(1)Si的核外电子排布式为 ,C 和 N 元素中第一电离能较大的是 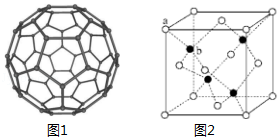
(2)富勒烯衍生物具有良好的光电性能,富勒烯(C60)的结构如图1所示,C60属于 晶体;C60分子中五元环与六元环的数目比为 (已知简单多面体的顶点数 V、棱数 E及面数 F间有如下关系:V﹣E+F=2)。
(3)N60的晶体中存在的作用力有 (填字母标号)
A.共价键B.离子键C.氢键 D.范德华力E.配位键F.金属键
(4)立方氮化硼(BN)可做磨料,其结构与金刚石相似,二者具有相似性结构的原因是 。
(5)金属 M(相对原子质量为 m)与N60形成的化合物晶体结 构如图2所示(其中白球代表 N60,黑球代表金属 M),若其晶胞边 长 为k pm,NA代 表 阿 伏 加 德 罗 常 数 的 值,则 其 密 度 为 g•cm﹣3,该化合物中 N60的配位数为 。
四、【选修题】[化学一选修5:有机化学基础](15分)
12.芳香族化合物 A(C9H12O)常用于药物及香料的合成,A 有如下转化关系: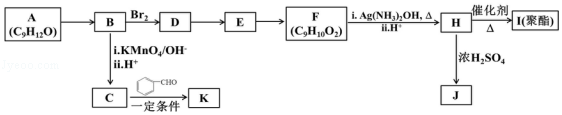
已知以下信息:
①A不能使酸性高锰酸钾溶液褪色;
②![]()
![]() +CO2
+CO2
③RCOCH3+R′CHORCOOH═CHR′
回答下列问题:
(1)A生成B的反应条件为: ,由D生成E的反应类型为 。
(2)F的官能团名称为 。
(3)K的结构简式为 ,由H生成I的反应方程式为 。
(4)J为一种具有3个六元环的酯,则其结构简式为 。
(5)F的同分异构体中,能与NaHCO3反应生成CO2的有 种,其中核磁共振氢谱为4组峰,且峰面积比为6:2:1:1的为 (写出其中一种结构简式)。
(6)糠叉丙酮(![]() )是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁基氯[(CH3)3CCl]和糠醛(
)是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁基氯[(CH3)3CCl]和糠醛(![]() )为原料制备糠叉丙酮的合成路线(无机试剂任用)。合成流程图示例如下:CH2═CH2CH3CH2BrCH3CH2OH。
)为原料制备糠叉丙酮的合成路线(无机试剂任用)。合成流程图示例如下:CH2═CH2CH3CH2BrCH3CH2OH。
参考答案与试题解析
一、选择题(共7小题,每小题6分,满分42分)
1.(6分)化学与生产、生活密切相关。下列说法不正确的是( )
A.还原铁粉和生石灰均可用作食品包装袋内的还原剂
B.SO2可用于制作葡萄酒的添加剂
C.食盐可用作食品调味剂和防腐剂
D.制造普通玻璃的原料是石灰石、纯碱和石英
【考点】14:物质的组成、结构和性质的关系.菁优网版权所有
【专题】513:物质的性质和变化专题.
【分析】A.生石灰具有吸水性,没有还原性;
B.二氧化硫有还原性;
C.食盐能够使细菌脱水死亡,达到抑制细菌繁殖的目的;
D.普通玻璃的成分是硅酸钠、硅酸钙和二氧化硅。
【解答】解:A.还原铁粉具有还原性,能作还原剂,生石灰无还原性,不能做还原剂,故A错误;
B.二氧化硫有还原性,可与氧气发生氧化还原反应而阻止或延缓食品氧化变质、提高食品稳定性和延长贮存期,故B正确;
C.食盐有咸味,可作调味剂,食盐能够使细菌脱水死亡,达到抑制细菌繁殖的目的,可做防腐剂,故C正确;
D.普通玻璃的成分是硅酸钠、硅酸钙和二氧化硅,玻璃是在高温下,由石灰石、纯碱和石英制成的,故D正确。
故选:A。
【点评】本题考查物质的性质及应用,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大。
2.(6分)设 NA阿伏加德罗常数的值,下列说法正确的是( )
A.1molH2O2中含有的阴离子数为 NA
B.0.1molH2和0.1molI2于密闭容器中充分反应,其分子总数为 0.2NA
C.22.4L(标准状况)Cl2与Na2SO3溶液完全反应转移电子数目为NA
D.pH=1的稀硫酸中,含有 H+总数为 0.1NA
【考点】4F:阿伏加德罗常数.菁优网版权所有
【专题】518:阿伏加德罗常数和阿伏加德罗定律.
【分析】A、双氧水是共价化合物;
B、H2和I2的反应是可逆反应,但同时也是气体分子数不变的反应;
C、22.4L(标准状况)Cl2的物质的量为1mol,和Na2SO3溶液完全反应变为﹣1价;
D、溶液体积不明确。
【解答】解:A、双氧水是共价化合物,故无阴离子,故A错误;
B、H2和I2的反应是可逆反应,但同时也是气体分子数不变的反应,故0.1molH2和0.1molI2于密闭容器中充分反应,无论反应进行的程度如何,其分子总数为 0.2NA,故B正确;
C、22.4L(标准状况)Cl2的物质的量为1mol,和Na2SO3溶液完全反应变为﹣1价,故1mol氯气转移2NA个电子,故C错误;
D、溶液体积不明确,故此溶液中含有的氢离子的个数无法计算,故D错误。
故选:B。
【点评】本题考查了物质的量和阿伏伽德罗常数的有关计算,难度不大,掌握公式的运用和物质的结构是解题关键。
3.(6分)某有机物结构简式如图,下列关于该有机物的说法正确的是( )
A.1 mol 该有机物含有 6 mol 碳碳双键
B.1 mol 该有机物完全燃烧可生成 9molH2O
C.1 mol 该有机物可电离生成 2molH+
D.1 mol 该有机物最多可与 6molH2发生加成反应
【考点】HD:有机物的结构和性质.菁优网版权所有
【专题】534:有机物的化学性质及推断.
【分析】由结构可知分子中含酚﹣OH、﹣COOC﹣、﹣COOH,结合酚、酯、羧酸的性质来解答.
【解答】解:A.分子中苯环不含碳碳双键,故A错误;
B.由结构可知分子式为C16H14O5,1 mol 该有机物完全燃烧可生成 7molH2O,故B错误;
C.含有1个羧基、1个羟基,且不能完全电离,故C错误;
D.该物质中能和氢气发生加成反应的为苯环,所以最多可与6molH2发生加成,故D正确。
故选:D。
【点评】本题考查有机物的结构与性质,为高频考点,把握官能团与性质、有机反应为解答的关键,侧重分析与应用能力的考查,注意选项B为解答的难点,题目难度不大.
4.(6分)垃圾假单胞菌株能够在分解有机物的同时分泌物质产生电能,其原理如图所示。下列 说法正确的是( )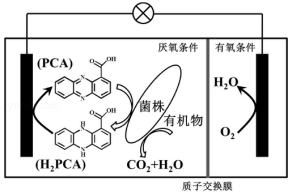
A.电流由左侧电极经过负载后流向右侧电极
B.放电过程中,正极附近pH变小
C.若 1molO2参与电极反应,有 4molH+穿过质子交换膜进入右室
D.负极电极反应为:H2PCA+2e﹣=PCA+2H+
【考点】BH:原电池和电解池的工作原理.菁优网版权所有
【专题】51I:电化学专题.
【分析】A.氧气得电子,为正极,左边为负极;
B.酸性条件下,氧气得电子生成水;
C.根据正极的电极方程式计算氧气与氢离子的物质的量;
D.负极失电子发生氧化反应。
【解答】解:A、原电池中电子由负极沿导线流向正极,所以电子由左侧电极经过负载后流向右侧电极,故A错误;
B.酸性条件下,氧气得电子生成水,则正极的电极反应为:4H++O2+4e﹣=2H2O,所以正极附近pH变大,故B错误;
C.已知正极的电极方程式为4H++O2+4e﹣=2H2O,则1molO2参与电极反应,消耗4 mol H+,即有4mol H+穿过质子交换膜进人右室,故C正确;
D.负极失电子发生氧化反应,所以电极反应式为:H2PCA﹣2e﹣=PCA+2H+,故D错误;
故选:C。
【点评】本题考查新型电池,题目难度不大,注意把握原电池的工作原理以及电极反应式的书写,解答本题的关键是根据物质的性质判断原电池的正负极,侧重于考查学生的分析能力和计算能力。
5.(6分)短周期元素 W、X、Y、Z 的原子序数依次增大,四种元素的原子最外层电子数总和为17.W 原子的最外层电子数是其内层电子数的 2 倍,X、Y 的简单离子的电子层结构相 同,Z 的单质为淡黄色固体,且 Z 能与 X 形成多种化合物。下列说法正确的是( )
A.原子半径:Y>Z>X>W
B.简单氢化物的稳定性:X<Z
C.非金属性:Z<W
D.Y 的某种氧化物能与 W 的氧化物相互反应得到单质 X
【考点】8F:原子结构与元素周期律的关系.菁优网版权所有
【专题】51C:元素周期律与元素周期表专题.
【分析】短周期元素 W、X、Y、Z 的原子序数依次增大,W原子的最外层电子数是其内层电子数的2倍,最外层最多含有8个电子,则W含有2个电子层,最外层含有4个电子,为C元素;Z的单质为淡黄色固体,则Z为S元素;Z(S)能与X形成多种化合物,X的原子序数大于W(C),应该为O元素;四种元素的原子最外层电子数总和为17,则Y的最外层电子数=17﹣4﹣6﹣6=1,结合原子序数大小可知Y为Na元素,通过验证满足X、Y 的简单离子的电子层结构相同,据此进行解答。
【解答】解:根据分析可知,W、X、Y、Z分别为C、O、Na、S。
A.原子的电子层越多原子半径越大,电子层相同时,原子的核电荷数越大原子半径越小,则原子半径:Y(Na)>Z (S)>W (C)>X (O),故A错误;
B.非金属性S<O,则简单氢化物的稳定性:H2S<H2O,故B错误;
C.非金属性:C<S,即Z>W,故C错误;
D.Y(Na)的某种氧化物(Na2O2)能与 W(C) 的氧化物(CO2)相互反应得到单质X (O2),故D正确;
故选:D。
【点评】本题考查原子结构与元素周期律的关系,为高频考点,题目难度中等,把握元素的位置、最外层电子数来推断元素为解答的关键,注意规律性知识的应用,讨论法推断元素为解答的难点,试题侧重分析与应用能力的考查。
6.(6分)根据下列实验操作和现象,所得到的结论正确的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 向2支盛有2mL等浓度银氨溶液的试管中分别加入2滴等浓度的NaCl和NaI溶液 | 一只试管中产生黄色沉淀,另一支中无明显现象 | Ksp(AgI)<Ksp(AgCl) |
| B | NaAlO2溶液与NaHCO3溶液混合 | 有白色絮状沉淀生成 | 两者水解相互促进生成Al(OH)3沉淀 |
| C | FeCl3和BaCl2混合溶液中通入足量SO2 | 溶液变成浅绿色且有白色沉淀生成 | Fe3+被还原为Fe2+,沉淀为BaSO4和BaSO3 |
| D | 向KBrO3溶液中通入少量Cl2,然后再加入少量苯 | 有机相呈橙红色 | 氧化性:Cl2>Br2 |
A.AB.BC.CD.D
【考点】U5:化学实验方案的评价.菁优网版权所有
【专题】25:实验评价题.
【分析】A.Ksp小的先沉淀;
B.AlO2﹣促进的HCO3﹣电离;
C.FeCl3与二氧化硫发生氧化还原反应生成硫酸根离子;
D.由现象可知生成溴。
【解答】解:A.Ksp小的先沉淀,先生成黄色沉淀,可知Ksp(AgI)<Ksp(AgCl),故A正确;
B.AlO2﹣促进的HCO3﹣电离,生成氢氧化铝沉淀,不发生相互促进水解,故B错误;
C.FeCl3与二氧化硫发生氧化还原反应生成硫酸根离子,再与氯化钡反应生成BaSO4,故C错误;
D.有机层呈橙色,说明生成溴,则KBrO2被氯气还原,可说明氧化性KBrO3>Cl2,故D错误;
故选:A。
【点评】本题考查化学实验方案的评价,为高考常见题型,把握物质的性质、沉淀生成、氧化还原反应、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大。
7.(6分)25℃时,H2CO3的Kal=4.2×10﹣7,Ka2=5.6×10﹣11.室温下向10mL 0.1mo1•L﹣1Na2CO3溶液中逐滴加入0.1mo1•L﹣1HCl溶液.如图是溶液中含碳元素微粒物质的量分数随pH降低而变化的图象(CO2因有逸出未画出).下列说法错误的是( )
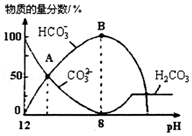
A.A点所示溶液的pH<11
B.B点所示溶液:c(Na+)=c(HCO3﹣)+c(CO32﹣)+c(H2CO3)
C.A点→B点发生反应的离子方程式为CO32﹣+H+═HCO3﹣
D.分步加入酚酞和甲基橙,用滴定法可测定Na2CO3与NaHCO3混合物的组成
【考点】D5:弱电解质在水溶液中的电离平衡;DN:离子浓度大小的比较.菁优网版权所有
【专题】51G:电离平衡与溶液的pH专题.
【分析】A.A点c(HCO3﹣)=c(CO32﹣),根据Ka2计算;
B.根据物料守恒分析;
C.A点→B:CO32﹣逐渐减少,HCO3﹣逐渐增加;
D.用酚酞作指示剂,滴定产物是NaHCO3,用甲基橙作指示剂,滴定产物是H2CO3.
【解答】解:A.A点c(HCO3﹣)=c(CO32﹣),Ka25.6×10﹣11,则c(H+)=5.6×10﹣11mol/L,所以pH<11,故A正确;
B.室温下向10mL 0.1mo1•L﹣1Na2CO3溶液中逐滴加入0.1mo1•L﹣1HCl溶液,B点溶液中钠离子的物质的量浓度是含碳粒子的浓度的2倍,即c(Na+)=2c(HCO3﹣)+2c(CO32﹣)+2c(H2CO3),故B错误;
C.A点→B:CO32﹣逐渐减少,HCO3﹣逐渐增加,所以发生反应的离子方程式为CO32﹣+H+═HCO3﹣,故C正确;
D.1Na2CO3溶液中逐滴加入HCl,用酚酞作指示剂,滴定产物是NaHCO3,用甲基橙作指示剂滴定时NaHCO3与HCl反应产物是H2CO3,所以分步加入酚酞和甲基橙,用滴定法可测定Na2CO3与NaHCO3混合物的组成,故D正确。
故选:B。
【点评】本题考查了弱电解质的电离、电离常数的计算,题目难度中等,明确弱电解质的电离特点、电离平衡常数与酸根离子水解程度的关系再结合守恒思想分析解答,试题培养了学生的灵活应用能力.
二、填空题(共3小题,每小题14分,满分43分)
8.(14分)无水四氯化锡(SnCl4)常用作有机合成的氯化催化剂。实验室可用熔融的锡(熔点231.9℃)与 Cl2反应制备 SnCl4,装置如图所示。回答下列问题
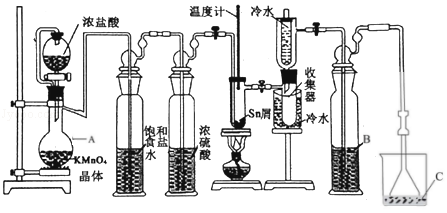
已知:①SnCl4在空气中极易水解生成 SnO2•xH2O
②
| 物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
| SnCl2 | 无色晶体 | 246 | 652 |
| SnCl4 | 无色液体 | ﹣33 | 114 |
(1)仪器 A 的名称是 蒸馏烧瓶 ,其中发生反应的离子方程式是 2MnO4﹣+16H++10Cl﹣=2Mn2++5Cl2↑+8H2O 。
( 2 ) 点 燃酒精灯 前需排 尽装置中 的空气,否则 会发生副 反应,化 学方 程式是 Sn+Cl2=SnCl2 、 Sn+O2=SnO2 。
(3)试剂 B、C 依次为 浓硫酸 、 NaOH ,试剂 B的作用是 防止溶液的水蒸气进入收集器中 。
(4)Cl2和锡的反应产物有 SnCl4和 SnCl2,为防止产品中带入 SnCl2,可采取的措施是 控制Sn与氯气的反应温度控制在114℃至652℃之间 、 通过量氯气 。
(5)碘氧化法滴定分析产品中2价Sn(II)的含量。准确称取 m g 产品于锥形瓶中,用蒸馏水溶解,淀粉﹣KI 溶液做指示剂,用cmol•L﹣1碘标准溶液滴定至终点,消耗碘标准溶液VmL,计算产品中Sn(II)的含量 100% (用含 c、m、V 的代数式表示)。
【考点】U3:制备实验方案的设计.菁优网版权所有
【专题】548:制备实验综合.
【分析】SnCl4极易水解,反应应在无水环境下进行进行装置A:采用KMnO4和浓盐酸反应的方法制取Cl2,反应还生成MnCl2,反应的方程式为:2MnO4﹣+16H++10Cl﹣=2Mn2++5Cl2↑+8H2O,制取的氯气中含有氯化氢,试剂为饱和食盐水,可以降低氯气的溶解,通过饱和的氯化钠溶液洗去氯气中的氯化氢,SnCl4在空气中极易水解,利用浓硫酸的吸水性干燥氯气,防止产生SnCl4水解;然后Cl2和锡的反应,制备SnCl4,冷水冷却,可将气态的SnCl4冷凝回流收集产物;装置C中NaOH吸收未反应的氯气,用氢氧化钠溶液吸收,防止污染空气,因SnCl4极易水解,装置B可防止溶液的水蒸气进入收集器中,且金属锡易与氯气、氧气反应,反应时应先生成氯气,将氧气排出,以此来解答。
【解答】解:(1)仪器A为蒸馏烧瓶,实验采用KMnO4和浓盐酸反应的方法制取Cl2,反应还生成MnCl2,则反应的离子方程式为2MnO4﹣+16H++10Cl﹣=2Mn2++5Cl2↑+8H2O,
故答案为:蒸馏烧瓶;2MnO4﹣+16H++10Cl﹣=2Mn2++5Cl2↑+8H2O;
(2)点燃酒精灯前需排尽装置中的空气,否则会发生副反应,化学方程式是Sn+Cl2=SnCl2、Sn+O2=SnO2,
故答案为:Sn+Cl2=SnCl2;Sn+O2=SnO2;
(3)由上述分析可知,B中试剂为浓硫酸,C中试剂为NaOH,B的作用为防止溶液的水蒸气进入收集器中,
故答案为:浓硫酸;NaOH;防止溶液的水蒸气进入收集器中;
(4)根据图表数据可知,SnCl4的熔沸点较低,SnCl4的熔沸点较低,可以将SnCl4转化为气态,适当增大氯气流量,继续加热,便于分离产物,但需低于SnCl2的沸点,所以为防止产品中带入过多的SnCl2,可采取的措施是:控制Sn与氯气的反应温度控制在114℃至652℃之间或通过量氯气,
故答案为:控制Sn与氯气的反应温度控制在114℃至652℃之间;通过量氯气;
(5)滴定反应为氧化还原反应,则有计量关系:5Sn2+~~2IO3﹣,cmol/L 的KIO3标准溶液进行滴定,消耗VmL的标准溶液,则含有n(Sn2+)cV×10﹣3mol=2.5cV×10﹣2mol,则产品中Sn(II)的含量为100%,
故答案为:100%。
【点评】本题考查物质的制备实验,为高频考点,把握物质的性质、制备原理、实验装置的作用为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合,题目难度不大。
9.(15分)锌锰干电池是最早的实用电池。现用下列工艺回收正极材料中的金属(部分条件未给出)。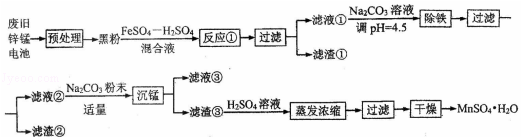
(1)碱性锌锰电池反应为:Zn+2MnO2+2H2O=Zn(OH)2+2MnO(OH),电解质是 KOH,该电池的负极材料为 Zn (填化学式),MnO(OH)中Mn的化合价为: +3 ,正极反应式为: MnO2+H2O+e﹣=MnO(OH)+OH﹣ 。
(2)黑粉的主要成份为 MnO2和石墨,写出反应①的化学方程式: MnO2+2FeSO4+2H2SO4=MnSO4+Fe2(SO4)3+2H2O 。
(3)MnO2的转化率与温度的关系如下表:
| 温度/℃ | 20 | 40 | 60 | 80 | 100 |
| 转化率/℃ | 86.0 | 90.0 | 91.3 | 92.0 | 92.1 |
生产中常选反应温度为 80℃,其理由是: 80℃时MnO2的转化率已经较高,更高的温度会增加能耗,增大生产成本,得不偿失 。
(4)“沉锰”过程中生成碱式碳酸锰[MnCO3•6Mn(OH)2•5H2O],写出其离子反应方程式: 7Mn2++7CO32﹣+11H2O=MnCO3•6Mn(OH)2•5H2O↓+6CO2↑ ,检验沉淀是否洗净的操作是: 取少量最后一次洗涤滤液于试管中,向其中滴加BaCl2溶液,观察是否有白色沉淀生成,若无白色沉淀生成,则说明沉淀已洗涤干净:若有白色沉淀生成,则说明未洗涤干净 。滤液③中可回收的物质为: Na2SO4 (填化学式)。
(5)“预处理”时,废旧锌锰电池经过拆解、筛分得到炭包,其中含MnO2为34.8%. 称取5.000g 炭包,经处理得到3.211g MnSO4•H2O,计算锰的回收率为: 82.6% 。
【考点】P8:物质分离和提纯的方法和基本操作综合应用.菁优网版权所有
【专题】545:物质的分离提纯和鉴别.
【分析】废旧锌锰干电池预处理得到二氧化锰和石墨,加入硫酸亚铁和硫酸混合溶液发生反应亚铁离子被氧化为铁离子,过滤得到滤渣主要是碳,滤液①为硫酸锰、硫酸铁、硫酸亚铁溶液,加入过氧化物氧化亚铁离子为铁离子,加入氢氧化钠溶液调节溶液PH沉淀铁离子,过滤得到滤渣②主要为氢氧化铁,滤液②为硫酸锰溶液,加入碳酸钠粉末沉淀锰离子过滤得到滤渣③为碱式碳酸锰[MnCO3•Mn(OH)2•5H2O],滤液③为硫酸钠溶液,滤渣③加入硫酸溶液得到硫酸锰溶液,通过蒸发浓缩、冷却结晶、过滤洗涤、干燥处理得到MnSO4•H2O,以此解答该题。
【解答】解:(1)反应Zn+2MnO2+2H2O=Zn(OH)2+2MnO(OH)中Zn元素化合价升高,被氧化,则Zn为负极,MnO(OH)中氧元素化合价﹣2价,氢元素化合价+1价,化合价代数和为0计算得到Mn的化合价为+3价,正极发生还原反应生成MnO(OH),电极方程式为MnO2+H2O+e﹣=MnO(OH)+OH﹣,
故答案为:Zn;+3;MnO2+H2O+e﹣=MnO(OH)+OH﹣;
(2)反应①的化学方程式为MnO2+2FeSO4+2H2SO4=MnSO4+Fe2(SO4)3+2H2O,故答案为:MnO2+2FeSO4+2H2SO4=MnSO4+Fe2(SO4)3+2H2O;
(3)由表中数据可知,MnO2的转化率随温度的升高而升高,80℃时MnO2的转化率已经较高,更高的温度会增加能耗,增大生产成本,得不偿失,
故答案为:80℃时MnO2的转化率已经较高,更高的温度会增加能耗,增大生产成本,得不偿失;
(4)“沉锰”过程中生成碱式碳酸锰[MnCO3•6Mn(OH)2•5H2O],离子反应方程式为7Mn2++7CO32﹣+11H2O=MnCO3•6Mn(OH)2•5H2O↓+6CO2↑,如沉淀没有洗净,吸附硫酸根离子,可取少量最后一次洗涤滤液于试管中,向其中滴加BaCl2溶液,观察是否有白色沉淀生成,若无白色沉淀生成,则说明沉淀已洗涤干净:若有白色沉淀生成,则说明未洗涤干净,滤液③中可回收的物质为Na2SO4,
故答案为:7Mn2++7CO32﹣+11H2O=MnCO3•6Mn(OH)2•5H2O↓+6CO2↑;取少量最后一次洗涤滤液于试管中,向其中滴加BaCl2溶液,观察是否有白色沉淀生成,若无白色沉淀生成,则说明沉淀已洗涤干净:若有白色沉淀生成,则说明未洗涤干净;Na2SO4;
(5)MnO2为34.8%. 称取5.000g 炭包,则n(Mn)=n(MnO2)0.023mol,
经处理得到3.211g MnSO4•H2O,则n(Mn)=0.019mol,
则回收率为82.6%。
故答案为:82.6%。
【点评】本题考查物质分离和提纯,为高频考点,侧重考查学生分析及知识综合应用能力,涉及基本操作、氧化还原反应、离子反应等知识点,明确流程图中发生的反应或操作方法是解本题关键,注意基础知识的积累和灵活运用,题目难度中等。
10.(14分)工业上采用高温活性炭催化CO与C12合成光气(COCl2))。
(1)COCl2中的原子最外层都达到 8电子稳定结构,光气分子的电子式为 ![]() 。
。
(2)工业上利用天然气(CH4)与CO2进行高温重整制备CO的反应为:
CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+247.3 kJ•mol﹣1
已知:C﹣H、C≡O、H﹣H键的键能依次为 413kJ•mol﹣1、1076kJ•mol﹣1、436kJ•mol﹣1,则 C=O键的键能为 809.65 kJ•mol﹣1。
(3)光气为窒息性毒剂,极易水解生成氯化氢,泄露后可用水雾吸收,化学方程式 为: COCl2+H2O=2HCl+CO2 。
(4)某温度下,在 2L恒容密闭容器中充入2molCO(g)、2mol Cl2(g)和适量的活性炭,发生反应:Cl2(g)+CO(g)⇌CO Cl2(g)△H=﹣108kJ•mol﹣1,测得在混合气中 COCl2的体积分数φ(COCl2)和时间 t 的关系如图曲线Ⅰ所示。
①下列情况不能表明该反应达到平衡状态的是 BC (填字母标号)。
A.CO 的体积分数不改变 B.Cl2的消耗速率与 COCl2的生成速率相等
C.体系中不改变 D.混合气体的平均相对分子质量不再变化
②按曲线Ⅰ,平衡常数 K= 12L/mol 。A点时,向容器中加入等物质的量CO和Cl2,再次达到平衡时,光气的体积分数会 增大 (填“增大”、“减小”或“不变”。
③曲线Ⅱ相对曲线Ⅰ改变的条件可能是 D (填字母标号)。
A.恒容通入惰性气体B.通入 CO C.增大压强D.升高温度。
【考点】CP:化学平衡的计算.菁优网版权所有
【专题】517:化学反应中的能量变化.
【分析】(1)COCl2中的原子最外层都达到 8电子稳定结构,C与O形成双键,C与Cl形成单键;
(2)焓变等于断裂化学键吸收的能量减去成键释放的能量;
(3)COCl2水解生成HCl,还生成二氧化碳;
(4)①结合平衡的特征“等、定”及衍生的物理量判定平衡状态;
②曲线Ⅰ中平衡时φ(COCl2)=0.60,则
Cl2(g)+CO(g)⇌CO Cl2(g)
开始 2 2 0
转化 x x x
平衡 2﹣x 2﹣x x
0.60,解得x=1.5mol,
结合K为生成物浓度幂之积与反应物浓度幂之积的比计算;
A点时,向容器中加入等物质的量CO和Cl2,体积不变、压强增大,平衡正向移动;
③曲线Ⅱ相对曲线Ⅰ,反应速率加快,且φ(COCl2)减小,应升高温度平衡逆向移动。
【解答】解:(1)COCl2中的原子最外层都达到 8电子稳定结构,C与O形成双键,C与Cl形成单键,所以光气的电子式为![]() ,
,
故答案为:![]() ;
;
(2)C﹣H、C≡O、H﹣H键的键能依次为 413kJ•mol﹣1、1076kJ•mol﹣1、436kJ•mol﹣1,设C=O键的键能为x,由CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+247.3 kJ•mol﹣1,可知413×4+2x﹣×1076﹣436×2=+247.3,解得x=809.65,
故答案为:809.65;,
(3)光气为窒息性毒剂,极易水解生成氯化氢,泄露后可用水雾吸收,化学方程式为COCl2+H2O=2HCl+CO2,
故答案为:COCl2+H2O=2HCl+CO2;
(4)①A.CO 的体积分数不改变,可知CO的物质的量不变,为平衡状态,故正确;
B.Cl2的消耗速率与 COCl2的生成速率相等,只体现正反应速率,不能判定平衡状态,故错误;
C.起始量相同、转化量相同,则体系中始终不改变,不能判定平衡状态,故错误;
D.气体的质量不变,物质的量减小,则混合气体的平均相对分子质量不再变化,为平衡状态,故正确;
故答案为:BC;
②曲线Ⅰ中平衡时φ(COCl2)=0.60,则
Cl2(g)+CO(g)⇌CO Cl2(g)
开始 2 2 0
转化 x x x
平衡 2﹣x 2﹣x x
0.60,解得x=1.5mol,
平衡常数K12L/mol,
且A点时,向容器中加入等物质的量CO和Cl2,体积不变、压强增大,平衡正向移动,则再次达到平衡时,光气的体积分数会增大,
故答案为:12L/mol;增大;
③曲线Ⅱ相对曲线Ⅰ,反应速率加快,且φ(COCl2)减小,
A.恒容通入惰性气体,浓度不变,反应速率不变,平衡不移动,故A不选;
B.通入 CO,平衡正向移动,φ(COCl2)增大,故B不选;
C.增大压强,平衡正向移动,φ(COCl2)增大,故C不选;
D.升高温度,反应速率加快,且为放热反应,平衡逆向移动,φ(COCl2)减小,故D选;
故答案为:D。
【点评】本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、K的计算、焓变计算、平衡移动及判定为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大。
三、【选修题】[化学一选修3:物质结构与性质](15分)
11.(15分)C60具有完美的球形结构。之后 Si60、N60等球形分子被不断制备出来。回答下列问题:
(1)Si的核外电子排布式为 1s22s22p63s23p2 ,C 和 N 元素中第一电离能较大的是 N 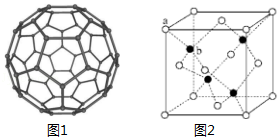
(2)富勒烯衍生物具有良好的光电性能,富勒烯(C60)的结构如图1所示,C60属于 分子 晶体;C60分子中五元环与六元环的数目比为 3:5 (已知简单多面体的顶点数 V、棱数 E及面数 F间有如下关系:V﹣E+F=2)。
(3)N60的晶体中存在的作用力有 AD (填字母标号)
A.共价键B.离子键C.氢键 D.范德华力E.配位键F.金属键
(4)立方氮化硼(BN)可做磨料,其结构与金刚石相似,二者具有相似性结构的原因是 B原子有3个价电子,N原子有5个价电子,在立方氮化硼晶体中,每个B原子利用3个价电子形成普通共价键外,还可以通过空轨道,接受N原子的孤电子对,形成1个配位键,于是在立方氮化硼晶体中B原子、N原子都采取sp3杂化,和金刚石中碳原子的杂化方式一样,形成与金刚石类似的正四面体空间网状结构。 。
(5)金属 M(相对原子质量为 m)与N60形成的化合物晶体结 构如图2所示(其中白球代表 N60,黑球代表金属 M),若其晶胞边 长 为k pm,NA代 表 阿 伏 加 德 罗 常 数 的 值,则 其 密 度 为 g•cm﹣3,该化合物中 N60的配位数为 4 。
【考点】9I:晶胞的计算.菁优网版权所有
【专题】51D:化学键与晶体结构.
【分析】(1)Si元素是14号元素处于第三周期IVA族,结合构造原理书写核外电子排布式;N原子2p轨道为半充满稳定状态,第一电离能高于同周期相邻元素的;
(2)C60属于分子晶体;C60属于分子晶体,设分子中有x个五元环,y个六元环,根据均摊原理,一个C连接3个环,一个五元环中含有碳原子数目为5,一个六元环中含有C碳原子数目=62,由碳原子数目可知:x+2y=60,每碳原子形成3个棱,每个棱为2个碳原子共用,含有棱为90,结合:顶点数+面数﹣棱数=2,列方程计算;
(3)N60晶体属于分子晶体,分子之间为范德华力,N原子之间形成共价键;
(4)B原子有3个价电子,N原子有5个价电子,每个B原子利用3个价电子形成普通共价键外,还可以提供空轨道,接受N原子的孤电子对,形成1个配位键,于是在立方氮化硼晶体中B原子、N原子都采取sp3杂化,和金刚石中碳原子的杂化方式一样,形成正四面体空间网状结构;
(5)均摊法计算晶胞中M原子数目、N60分子数目,再计算晶胞质量,晶体密度=晶胞质量÷晶胞体积;金属M的配位数为4,配位数之比等于相应微粒数目反比。
【解答】解:(1)Si元素是14号元素处于第三周期IVA族,核外电子排布式为:1s22s22p63s23p2;N原子2p轨道为半充满稳定状态,第一电离能高于同周期相邻元素的,故N元素第一电离能较大,
故答案为:1s22s22p63s23p2;N;
(2)C60属于分子晶体;C60属于分子晶体,设分子中有x个五元环,y个六元环,根据均摊原理,一个C连接3个环,一个五元环中含有碳原子数目为5,一个六元环中含有C碳原子数目=62,由碳原子数目可知:x+2y=60,每碳原子形成3个棱,每个棱为2个碳原子共用,含有棱为90,则:60+x+y﹣90=2,联立解得x=12,y=20,故C60分子中五元环与六元环的数目比为12:20=3:5,
故答案为:分子;3:5;
(3)N60晶体属于分子晶体,分子之间为范德华力,N原子之间形成共价键,
故答案为:AD;
(4)B原子有3个价电子,N原子有5个价电子,在立方氮化硼晶体中,每个B原子利用3个价电子形成普通共价键外,还可以通过空轨道,接受N原子的孤电子对,形成1个配位键,于是在立方氮化硼晶体中B原子、N原子都采取sp3杂化,和金刚石中碳原子的杂化方式一样,形成与金刚石类似的正四面体空间网状结构,
故答案为:B原子有3个价电子,N原子有5个价电子,在立方氮化硼晶体中,每个B原子利用3个价电子形成普通共价键外,还可以通过空轨道,接受N原子的孤电子对,形成1个配位键,于是在立方氮化硼晶体中B原子、N原子都采取sp3杂化,和金刚石中碳原子的杂化方式一样,形成与金刚石类似的正四面体空间网状结构。;
(5)晶胞中M原子数目=4、N60分子数目=864,晶胞质量=4g,晶体密度=4g÷(k×10﹣10cm)3g•cm﹣3;金属M的配位数为4,M原子与N60分子数目之比为1:1,二者配位数相等,故N60分子的配位数也是4,
故答案为:;4。
【点评】本题考查物质结构与性质,涉及核外电子排布、电离能、化学键、晶胞结构与计算等,是对学生综合能力的考查,需要学生具备扎实的基础,注意同周期主族元素第一电离能变化异常情况。
四、【选修题】[化学一选修5:有机化学基础](15分)
12.芳香族化合物 A(C9H12O)常用于药物及香料的合成,A 有如下转化关系: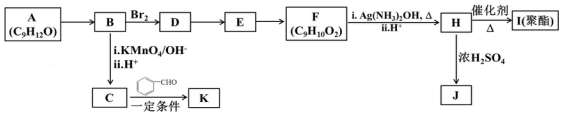
已知以下信息:
①A不能使酸性高锰酸钾溶液褪色;
②![]()
![]() +CO2
+CO2
③RCOCH3+R′CHORCOOH═CHR′
回答下列问题:
(1)A生成B的反应条件为: 浓硫酸,加热 ,由D生成E的反应类型为 取代反应 。
(2)F的官能团名称为 醛基和羟基 。
(3)K的结构简式为 ![]() ,由H生成I的反应方程式为 n
,由H生成I的反应方程式为 n
 +(n﹣1)H2O 。
+(n﹣1)H2O 。
(4)J为一种具有3个六元环的酯,则其结构简式为 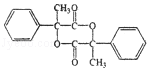 。
。
(5)F的同分异构体中,能与NaHCO3反应生成CO2的有 14 种,其中核磁共振氢谱为4组峰,且峰面积比为6:2:1:1的为 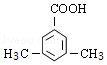 或
或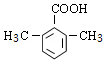 (写出其中一种结构简式)。
(写出其中一种结构简式)。
(6)糠叉丙酮(![]() )是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁基氯[(CH3)3CCl]和糠醛(
)是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁基氯[(CH3)3CCl]和糠醛(![]() )为原料制备糠叉丙酮的合成路线(无机试剂任用)。合成流程图示例如下:CH2═CH2CH3CH2BrCH3CH2OH。
)为原料制备糠叉丙酮的合成路线(无机试剂任用)。合成流程图示例如下:CH2═CH2CH3CH2BrCH3CH2OH。
【考点】HB:有机物的推断;HC:有机物的合成.菁优网版权所有
【专题】534:有机物的化学性质及推断.
【分析】芳香族化合物A的分子式为C9H12O,A的不饱和度4,则侧链没有不饱和键,A转化得到的B能发生信息②中的反应,说明B中含有碳碳双键,应是A发生醇的消去反应生成B,而A不能使酸性高锰酸钾溶液褪色,故A为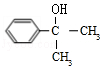 ,则B为
,则B为 ,D为
,D为 ,C为
,C为 ,C发生信息③的反应,K为
,C发生信息③的反应,K为![]() .由F的分子式可知,D发生水解反应生成E为
.由F的分子式可知,D发生水解反应生成E为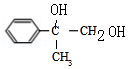 ,E发生氧化反应生成F为
,E发生氧化反应生成F为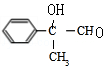 ,F发生银镜反应然后酸化得到H为
,F发生银镜反应然后酸化得到H为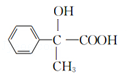 ,H发生缩聚反应生成I为
,H发生缩聚反应生成I为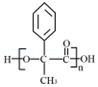 .J为一种具有3个六元环的酯,则其结构简式为
.J为一种具有3个六元环的酯,则其结构简式为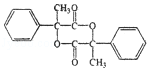 ,以此解答该题。
,以此解答该题。
【解答】解:(1)A在浓硫酸、加热条件下发生消去反应生成B,D发生水解反应生成E,为取代反应,
故答案为:浓硫酸,加热;取代反应;
(2)F为 ,含有的官能团为名称为醛基和羟基,故答案为:醛基和羟基;
,含有的官能团为名称为醛基和羟基,故答案为:醛基和羟基;
(3)根据以上分析,K为![]() ,由H生成I的反应方程式为n
,由H生成I的反应方程式为n
 +(n﹣1)H2O,
+(n﹣1)H2O,
故答案为:![]() ;n
;n
 +(n﹣1)H2O;
+(n﹣1)H2O;
(4)J为一种具有3个六元环的酯,其结构简式为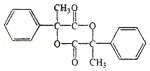 ,故答案为:
,故答案为: ;
;
(5)F(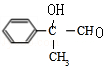 )的同分异构体中,能与NaHCO3反应生成CO2,说明含有羧基,如分子中含有3个取代基,可为2个甲基、1个羧基,有6种同分异构体,如含有2个取代基,可为乙基、羧基,有邻、间、对3种,如为甲基、﹣CH2COOH,也有邻、间、对3种,如含有1个取代基,则可为﹣CH2CH2COOH、﹣CH2(COOH)CH3,则共14种,
)的同分异构体中,能与NaHCO3反应生成CO2,说明含有羧基,如分子中含有3个取代基,可为2个甲基、1个羧基,有6种同分异构体,如含有2个取代基,可为乙基、羧基,有邻、间、对3种,如为甲基、﹣CH2COOH,也有邻、间、对3种,如含有1个取代基,则可为﹣CH2CH2COOH、﹣CH2(COOH)CH3,则共14种,
核磁共振氢谱为4组峰,且峰面积比为6:2:1:1的有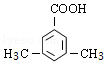 或
或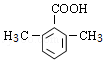 ,
,
故答案为:14; 或
或 ;
;
(6)(CH3)3CCl发生消去反应生成(CH3)2C=CH2,(CH3)2C=CH2发生信息②的反应生成![]() ,
,![]() 和
和![]() 反应生成
反应生成![]() .合成路线流程图为:
.合成路线流程图为: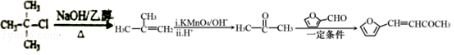 ,
,
故答案为: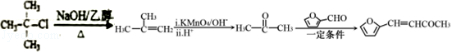 。
。
【点评】本题考查有机物推断和有机合成,为高频考点,侧重考查学生的分析能力,明确有机物官能团及其性质、物质之间的转化、反应条件及基本概念是解本题关键,侧重考查学生知识综合运用、知识迁移能力,注意采用正逆结合的方法进行推断。
声明:试题解析著作权属菁优网所有,未经书面同意,不得复制发布
日期:2019/4/14 18:58:12;用户:tp;邮箱:lsgjgz137@xyh.com;学号:21474120