
湖南省醴陵二中、醴陵四中2016-2017学年高二下学期期中联考化学试卷
03月05日
2018-2019学年重庆市南开中学高三(上)第一次月考化学试卷
一.选择题(本题包括16小题,每小题3分,共48分.每小题只有一个选项符合题意.)
1.(3分)化学与生活密切相关,下列有关说法错误的是( )
A.用灼烧的方法可以区分蚕丝和人造纤维
B.食用油反复加热会产生稠环芳香烃等有害物质
C.加热能杀死流感病毒是因为蛋白质受热变性
D.医用消毒酒精中乙醇的浓度为95%
2.(3分)下列说法中不正确的是( )
A.氟化银可用于人工降雨
B.从海水中获取食盐不需要化学变化
C.FeCl3溶液可用于制作印刷电路板
D.绿矾可用来生产铁系列净水剂
3.(3分)下列说法正确的是( )
A.精密pH试纸测得某酸溶液的pH为3.5
B.Fe(OH)3胶体和FeSO4溶液均能产生丁达尔效应
C.容量瓶使用前应检漏、润洗
D.在日常生活中,化学腐蚀是造成钢铁腐蚀的主要原因
4.(3分)下列反应中,金属元素被氧化的是( )
A.2FeCl2+Cl2=2FeCl3
B.H2+CuOCu+H2O
C.Na2O+H2O=2NaOH
D.2KmnO4K2MnO4+MnO2+O2↑
5.(3分)下列说法不正确的是( )
A.氯气可用于合成药物
B.碳酸钠可用于治疗胃酸过多
C.高压钠灯常用来广场照明
D.镁合金密度小强度大可用于制飞机零部件
6.(3分)下列反应的离子方程式的书写正确的是( )
A.氧化钠投入水中:O2﹣+H2O=2OH﹣
B.FeCl3溶液与KI反应:2Fe3++2KI=2Fe2++I2+2K+
C.过量硫酸氢铵与氢氧化钡反应:Ba2++2OH﹣+SO42﹣+2H+=BaSO4↓+2H2O
D.过量CO2 通入到 NaClO溶液中:H2O+CO2+2ClO﹣=2HClO+CO32﹣
7.(3分)恒温条件下,在体积不变的密闭容器中,有可逆反应X(s)+2Y(g)⇌2Z(g)△H<0,下列说法一定正确的是( )
A.0.2molX和0.4molY充分反应,Z的物质的量可能会达到0.35mol
B.从容器中移出部分反应物X,则正反应速率将下降
C.当△H不变时,反应将达到平衡
D.向反应体系中继续通入足量Y气体,X有可能被反应完全
8.(3分)设NA为阿伏加德罗常数的值,下列说法确的是( )
A.常温下,22g CO2所含的共用电子对数目为NA
B.标准状况下,22.4L NO与11.2L O2混合后气体中分子总数小于NA
C.将1L 0.1mol•L﹣1FeCl3溶液滴入沸水中,制得的Fe(OH)3胶粒数目为0.1NA
D.常温下,1L 0.5mol•L﹣1NH4Cl溶液与2L 0.25mol•L﹣1NH4Cl溶液中的NH4+数目相同
9.(3分)常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.无色透明溶液中:Zn2+、SO42﹣、NH4+,Cl﹣
B.0.1mol•L﹣1NaHCO3溶液中:Mg2+、Al3+、K+、NO3﹣
C.能使甲基橙变黄的溶液中:Na+,CH3COO﹣、MnO4﹣、Fe3+
D.1×1012的溶液中:NO3﹣、I﹣、K+、Fe2+
10.(3分)工业上用铋酸钠(NaBiNO3)检验溶液中的Mn2+,反应方程式为:4MnSO4+10NaBiO3+14H2SO4═4NaMnO4+5Bi2(SO4)3+3Na2SO4+□,下列说法不正确的是( )
A.“□”内的物质为水,配平系数为14
B.若生成1mol NaMnO4,则转移5mol e﹣
C.反应方程式中的硫酸可换为盐酸
D.溶液中有Mn2+的现象是溶液变为紫红色
11.(3分)下列实验操作、现象和结论均正确的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | 向某溶液中加入NaOH 溶液,并将红色石蕊试纸置于溶液中 | 试纸变蓝 | 原溶液中有NH4+ |
| B | 向苏打和小苏打溶液中分别加入盐酸 | 均冒气泡 | 两者均能与盐酸反应 |
| C | 向某溶液中滴加氯水后,再加KSCN溶液 | 溶液变红 | 该溶液中一定有Fe3+ |
| D | 向某无色溶液中滴加BaCl2溶液 | 产生白色沉淀 | 该无色溶液中一定含有SO42﹣ |
A.AB.BC.CD.D
12.(3分)能正确表示下列反应的离子方程式是( )
A.向次氯酸钠溶液中通入足量SO2气体:ClO﹣+SO2+H2O═HClO+HSO3﹣
B.0.1mol/LNH4Al(SO4)2溶液与0.2mol/LBa(OH)2溶液等体积混合:Al3++2SO42﹣+2Ba2++4OH﹣═2BaSO4↓+AlO2﹣+2H2O
C.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4﹣+6H++5H2O2═2Mn2++5O2↑+8H2O
D.Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I﹣═2Fe2++I2+3H2O
13.(3分)将0.2mol KMnO4在一定温度下加热后生成a mol O2;将剩余固体与过量浓盐酸混合加热又生成b mol Cl2,此时锰元素均以Mn2+形式存在.若a+b=m,则m的值可能为( )
A.0.30B.0.35C.0.40D.0.50
14.(3分)实验室模拟工业漂白液(有效成分为NaClO)脱除废水中氨氮(NH3)的流程如下:
![]()
下列分析正确的是( )
A.①中采用蒸馏的方法精制粗盐水
B.②中阳极的主要电极反应:4OH﹣﹣4e﹣=2H2O+O2↑
C.③中制备漂白液的反应:Cl2+OH﹣=Cl﹣+HClO
D.②、③、④中均发生了氧化还原反应
15.(3分)下列关于物质分类的说法正确的是( )
A.根据原子核外电子数的多少.可将元素分为金属元素、非金属元素、稀有气体
B.根据含氧酸分子中所含氢原子个数,可将酸分为一元酸、二元酸、三元酸等
C.汽油、漂白粉、氨水、盐酸均为混介物
D.氢氧化钙、硫酸钡、醋酸、食盐水均为电解质
16.(3分)如图所示,一密闭气缸被一不漏气但可滑动的活塞隔开分成两部分.反应前,左边充有N2,右边充有H2、O2的混合气体;20℃时,将右边混合气体点燃,反应后冷却到20℃,若活塞最终静置于气缸的中央(液体体积忽略不计).则反应前容器中N2和O2的物质的量之比可能为( )
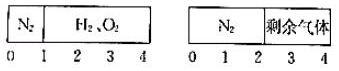
A.3:5B.5:4C.2:7D.2:5
二.非选择题(本题包括5小题,共52分.)
17.(10分)Ⅰ:某实验小组为探究ClO﹣、I2、SO42﹣在酸性条件下的氧化性强弱,设计实验如下:
实验①:在淀粉﹣碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝;
实验②:向实验①的溶液中加入4ML 0.5mol•L﹣1的亚硫酸钠溶液,蓝色恰好完全褪去。
(1)写出实验①中发生反应的离子方程式: 。
(2)实验②的化学反应中转移电子的物质的量是 。
(3)以上实验说明,在酸性条件下ClO﹣、I2、SO42﹣的氧化性由弱到强的顺序是 。
Ⅱ.(4)Cl2、H2O2、ClO2(还原产物为Cl﹣)、O3(1mol O3转化为1mol O2和1mol H2O)等物质常被用作消毒剂。等物质的量的上述物质消毒效率最高的是 (填序号)。
A.Cl2B.H2O2C.ClO2D.O3
(5)“84”消毒液(主要成分是NaClO)和洁厕剂(主要成分是浓盐酸)不能混用,原因是 (用离子方程式表示)。
18.(12分)现有A、B、C、D、E、F六种常见化合物,已知它们包含的阳离子有K+、Ag+、Na+、Ba2+、Fe2+、Al3+,阴离子有Cl﹣、OH﹣、Al、N、S、C.将它们分别配成0.1mol/L的溶液进行如下实验:
①测得A、C、E溶液均呈碱性,且碱性A>E>C,E的焰色呈浅紫色(透过蓝色钴玻璃观察);
②向B溶液中滴加稀氨水至过量,先生成沉淀,后沉淀全部溶解;
③向F溶液中滴加稀硝酸,溶液变成棕黄色,且有无色气体生成;
④向D溶液中滴加Ba(NO3)2溶液,无明显现象。
(1)写出A、D、E、F的化学式:
A ;D ;E ;F 。
(2)用离子方程式解释C溶液呈碱性的原因: 。
(3)写出实验③中反应的离子方程式: 。
19.(12分)NaCN是重要的基本化工原料,常用于基本化学合成、冶金等,回答下列问题:
(1)NaCN中C的化合价为 ;写出NaCN的电子式: ;
(2)现代开采金矿:先以NaCN溶液浸取粉碎的含金(Au)矿石,得到 Na[Au(CN)2](二氰合金酸钠)溶液;再用锌与Na[Au(CN)2]溶液发生置换反应生成金。“粉碎”的目的是 ;“浸取”反应的氧化剂是 ;消耗的锌与生成的金的物质的量之比为 。
(3)工业上常用纯碱、焦炭、氨气反应制备NaCN,写出反应的化学方程式,并用单线桥标明电子转移的方向和数目: 。
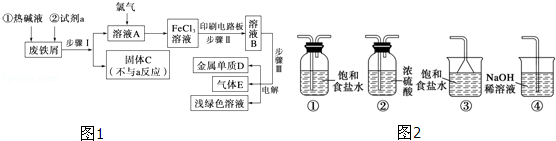
20.(12分)以废铁屑为原料制备FeCl3溶液,用作印刷电路铜板腐蚀剂,并对溶液B进行电解处理的实验流程如图1:
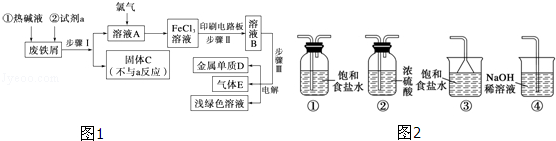
(1)试剂a应选用 (填写名称);
(2)步骤Ⅰ用到的主要玻璃仪器有漏斗、 (填写仪器名称);
(3)写出步骤Ⅱ中主要反应的化学方程式: ;
(4)实验室制取气体E的离子方程式是 ,欲对气体E进行干燥和吸收,需选用下列装置(图2)中的 (填写序号);
(5)如何用化学方法检验气体E? .
21.(6分)碱式碳酸铝镁[MgaAlb(OH)c(CO3)d•xH2O]常用作塑料阻燃剂。
(1)碱式碳酸铝镁具有阻燃作用,是由于其受热分解需吸收大量热量和 。
(2)[MgaAlb(OH)c(CO3)d•xH2O]中的a、b、c、d的代数关系式为 。
(3)为确定碱式碳酸铝镁的组成,进行如下实验:
①准确称取3.390g样品与足量稀盐酸充分反应,生成CO20.560L(已换算成标准状况下)。
②另取一定量样品在空气中加热,样品的固体残留率(100%)随温度的变化如图所示(样品在270℃时已完全失去结晶水,600℃以上残留固体为金属氧化物的混合物)。
根据以上实验数据计算碱式碳酸铝镁样品中的n(OH﹣):n(CO32﹣)(写出计算过程)。
2018-2019学年重庆市南开中学高三(上)第一次月考化学试卷
参考答案与试题解析
一.选择题(本题包括16小题,每小题3分,共48分.每小题只有一个选项符合题意.)
1.(3分)化学与生活密切相关,下列有关说法错误的是( )
A.用灼烧的方法可以区分蚕丝和人造纤维
B.食用油反复加热会产生稠环芳香烃等有害物质
C.加热能杀死流感病毒是因为蛋白质受热变性
D.医用消毒酒精中乙醇的浓度为95%
【考点】11:化学的主要特点与意义;14:物质的组成、结构和性质的关系.菁优网版权所有
【专题】56:化学应用.
【分析】A.蚕丝含有蛋白质,灼烧时具有烧焦的羽毛气味;
B.食用油反复加热会生成苯并芘等物质;
C.加热可导致蛋白质变性;
D.医用消毒酒精中乙醇的浓度为75%。
【解答】解:A.蚕丝含有蛋白质,灼烧时具有烧焦的羽毛气味,为蛋白质的特有性质,可用于鉴别蛋白质类物质,故A正确;
B.食用油反复加热会生成苯并芘等稠环芳香烃物质,可致癌,故B正确;
C.加热可导致蛋白质变性,一般高温可杀菌,故C正确;
D.医用消毒酒精中乙醇的浓度为75%,故D错误。
故选:D。
【点评】本题综合考查元素化合物知识,为高频考点,侧重于化学与生活、生产的考查,有利于培养学生良好的科学素养,提高学习的积极性,注意相关基础知识的积累,难度不大。
2.(3分)下列说法中不正确的是( )
A.氟化银可用于人工降雨
B.从海水中获取食盐不需要化学变化
C.FeCl3溶液可用于制作印刷电路板
D.绿矾可用来生产铁系列净水剂
【考点】14:物质的组成、结构和性质的关系.菁优网版权所有
【专题】513:物质的性质和变化专题.
【分析】A.氟化银难分解;
B.蒸发海水可以获得食盐;
C.氯化铁具有氧化性,可氧化铜生成氯化铜;
D.绿矾易被氧化为三价铁.
【解答】解:A.氟化银比较稳定,在空气中不分解,不能用于人工降雨,故A错误;
B.蒸发海水可以获得食盐,蒸发属于物理变化,所以从海水中获取食盐不需要化学变化,故B正确;
C.氯化铁具有氧化性,可氧化铜生成氯化铜,则FeCl3溶液可用于制作印刷电路板,故C正确;
D.绿矾是硫酸亚铁晶体,亚铁离子易被氧化为三价铁,三价铁盐可用来生产铁系列净水剂,故D正确。
故选:A。
【点评】本题考查化学与环境、海水综合利用、物质的性质与应用等,为高频考点,侧重于基础知识的综合理解和运用的考查,题目难度不大,注意对相关知识的积累.
3.(3分)下列说法正确的是( )
A.精密pH试纸测得某酸溶液的pH为3.5
B.Fe(OH)3胶体和FeSO4溶液均能产生丁达尔效应
C.容量瓶使用前应检漏、润洗
D.在日常生活中,化学腐蚀是造成钢铁腐蚀的主要原因
【考点】U5:化学实验方案的评价.菁优网版权所有
【专题】25:实验评价题.
【分析】A.精密pH试纸可准确到0.1;
B.丁达尔现象为胶体特有的性质;
C.容量瓶不能润洗;
D.电化学腐蚀比化学腐蚀更普遍.
【解答】解:A.精密pH试纸可准确到0.1,则精密pH试纸测得某酸溶液的pH为3.5,故A正确;
B.丁达尔现象为胶体特有的性质,则FeSO4溶液不能产生丁达尔效应,故B错误;
C.容量瓶不能润洗,使用前应检漏,故C错误;
D.电化学腐蚀比化学腐蚀更普遍,则电化学腐蚀是造成钢铁腐蚀的主要原因,故D错误;
故选:A。
【点评】本题考查化学实验方案的评价,为高频考点,把握物质的性质、实验操作、仪器的使用、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.
4.(3分)下列反应中,金属元素被氧化的是( )
A.2FeCl2+Cl2=2FeCl3
B.H2+CuOCu+H2O
C.Na2O+H2O=2NaOH
D.2KmnO4K2MnO4+MnO2+O2↑
【考点】B1:氧化还原反应.菁优网版权所有
【专题】515:氧化还原反应专题.
【分析】发生的反应中,金属元素被氧化,则为化合价在升高,以此来解答.
【解答】解:A.2FeCl2+Cl2=2FeCl3,Fe元素的化合价由+2升高到+3价被氧化,故A选;
B.H2+CuOCu+H2O,Cu元素的化合价由+2降低到0价被还原,故B不选;
C.Na2O+H2O=2NaOH,没有元素的化合价变化,不属于氧化还原反应,故C不选;
D.2KmnO4K2MnO4+MnO2+O2↑,Mn元素的化合价降低被还原,故D不选;
故选:A。
【点评】本题考查氧化还原反应,把握发生的反应及反应中元素的化合价变化为解答关键,侧重氧化还原反应判断的考查,题目难度不大.
5.(3分)下列说法不正确的是( )
A.氯气可用于合成药物
B.碳酸钠可用于治疗胃酸过多
C.高压钠灯常用来广场照明
D.镁合金密度小强度大可用于制飞机零部件
【考点】14:物质的组成、结构和性质的关系.菁优网版权所有
【专题】513:物质的性质和变化专题.
【分析】A.根据氯气的用途判断;
B.治疗胃酸过多,首先应选择一种能够和胃酸发生的物质,而且这种物质没有腐蚀性;
C.钠的焰色反应为黄色;
D.合金密度小、强度大.
【解答】解:A.氯气的用途比较广泛,可用于合成多种药物,故A正确;
B.治疗胃酸过多,首先应选择一种能够和胃酸发生的物质,而且这种物质没有腐蚀性,碳酸钠碱性太强,不能用作胃药,可以用碳酸氢钠治疗胃酸过多,故B错误;
C.钠的焰色反应为黄色,穿透力强,可用于广场照明,高压钠灯常用于道路和广场的照明,故C正确;
D.合金密度小、强度大、熔点高,所以镁合金能应用于火箭、飞机等部件,故D正确;
故选:B。
【点评】本题考查物质的性质和用途,题目难度不大,建议学习中注重相关基础知识的积累,侧重于考查学生对基础知识的应用能力.
6.(3分)下列反应的离子方程式的书写正确的是( )
A.氧化钠投入水中:O2﹣+H2O=2OH﹣
B.FeCl3溶液与KI反应:2Fe3++2KI=2Fe2++I2+2K+
C.过量硫酸氢铵与氢氧化钡反应:Ba2++2OH﹣+SO42﹣+2H+=BaSO4↓+2H2O
D.过量CO2 通入到 NaClO溶液中:H2O+CO2+2ClO﹣=2HClO+CO32﹣
【考点】49:离子方程式的书写.菁优网版权所有
【专题】516:离子反应专题.
【分析】A.氧化物应保留化学式;
B.碘化钾为可溶性盐,应拆成离子形式;
C.硫酸氢铵过量,氢氧根离子只与氢离子反应;
D.二氧化碳过量,反应生成次氯酸和碳酸氢钠.
【解答】解:A.氧化钠投入水中,离子方程式:Na2O+H2O=2Na++2OH﹣,故A错误;
B.FeCl3溶液与KI反应,离子方程式:2Fe3++2I﹣=2Fe2++I2,故B错误;
C.过量硫酸氢铵与氢氧化钡反应,离子方程式:Ba2++2OH﹣+SO42﹣+2H+=BaSO4↓+2H2O,故C正确;
D.过量CO2 通入到 NaClO溶液中,离子方程式:CO2+H2O+ClO﹣=HClO+HCO3﹣,故D错误;
故选:C。
【点评】本题考查了离子方程式的判断,明确反应实质,掌握离子方程式正误判断常用方法是解题关键,注意反应物用量对反应的影响,题目难度不大.
7.(3分)恒温条件下,在体积不变的密闭容器中,有可逆反应X(s)+2Y(g)⇌2Z(g)△H<0,下列说法一定正确的是( )
A.0.2molX和0.4molY充分反应,Z的物质的量可能会达到0.35mol
B.从容器中移出部分反应物X,则正反应速率将下降
C.当△H不变时,反应将达到平衡
D.向反应体系中继续通入足量Y气体,X有可能被反应完全
【考点】CB:化学平衡的影响因素.菁优网版权所有
【专题】51E:化学平衡专题.
【分析】A.可逆反应中Y不能完全转化生成Z;
B.移出部分反应物X,反应速率不变;
C.△H与热化学方程式有关;
D.向反应体系中继续通入足量Y气体,平衡正向移动,但不能完全转化。
【解答】解:A.可逆反应中Y不能完全转化生成Z,则Z的物质的量小于0.4mol,Z的物质的量可能会达到0.35mol,故A正确;
B.移出部分反应物X,反应速率不变,平衡不移动,故B错误;
C.△H与热化学方程式有关,不能利用△H判定平衡状态,故C错误;
D.向反应体系中继续通入足量Y气体,平衡正向移动,但不能完全转化,则X不能被反应完全,故D错误;
故选:A。
【点评】本题考查化学平衡的影响因素,为高频考点,把握可逆反应的特点及平衡移动原理为解答的关键,侧重分析与应用能力的考查,注意选项C为解答的难点,题目难度不大。
8.(3分)设NA为阿伏加德罗常数的值,下列说法确的是( )
A.常温下,22g CO2所含的共用电子对数目为NA
B.标准状况下,22.4L NO与11.2L O2混合后气体中分子总数小于NA
C.将1L 0.1mol•L﹣1FeCl3溶液滴入沸水中,制得的Fe(OH)3胶粒数目为0.1NA
D.常温下,1L 0.5mol•L﹣1NH4Cl溶液与2L 0.25mol•L﹣1NH4Cl溶液中的NH4+数目相同
【考点】4F:阿伏加德罗常数.菁优网版权所有
【分析】A、求出二氧化碳的物质的量,然后根据二氧化碳中含4对共用电子对来分析;
B、NO和氧气反应后生成的NO2中存在平衡:2NO2⇌N2O4;
C、一个氢氧化铁胶粒是多个氢氧化铁的聚集体;
D、溶液越稀,盐水解的程度越大。
【解答】解:A.CO2分子含有4个共价键即4对共用电子对,22g即0.5mol CO2所含的共用电子对数目为2NA,故A错误;
B.标准状况下,22.4L即1molNO与11.2L即0.5molO2混合后,2NO+O2═2NO2,而二氧化氮中存在平衡:2NO2⇌N2O4,导致气体分子数减小,故所得气体中分子总数小于NA,故B正确;
C.Fe(OH)3胶粒是许多Fe(OH)3的集合体,所以将1L 0.1mol•L﹣1FeCl3溶液滴入沸水中,制得的Fe(OH)3胶粒数目小于0.1NA,故C错误;
D.稀释有利于盐类水解,常温下,1L 0.5mol•L﹣1NH4Cl溶液与2L 0.25mol•L﹣1NH4Cl溶液中的NH4+的水解程度,前者小于后者,所以NH4+数目前者大于后者,故D错误。
故选:B。
【点评】本题考查了物质的量和阿伏伽德罗常数的有关计算,难度不大,掌握公式的运用和物质的结构是解题关键。
9.(3分)常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.无色透明溶液中:Zn2+、SO42﹣、NH4+,Cl﹣
B.0.1mol•L﹣1NaHCO3溶液中:Mg2+、Al3+、K+、NO3﹣
C.能使甲基橙变黄的溶液中:Na+,CH3COO﹣、MnO4﹣、Fe3+
D.1×1012的溶液中:NO3﹣、I﹣、K+、Fe2+
【考点】DP:离子共存问题.菁优网版权所有
【分析】A.无色溶液不含有色离子,离子之间不反应且无色的能大量共存;
B.能和碳酸氢钠反应的不能大量共存;
C.使甲基橙变黄色的溶液可能呈酸性、中性或碱性,和氢离子或氢氧根离子反应的不能大量共存;
D.该溶液呈酸性,相互反应的且和氢离子反应的离子不能大量共存。
【解答】解:A.这几种离子都无色且离子之间不反应,所以能大量共存,故A正确;
B.HCO3﹣和Mg2+、Al3+反应生成沉淀和气体而不能大量共存,故B错误;
C.酸性条件下CH3COO﹣、MnO4﹣发生氧化还原反应而不能大量共存,碱性或中性条件下,Fe3+生成沉淀而不能大量共存,故C错误;
D.该溶液呈酸性,NO3﹣、I﹣发生氧化还原反应且NO3﹣、Fe2+发生氧化还原反应而不能大量共存,故D错误;
故选:A。
【点评】本题考查离子共存,明确离子共存条件及离子性质是解本题关键,注意题干中限制性条件,注意CD中隐含条件,题目难度不大。
10.(3分)工业上用铋酸钠(NaBiNO3)检验溶液中的Mn2+,反应方程式为:4MnSO4+10NaBiO3+14H2SO4═4NaMnO4+5Bi2(SO4)3+3Na2SO4+□,下列说法不正确的是( )
A.“□”内的物质为水,配平系数为14
B.若生成1mol NaMnO4,则转移5mol e﹣
C.反应方程式中的硫酸可换为盐酸
D.溶液中有Mn2+的现象是溶液变为紫红色
【考点】B1:氧化还原反应;B3:氧化还原反应方程式的配平.菁优网版权所有
【分析】根据原子守恒定律判断“口”内的物质为水,配平系数为14,则该反应中Mn2+→MnO4﹣,锰元素化合价由+2升高到+7,则生成1mol NaMnO4,则转移5mole﹣,溶液变为紫红色,盐酸也可被NaBiO3氧化,据此判断。
【解答】解:A、根据质量守恒定律判断“口”内的物质为水,配平系数为14,故A正确;
B、锰元素化合价由+2升高到+7,则生成1mol NaMnO4,则转移5mole﹣,故B正确;
C、盐酸可被NaBiO3氧化,所以反应方程式中的硫酸不可换为盐酸,故C错误;
D、该反应中Mn2+→MnO4﹣,溶液中有Mn2+的现象是溶液变为紫红色,故D正确;
故选:C。
【点评】本题考查了氧化还原反应的综合应用,主要考查概念应用电子守恒、原子守恒的应用。
11.(3分)下列实验操作、现象和结论均正确的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | 向某溶液中加入NaOH 溶液,并将红色石蕊试纸置于溶液中 | 试纸变蓝 | 原溶液中有NH4+ |
| B | 向苏打和小苏打溶液中分别加入盐酸 | 均冒气泡 | 两者均能与盐酸反应 |
| C | 向某溶液中滴加氯水后,再加KSCN溶液 | 溶液变红 | 该溶液中一定有Fe3+ |
| D | 向某无色溶液中滴加BaCl2溶液 | 产生白色沉淀 | 该无色溶液中一定含有SO42﹣ |
A.AB.BC.CD.D
【考点】U5:化学实验方案的评价.菁优网版权所有
【专题】25:实验评价题.
【分析】A.氨气可使湿润的红色石蕊试纸变蓝,但检验铵根离子不能将红色石蕊试纸置于溶液中;
B.苏打和小苏打均与盐酸反应生成二氧化碳;
C.滴加氯水可氧化亚铁离子;
D.白色沉淀可能为硫酸钡、AgCl等.
【解答】解:A.氨气可使湿润的红色石蕊试纸变蓝,但检验铵根离子不能将红色石蕊试纸置于溶液中,且溶液显碱性不一定含铵根离子,故A错误;
B.苏打和小苏打均与盐酸反应生成二氧化碳,则均冒气泡,故B正确;
C.滴加氯水可氧化亚铁离子,不能说明溶液中一定有Fe3+,故C错误;
D.白色沉淀可能为硫酸钡、AgCl等,则原溶液可能含SO42﹣,故D错误;
故选:B。
【点评】本题考查化学实验方案的评价,为高频考点,把握物质的性质、反应与现象、离子检验、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.
12.(3分)能正确表示下列反应的离子方程式是( )
A.向次氯酸钠溶液中通入足量SO2气体:ClO﹣+SO2+H2O═HClO+HSO3﹣
B.0.1mol/LNH4Al(SO4)2溶液与0.2mol/LBa(OH)2溶液等体积混合:Al3++2SO42﹣+2Ba2++4OH﹣═2BaSO4↓+AlO2﹣+2H2O
C.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4﹣+6H++5H2O2═2Mn2++5O2↑+8H2O
D.Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I﹣═2Fe2++I2+3H2O
【考点】49:离子方程式的书写.菁优网版权所有
【专题】516:离子反应专题.
【分析】A.次氯酸根离子具有强的氧化性,能够氧化二氧化硫生成硫酸根离子;
B.溶液中NH4Al(SO4)2与Ba(OH)2以物质的量之比1:2混合,反应生成氢氧化铝、硫酸钡和一水合氨;
C.高锰酸钾具有强的氧化性,能够氧化氯离子;
D.三价铁具有氧化性能氧化碘离子.
【解答】解:A.次氯酸具有氧化性,亚硫酸氢根离子具有还原性,次氯酸能将亚硫酸根离子氧化,即ClO﹣+SO2+H2O═SO42﹣+Cl﹣+2H+,故A错误;
B.溶液中NH4Al(SO4)2与Ba(OH)2以物质的量之比1:2混合,离子方程式:2Ba2++NH4++Al3++2SO42﹣+4OH﹣═Al(OH)3↓+2BaSO4↓++NH3.H2O,故B错误;
C.高锰酸钾具有强的氧化性,能够氧化氯离子,所以不能用盐酸酸化,故C错误;
D.氧化铁可溶于氢碘酸,三价铁具有氧化性能氧化碘离子,反应的离子方程式为:Fe2O3+2I﹣+6H+=2Fe2++3H2O+I2,故D正确;
故选:D。
【点评】本题考查了离子方程式的书写原则和注意问题,侧重考查氧化还原反应的离子方程式书写,明确反应实质是解题关键,题目难度中等.
13.(3分)将0.2mol KMnO4在一定温度下加热后生成a mol O2;将剩余固体与过量浓盐酸混合加热又生成b mol Cl2,此时锰元素均以Mn2+形式存在.若a+b=m,则m的值可能为( )
A.0.30B.0.35C.0.40D.0.50
【考点】5A:化学方程式的有关计算.菁优网版权所有
【专题】559:利用化学方程式的计算.
【分析】KMnO4固体在一定温度下加热,反应后的残留固体中与过量的浓盐酸,收集到气体为氯气,根据电子转移守恒,整个过程中,Mn元素获得电子等于O元素、Cl元素获得的电子,则有:0.2×(7﹣2)=4a+2b,整理得a+b=0.5﹣a,当高氯酸钾没有分解时,(a+b)达极大值,当高锰酸钾完全分解生成氧气时,生成氧气最多,生成氯气最少,根据方程式计算氧气最大值,进而确定(a+b)的最小值.
【解答】解:KMnO4固体在一定温度下加热,反应后的残留固体中与过量的浓盐酸,收集到气体为氯气,根据电子转移守恒,整个过程中,Mn元素获得电子等于O元素、Cl元素获得的电子,则有:0.2×(7﹣2)=4a+2b,整理得a+b=0.5﹣a,
当高氯酸钾没有分解时,即a=0,(a+b)达极大值,故(a+b)<0.5,
当高锰酸钾完全分解生成氧气时,生成氧气最多,生成氯气最少,由2KMnO4K2MnO4+MnO2+O2↑,可知生成氧气最大的物质的量为0.2mol0.1mol,故a+b≥0.5﹣0.1=0.4,
故选:C。
【点评】本题考查混合物计算、氧化还原反应计算,注意充分利用整个过程中的电子转移守恒解答,关键是用氧气物质的量表示出m的表达式.
14.(3分)实验室模拟工业漂白液(有效成分为NaClO)脱除废水中氨氮(NH3)的流程如下:
![]()
下列分析正确的是( )
A.①中采用蒸馏的方法精制粗盐水
B.②中阳极的主要电极反应:4OH﹣﹣4e﹣=2H2O+O2↑
C.③中制备漂白液的反应:Cl2+OH﹣=Cl﹣+HClO
D.②、③、④中均发生了氧化还原反应
【考点】P8:物质分离和提纯的方法和基本操作综合应用;U3:制备实验方案的设计.菁优网版权所有
【专题】546:无机实验综合.
【分析】粗盐水经提纯得到精致盐水,电解生成氯气,氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠,次氯酸钠与氨气发生氧化还原反应可生成氮气、氯化钠,达到脱除废水氨氮的目的,以此解答该题。
【解答】解:A.蒸馏不能除去食盐中的固体杂质,故A错误;
B.电解饱和食盐水,阳极生成氯气,发生2Cl﹣﹣2e﹣=Cl2↑,故B错误;
C.③中制备漂白液的反应为Cl2+2OH﹣=Cl﹣+ClO﹣+H2O,故C错误;
D.②电解食盐水生成氯气,③发生Cl2+2OH﹣=Cl﹣+ClO﹣+H2O,④次氯酸钠与氨气发生氧化还原反应可生成氮气、氯化钠,均发生了氧化还原反应,故D正确。
故选:D。
【点评】本题综合考查物质的制备以及分离提纯,为高频考点,侧重考查学生的分析能力和实验能力,注意把握物质的性质以及实验的原理,难度不大。
15.(3分)下列关于物质分类的说法正确的是( )
A.根据原子核外电子数的多少.可将元素分为金属元素、非金属元素、稀有气体
B.根据含氧酸分子中所含氢原子个数,可将酸分为一元酸、二元酸、三元酸等
C.汽油、漂白粉、氨水、盐酸均为混介物
D.氢氧化钙、硫酸钡、醋酸、食盐水均为电解质
【考点】37:混合物和纯净物;3A:酸、碱、盐、氧化物的概念及其相互联系.菁优网版权所有
【专题】512:物质的分类专题.
【分析】A、最外层电子数少的不一定是金属元素;
B、根据酸能电离出的氢离子个数来分类;
C、混合物是指由不同物质组成的;
D、电解质是指在水溶液或是熔融状态下导电的化合物.
【解答】解:A、最外层电子数少的不一定是金属元素,如氢元素的最外层电子数为1,但为非金属元素,故A错误;
B、根据酸分子中电离出的氢离子个数,将酸分为一元酸、二元酸和多元酸,故B错误;
C、汽油、漂白粉、氨水和盐酸均由不同物质组成,为混合物,故C正确;
D、氢氧化钙、硫酸钡和醋酸在水溶液或是熔融状态下导电,属于电解质,但是食盐水是混合物,不是电解质,故D错误。
故选:C。
【点评】本题考查混合物、电解质、和金属元素非金属元素的辨别和定义,难度不大,注意把握概念的区别.
16.(3分)如图所示,一密闭气缸被一不漏气但可滑动的活塞隔开分成两部分.反应前,左边充有N2,右边充有H2、O2的混合气体;20℃时,将右边混合气体点燃,反应后冷却到20℃,若活塞最终静置于气缸的中央(液体体积忽略不计).则反应前容器中N2和O2的物质的量之比可能为( )
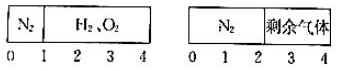
A.3:5B.5:4C.2:7D.2:5
【考点】5A:化学方程式的有关计算.菁优网版权所有
【专题】559:利用化学方程式的计算.
【分析】反应前左右压强都相等,气体的物质的量之比等于体积之比,设氮气的物质的量为1mol,则氢气、氧气的混合气体为3mol,反应后恢复至原来的温度,活塞正好停留在容器的中间,说明反应后左右气体的物质的量相等,右室中剩余气体为1mol,剩余的气体可能为氢气,也可能为氧气,据此讨论计算.
【解答】解:令氮气的物质的量为1mol,反应前,左右两室的体积之比为1:3,反应前右室的物质的量为3mol,反应后,活塞处于中央,两室体积相等,则两室中气体的物质的量相等,反应后右室气体物质的量为1mol,发生反应2H2+O22H2O,
设H2、O2的物质的量分别为xmol、ymol,
若氢气过量,则:x﹣2y=1,x+y=3,解得x,y,
若氧气过量,则:y﹣0.5x=1,x+y=3,解得x,y,
反应前容器中N2和O2的物质的量之比可能为1:3:2或1:3:5,
故选:A。
【点评】本题考查混合物计算,注意左室中气体物质的量不变,据此根据体积变化判断右室反应前后气体物质的量,再利用赋值法与讨论法计算,题目难度中等.
二.非选择题(本题包括5小题,共52分.)
17.(10分)Ⅰ:某实验小组为探究ClO﹣、I2、SO42﹣在酸性条件下的氧化性强弱,设计实验如下:
实验①:在淀粉﹣碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝;
实验②:向实验①的溶液中加入4ML 0.5mol•L﹣1的亚硫酸钠溶液,蓝色恰好完全褪去。
(1)写出实验①中发生反应的离子方程式: ClO﹣+2I﹣+2H+=I2+Cl﹣+H2O 。
(2)实验②的化学反应中转移电子的物质的量是 0.004mol 。
(3)以上实验说明,在酸性条件下ClO﹣、I2、SO42﹣的氧化性由弱到强的顺序是 SO42﹣<I2<ClO﹣ 。
Ⅱ.(4)Cl2、H2O2、ClO2(还原产物为Cl﹣)、O3(1mol O3转化为1mol O2和1mol H2O)等物质常被用作消毒剂。等物质的量的上述物质消毒效率最高的是 C (填序号)。
A.Cl2B.H2O2C.ClO2D.O3
(5)“84”消毒液(主要成分是NaClO)和洁厕剂(主要成分是浓盐酸)不能混用,原因是 ClO﹣+Cl﹣+2H+═Cl2↑+H2O (用离子方程式表示)。
【考点】49:离子方程式的书写;B2:氧化性、还原性强弱的比较.菁优网版权所有
【分析】Ⅰ、(1)次氯酸根离子具有氧化性,能将碘离子样啊互为碘单质;
(2)化合价升高值=化合价降低值=转移电子数,据此回答;
(3)根据氧化剂氧化性大于氧化产物的氧化性判断;
Ⅱ、(4)1mol Cl2(发生的反应为Cl2+H2O=HCl+HClO)、H2O2、ClO2、O3分别消毒时,转移电子依次为1mol、1mol、5mol、2mol,以此判断;
(5)ClO﹣与浓盐酸中的Cl﹣会发生反应生成有毒的Cl2。
【解答】解:I、(1)实验①说明酸性条件下,次氯酸钠把碘离子氧化生成碘单质,同时自身被还原生成氯离子,该反应中,次氯酸根离子得电子作氧化剂,碘离子失电子是还原剂,氧化产物是碘,所以氧化性强弱为:ClO﹣>I2,反应离子方程式为:ClO﹣+2I﹣+2H+=I2+Cl﹣+H2O,故答案为:ClO﹣+2I﹣+2H+=I2+Cl﹣+H2O;
(2)实验②说明碘单质把亚硫酸根离子氧化生成硫酸根离子,自身被还原生成碘离子,氧化剂是碘,还原剂是亚硫酸钠,氧化产物是硫酸根离子,所以氧化性强弱为:I2>SO42﹣,反应离子方程式为:H2O+I2+SO32﹣=SO42﹣+2I﹣+2H+,
设转移电子的物质的量为x。
H2O+SO32﹣+I2=SO42﹣+2I﹣+2H+转移电子
1mol 2mol
0.5mol/L×0.004L x
x0.004mol,
故答案为:0.004 mol;
(3)实验①说明氧化性强弱为:ClO﹣>I2,实验②说明氧化性强弱为:I2>SO42﹣,所以在酸性条件下ClO﹣、I2、SO42﹣的氧化性由弱到强的顺序是SO42﹣<I2<ClO﹣,故答案为:SO42﹣<I2<ClO﹣;
II、(4)1mol Cl2(发生的反应为Cl2+H2O=HCl+HClO)、H2O2、ClO2、O3分别消毒时,转移电子依次为1mol、1mol、5mol、2mol,等物质的量的上述物质反应,ClO2转移的电子数最多,消毒效率最高,
故答案为:C;
(5)ClO﹣与浓盐酸中的Cl﹣会发生反应生成有毒的Cl2,方程式为ClO﹣+Cl﹣+2H+═Cl2↑+H2O,
故答案为:ClO﹣+Cl﹣+2H+═Cl2↑+H2O。
【点评】本题综合考查学生物质的性质以及应用、氧化还原反应中的基本知识、离子方程式的书写,侧重于分析能力和计算能力的考查,为高频考点,有利于培养学生的良好的科学素养,提高学生学习的积极性。
18.(12分)现有A、B、C、D、E、F六种常见化合物,已知它们包含的阳离子有K+、Ag+、Na+、Ba2+、Fe2+、Al3+,阴离子有Cl﹣、OH﹣、Al、N、S、C.将它们分别配成0.1mol/L的溶液进行如下实验:
①测得A、C、E溶液均呈碱性,且碱性A>E>C,E的焰色呈浅紫色(透过蓝色钴玻璃观察);
②向B溶液中滴加稀氨水至过量,先生成沉淀,后沉淀全部溶解;
③向F溶液中滴加稀硝酸,溶液变成棕黄色,且有无色气体生成;
④向D溶液中滴加Ba(NO3)2溶液,无明显现象。
(1)写出A、D、E、F的化学式:
A Ba(OH)2 ;D AlCl3 ;E KAlO2 ;F FeSO4 。
(2)用离子方程式解释C溶液呈碱性的原因: CO32﹣+H2O⇌HCO3﹣+OH﹣ 。
(3)写出实验③中反应的离子方程式: 3Fe2++NO3﹣+4H+=3Fe3++NO↑+2H2O 。
【考点】49:离子方程式的书写;DD:盐类水解的应用;PT:物质的检验和鉴别的实验方案设计.菁优网版权所有
【专题】19:物质检验鉴别题.
【分析】根据溶液A、C、E呈碱性,且碱性为A>E>C可推知A含有OH﹣、E含有AlO2﹣、C含有CO32﹣;根据向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失可推知溶液中含Ag+;根据向F溶液中滴加稀硝酸,溶液变成棕黄色,且有无色气体生成,可知F含Fe2+;向D溶液中滴加Ba(NO3)2溶液,无明显现象,说明D溶液中无SO42﹣,由离子共存知识可推知ABCDEF溶液依次为Ba(OH)2、AgNO3、Na2CO3、AlCl3、KAlO2、FeSO4溶液,结合对应物质的性质解答该题。
【解答】解:根据溶液A、C、E呈碱性,且碱性为A>E>C可推知A含有OH﹣、E含有AlO2﹣、C含有CO32﹣;根据向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失可推知溶液中含Ag+;根据向F溶液中滴加稀硝酸,溶液变成棕黄色,且有无色气体生成,可知F含Fe2+;向D溶液中滴加Ba(NO3)2溶液,无明显现象,说明D溶液中无SO42﹣,由离子共存知识可推知ABCDEF溶液依次为Ba(OH)2、AgNO3、Na2CO3、AlCl3、KAlO2、FeSO4溶液,
(1)由以上分析可知A为Ba(OH)2,D为AlCl3,E为KAlO2,F为FeSO4,
故答案为:Ba(OH)2;AlCl3;KAlO2;FeSO4;
(2)C为Na2CO3,为强碱弱酸盐,水解呈碱性,在溶液中发生:CO32﹣+H2O⇌HCO3﹣+OH﹣,
故答案为:CO32﹣+H2O⇌HCO3﹣+OH﹣;
(3)亚铁离子与硝酸根离子在酸性条件下发生氧化还原反应,反应的离子方程式为3Fe2++NO3﹣+4H+=3Fe3++NO↑+2H2O,
故答案为:3Fe2++NO3﹣+4H+=3Fe3++NO↑+2H2O。
【点评】本题考查物质的检验和鉴别的实验方案的设计,侧重于离子共存和离子方程式的书写,注意把握相关物质的性质,根据反应的现象结合离子共存知识解答该题,题目难度中等。
19.(12分)NaCN是重要的基本化工原料,常用于基本化学合成、冶金等,回答下列问题:
(1)NaCN中C的化合价为 +2价 ;写出NaCN的电子式: ![]() ;
;
(2)现代开采金矿:先以NaCN溶液浸取粉碎的含金(Au)矿石,得到 Na[Au(CN)2](二氰合金酸钠)溶液;再用锌与Na[Au(CN)2]溶液发生置换反应生成金。“粉碎”的目的是 增大接触面积,加快反应速率 ;“浸取”反应的氧化剂是 O2 ;消耗的锌与生成的金的物质的量之比为 1:2 。
(3)工业上常用纯碱、焦炭、氨气反应制备NaCN,写出反应的化学方程式,并用单线桥标明电子转移的方向和数目: ![]() +2NH3═2NaCN+3H2O 。
+2NH3═2NaCN+3H2O 。
【考点】43:电子式;B1:氧化还原反应.菁优网版权所有
【分析】(1)化合物中正负化合价代数和为0,NaCN为离子化合物,C、N之间为共价键;
(2)“粉碎”可增大接触面积,“浸取”反应中Au元素的化合价升高,结合电子守恒计算;
(3)用纯碱、焦炭、氨气反应制备NaCN,只有C元素的化合价变化,该反应转移2e﹣。
【解答】解:(1)NaCN中,Na是+1价,N是﹣3价,根据正负化合价代数和为0知,C是+2价,也可以由HCN的结构式确定,H﹣C≡N中非金属性强的N是﹣3价,H是+1价,故C是+2价,NaCN是HCN的钠盐,二者碳元素化合价相同。依据HCN的结构式可以写出NaCN的电子式为![]() ,
,
故答案为:+2价;
(2)“粉碎”含金矿石可以“增大接触面积,加快反应速率”。由NaCN、Au和Na[Au(CN)2]可知,只有Au的化合价由0升高到+1,其他元素化合价没有变化,这时应考虑空气中的氧气参与了反应,故“浸取”反应的氧化剂是空气中的O2.抓住“置换”理解:锌元素的化合价由0升高到+2、金元素的化合价由+1降低到0,根据得失电子守恒知,消耗的锌与生成的金的物质的量之比为1:2,
故答案为:增大接触面积,加快反应速率;O2;1:2;
(3)Na2CO3中的C(+4价)与焦炭(0价)发生归中反应生成NaCN(C为+2价),即焦炭是还原剂、Na2CO3是氧化剂,则反应及电子转移方向和数目为![]() +2NH3═2NaCN+3H2O,
+2NH3═2NaCN+3H2O,
故答案为:![]() +2NH3═2NaCN+3H2O。
+2NH3═2NaCN+3H2O。
【点评】本题考查氧化还原反应,为高频考点,把握物质的性质、发生的反应、电子守恒为解答的关键,侧重分析与应用能力的考查,注意元素的化合价变化,题目难度不大。
20.(12分)以废铁屑为原料制备FeCl3溶液,用作印刷电路铜板腐蚀剂,并对溶液B进行电解处理的实验流程如图1:
(1)试剂a应选用 稀盐酸 (填写名称);
(2)步骤Ⅰ用到的主要玻璃仪器有漏斗、 烧杯、玻璃棒 (填写仪器名称);
(3)写出步骤Ⅱ中主要反应的化学方程式: 2FeCl3+Cu═2FeCl2+CuCl2 ;
(4)实验室制取气体E的离子方程式是 MnO2+4H++2Cl﹣Mn2++Cl2↑+2H2O ,欲对气体E进行干燥和吸收,需选用下列装置(图2)中的 ②④ (填写序号);
(5)如何用化学方法检验气体E? 将湿润的淀粉KI试纸靠近集气瓶口,试纸变蓝,证明该气体为Cl2 .
【考点】DI:电解原理;GO:铁盐和亚铁盐的相互转变.菁优网版权所有
【专题】51I:电化学专题;527:几种重要的金属及其化合物.
【分析】(1)铁与盐酸反应生成氯化亚铁;
(2)依据过滤用到的玻璃仪器:漏斗、玻璃棒、烧杯解答;
(3)三氯化铁与铜反应生成氯化亚铁和氯化铜;
(4)实验室用二氧化锰与浓盐酸反应生成氯化锰、水和氯气制备氯气,氯气与浓硫酸不反应,可用浓硫酸干燥,氯气有毒,不能直接排放在空气中,在饱和食盐水中溶解度很小,能与氢氧化钠反应而被吸收;
(5)氯气具有强氧化性能氧化碘化钾生成单质碘,单质碘遇到淀粉变蓝.
【解答】解:(1)铁与盐酸反应生成氯化亚铁,故答案为:稀盐酸;
(2)过滤用到的玻璃仪器有:漏斗、玻璃棒、烧杯,故答案为:烧杯、玻璃棒;
(3)三氯化铁与铜反应生成氯化亚铁和氯化铜,反应的化学方程式为:2FeCl3+Cu═2FeCl2+CuCl2,故答案为:2FeCl3+Cu═2FeCl2+CuCl2;
(4)二氧化锰与浓盐酸反应的离子方程式为:MnO2+4H++2Cl﹣Mn2++Cl2↑+2H2O;氯气与浓硫酸不反应,可用浓硫酸干燥氯气;氯气有毒不能直接排放到空气中,尾气用氢氧化钠吸收;
故答案为:MnO2+4H++2Cl﹣Mn2++Cl2↑+2H2O;②④;
(5)氯气具有强氧化性能氧化碘化钾生成单质碘,单质碘遇到淀粉变蓝,所以将湿润的淀粉KI试纸靠近集气瓶口,试纸变蓝,证明该气体为Cl2,
故答案为:将湿润的淀粉KI试纸靠近集气瓶口,试纸变蓝,证明该气体为Cl2.
【点评】本题考查了铁盐、亚铁盐、氯气的性质,题目难度不大,注意不同价态铁元素之间的转化是高考的热点,注意相关知识的积累.
21.(6分)碱式碳酸铝镁[MgaAlb(OH)c(CO3)d•xH2O]常用作塑料阻燃剂。
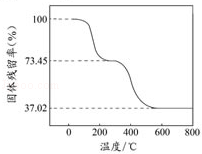
(1)碱式碳酸铝镁具有阻燃作用,是由于其受热分解需吸收大量热量和 生成的产物具有阻燃作用 。
(2)[MgaAlb(OH)c(CO3)d•xH2O]中的a、b、c、d的代数关系式为 2a+3b=c+2d 。
(3)为确定碱式碳酸铝镁的组成,进行如下实验:
①准确称取3.390g样品与足量稀盐酸充分反应,生成CO20.560L(已换算成标准状况下)。
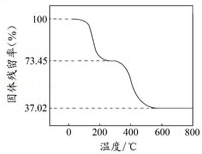
②另取一定量样品在空气中加热,样品的固体残留率(100%)随温度的变化如图所示(样品在270℃时已完全失去结晶水,600℃以上残留固体为金属氧化物的混合物)。
根据以上实验数据计算碱式碳酸铝镁样品中的n(OH﹣):n(CO32﹣)(写出计算过程)。
【考点】1B:真题集萃;M5:复杂化学式的确定.菁优网版权所有
【专题】1A:计算题.
【分析】(1)氧化镁、氧化铝熔点较高且都不燃烧;
(2)根据化合物中各元素化合价的代数和为0确定这几个字母之间的关系;
(3)n(CO2)2.50×10﹣2mol,m(CO2)=2.50×10﹣2mol×44g/mol=1.10g,
在270℃~600℃之间,失去结晶水后的样品进一步受热分解生成CO2、H2O,
m(CO2)+m(H2O)=3.390g×(0.7345﹣0.3702)=1.235g,
m(H2O)=1.235g﹣1.10g=0.135g,
生成1个H2O需要2个OH﹣,则存在n(OH﹣)=2n(H2O),根据C原子守恒计算n(CO32﹣),从而得出二者的比值。
【解答】解:(1)碱式碳酸铝镁[MgaAlb(OH)c(CO3)d•xH2O]受热分解最终生成MgO、Al2O3,MgO、Al2O3的熔点较高且都不燃烧,所以有阻燃作用,
故答案为:生成的产物具有阻燃作用;
(2)化合物中各元素化合价的代数和为0,所以2a+3b+c+4d=(c+3d)×2,所以得2a+3b=c+2d,
故答案为:2a+3b=c+2d;
(3)n(CO2)2.50×10﹣2mol,m(CO2)=2.50×10﹣2mol×44g/mol=1.10g,
在270℃~600℃之间,失去结晶水后的样品进一步受热分解生成CO2、H2O,
m(CO2)+m(H2O)=3.390g×(0.7345﹣0.3702)=1.235g,
m(H2O)=1.235g﹣1.10g=0.135g,
n(H2O)7.50×10﹣3mol,
生成1个H2O需要2个OH﹣,则存在n(OH﹣)=2n(H2O)=1.50×10﹣2mol,根据C原子守恒得n(CO32﹣)=n(CO2)=2.50×10﹣2mol,所以n(OH﹣):n(CO32﹣)=1.50×10﹣2mol:2.50×10﹣2mol=3:5,
答:碱式碳酸铝镁样品中的n(OH﹣):n(CO32﹣)=3:5。
【点评】本题考查了镁铝化合物知识,根据物质的性质、物质之间的反应来分析解答,注意结合原子守恒进行分析,明确图象中曲线变化趋势及其含义,题目难度中等。
声明:试题解析著作权属菁优网所有,未经书面同意,不得复制发布
日期:2019/4/14 18:43:11;用户:tp;邮箱:lsgjgz137@xyh.com;学号:21474120