
湖南省醴陵二中、醴陵四中2016-2017学年高二下学期期中联考化学试卷
03月05日
2006年全国普通高等学校招生统一考试
上海 化学试卷
本试卷分为第I卷(第1—4页)和第II卷(第5—12页)两部分。全卷共12页。满分150分,考试时间120分钟。
第I卷 (共66分)
考生注意:
1.答第I卷前,考生务必在答题卡上用钢笔或圆珠笔清楚填写姓名、准考证号、校验码,并用铅笔正确涂写准考证号和校验码。
2.第I卷(1—22小题),由机器阅卷,答案必须全部涂写在答题纸上。考生应将代表正确答案的小方格用铅笔涂黑。注意试题题号和答题纸编号一一对应,不能错位。答案需要更改时,必须将原选项用橡皮擦去,重新选择。答案不能写在试卷上,写在试卷上一律不给分。
3.第II卷第23题和第26题为分叉题,各分为A、B两题,A题适合使用二期课改新教材考生解答,B题适合使用一期课改教材考生解答。但考生可任选一题。若两题均做,一律按A题计分。
相对原于质量: H—1 C—12 N—14 0—16 Mg—24 S.32 C1—35.5 Fe—56
一.选择题(本题共10分),每小题2分,只有一个正确选项,答案涂写在答题纸上。
1.石油是一种重要能源,人类正面临着石油短缺、油价上涨的困惑。以下解决能源问题的方法不当的是
A.用木材作燃料 B。用液氢替代汽油 C.开发风能 D.开发地热
2.以下化学用语正确的是
A.乙烯的结构简式CH2CH2B.乙酸的分子式C2H4O2
C.明矾的化学式KAlSO4·12H2O D.氯化钠的电子式Na
3.科学家发现C60后,近年又合成了许多球形分子(富勒烯),如C50、C70、C120、C540等它们互称为
A.同系物 B.同分异构体 C.同素异形体 D.同位素
4.下列不符合当今化学研究方向的是
A.发现新物质 B.合成新材料
C.研究化学反应的微观过程 D.研究化学反应中原子守恒关系
5.下列有机物命名正确的是
A、2-乙基丙烷
B.CH3CH2CH2CH2OH 1-丁醇
C、
间二甲苯
D. 2—甲基—2—丙烯
二、选择题(本题36分)每小题3分、只有一个正确选项,答案涂写在答题纸上。
6.下列含有非极性键的共价化合物是
A.HCl B.Na2O2C.C2H2D.CH4
7.下列反应中生成物总能量高于反应物总能量的是
A.碳酸钙受热分解 B.乙醇燃烧
C.铝粉与氧化铁粉末反应 D.氧化钙溶于水
8.某非金属单质A和氧气发生化合反应生成B。B为气体,其体积是反应掉氧气体积的两倍(同温同压)。以下对B分子组成的推测一定正确的是
A.有1个氧原子 B.有2个氧原子
C.有1个A原子 D.有2个A原子
9.二甘醇可用作溶剂、纺织助剂等,一旦进入人体会导致急性肾衰竭,危及生命。二甘醇的结构简式是HO—CH2CH2—O—CH2CH2—OH。下列有关二甘醇的叙述正确的是
A.不能发生消去反应 B.能发生取代反应
C.能溶于水,不溶于乙醇 D.符合通式CnH2nO3
10.已知某溶液中存在较多的H+、SO42-、NO3-,则溶液中还可能大量存在的离子组是
A.A13+、CH3COO—、C1—B.Na+、NH4+、C1—
C.Mg2+、C1—、Fe2+D. Mg2+、Ba2+、Br—
11.已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。玻璃管内
装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确
的是
| ① | ② | ③ | 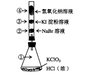 ④ ④ | |
| A | 黄绿色 | 橙色 | 蓝色 | 白色 |
| B | 无色 | 橙色 | 紫色 | 白色 |
| C | 黄绿色 | 橙色 | 蓝色 | 无色 |
| D | 黄绿色 | 无色 | 紫色 | 白色 |
12.NA代表阿伏加德罗常数,下列说法正确的是
A.9gD2O中含有的电子数为5NA
B.1molMgCl2中含有的离子数为2NA
C.1molCH4分子中共价键总数为4NA
D.7.1g C12与足量NaOH溶液反应转移的电子数为0.2NA
13.将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是
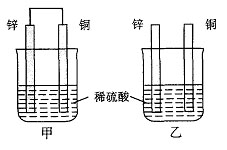
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速度甲比乙慢
14.下列物质能通过化合反应直接制得的是
①FeCl2②H2SO4③NH4NO3④HCl
A.只有①②③ B.只有②③
C. 只有①③④ D.全部
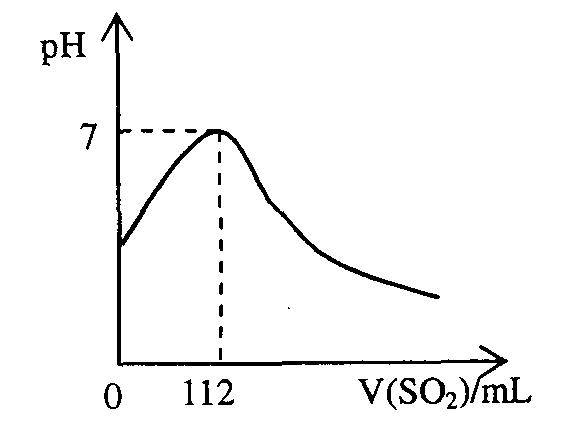 15.在标准状况下,向100mL氢硫酸溶液中通人二氧化硫气体,溶液pH变化如图所示,则原氢硫酸溶液的物质的量浓度为
15.在标准状况下,向100mL氢硫酸溶液中通人二氧化硫气体,溶液pH变化如图所示,则原氢硫酸溶液的物质的量浓度为
A.0.5mol/L B.0.05mol/L
C.1mol/L D.0.1mol/L
16.将相同质量的铜分别和过量浓硝酸、稀硝酸反应,下列叙述正确的是
A.反应速率:两者相同
B.消耗硝酸的物质的量:前者多,后者少
C.反应生成气体的颜色:前者浅,后者深
D.反应中转移的电子总数:前者多,后者少
17.根据相关化学原理,下列判断正确的是
A.若X是原子晶体,Y是分子晶体,则熔点:X B.若A2十2D—→2A—十D2,则氧化性:D2>A2 C.若R2—和M+的电子层结构相同,则原子序数:R>M D.若弱酸HA的酸性强于弱酸HB,则同浓度钠盐溶液的碱性:NaA 三.选择题(本题共20分),每小题4分,每小题有一个或两个正确选项。只有一个正确选项的,多选不给分:有两个正确选项的,选对一个给2分,选错一个该小题不给分,答案涂写在答题纸上。 18.右图是气体制取装置,下列能用此装置制取气体并能“随开随用、随关随停”的是 C.浓盐酸和二氧化锰制取氯气 D.电石和水制取乙炔 19.下列离子方程式中正确的是 A.H2SO4与Ba(OH)2溶液反应:Ba2++2OH—+2H+十SO42-→ BaSO4↓+2H2O B.Ca(HCO3)2与过量Ca(OH)2溶液反应:Ca2++HCO3-+2OH-→CaCO3↓+ CO32-+2H2O C.Na2CO3溶液中通入少量CO2: CO32-+ CO2+ H2O→2HCO3- D.CH3COOH溶液与NaOH溶液反应: H++ OH—→H2O 20.室温下,下列溶液等体积混合后,所得溶液的pH一定大于7的是 A 0.1mol/L的盐酸和0.1mol/L的氢氧化钠溶液 B.0.1mol/L的盐酸和0.1mol/L的氢氧化钡溶液 C.pH=4的醋酸溶液和pH=10的氢氧化钠溶液 D.pH=4的盐酸和pH=l0的氨水 21.为确定某溶液的离子组成,进行如下实验: ①测定溶液的pH,溶液显强碱性。 ②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体。 ③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀。 ④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加Ag NO3溶液,产生白色沉淀。 根据实验以下推测正确的是 A.一定有SO32-离子 B.一定有CO32-离子 C.不能确定C1—离子是否存在 D.不能确定HCO3-离子是否存在 22.已知Ba(AlO2)2可溶于水。右图表示的是向A12(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加人Ba(OH)2的物质的量x的关系。下列有关叙述正确的是 B.c—d时溶液中离子的物质的量:AlO2-比Ba2+多 C.a—d时沉淀的物质的量: BaSO4可能小于A1(OH)3 D.d—e时溶液中离子的物质的量:Ba2+可能等于OH- 第II卷(共84分) 考生注意: 1.答第II卷前,考生务必将姓名、准考证号、校验码等填写湾楚。 2.第II卷从第23题到第31题,考生应用钢笔或圆珠笔将答案直接写在试卷上。 四、(本题共24分) 考生注意:23题为分叉题,分A、B两题,考生可任选一题。若两题均做,一律按A题计分。A题适合使用二期课改新教材的考生解答,B题适合使用一期课改教材的考生解答。 23(A) _______________________________________________________________________________ 23.(B) 下表中的实线表示元素周期表的部分边界。①-⑤分别表示元素周期表中对应位置的元素。 a.元素①的单质 b.元素②的单质 c.元素①②形成的合金 d.无法判断 24. (1)请将5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。 _________+__________→__________+__________+__________+H2O (2)反应物中发生氧化反应的物质__________,被还原的元素是_________。 (3)反应中1 mol氧化剂_______(填“得到”或“失去”)___________ mol电子。 (4)请将反应物的化学式及配平后的系数填入下列相应的位置中: __________+ __________→ 25. K值大小与温度的关系是:温度升高,K值______________ (填一定增大、一定减小、或可能增大也可能减小)。 (2)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应: CO(g)十H2O(g) CO和H2O浓度变化如下图,则 0—4min的平均反应速率v(CO)=______ mol/(L·min) (3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。 ①表中3min—4min之间反应处于_________状态; C1数值_________0.08 mol/L (填大于、小于或等于)。 ②反应在4min—5min问,平衡向逆方向移动,可能的原因是________(单选), 表中5min—6min之间数值发生变化,可能的原因是__________(单选)。 a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度 考生注意:26题为分叉题,分A、B两题,考生可任选一题。若两题均做,一律按A题计分。A题适合使用二期课改新教材的考生解答,B题适合使用一期课改教材的考生解答。 得固体M的成分,设计了如右图装置。倾斜A使稀硫酸(足量)与固体M充分反应,待反应停止后,B装置增重,C装置中溶液无变化,反应后进入量气管气体的体积为VmL(已折算成标准状况) 由上述实验事实可知: (1)①固体M中一定有的物质是______________(填化学式) 理由是__________________________________________________________________________ ②其中一种物质的质量可以确定为___________g(用代数式表示)。 (2)B装置的名称是________。 写出B装置中反应的离子方程式_______________________________________。 (3)C装置的作用是_________________________,如果实验中没有B装置,则C装置中产生的现象是____________________________________________________________________。 (4)稀硫酸和固体M反应后溶液中还残留淡黄色固体,该固体是_____________,要分离出该固体,在实验操作中,除烧杯外还需要用到的玻璃仪器是_____________。 (5)通过进一步实验,测得固体M中各种成分的质量之和小于反应前铁粉和硫粉的质量之和,产生这种现象的原因可能是_____________ a.M中有未反应的铁和硫 b.测定气体体积时水准管的水面高于量气管的水面 c.A中留有反应生成的气体 d.气体进入D装置前未用浓硫酸干燥 26 (B) 某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯 (1)制备粗品 将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热 至反应完全,在试管C内得到环己烯粗品。 ①A中碎瓷片的作用是____________,导管B除了导气外还具有的作用是____________。 ②试管C置于冰水浴中的目的是________________________________________________。 (2)制备精品 a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液 ②再将环己烯按右图装置蒸馏,冷却水 从_________口进入。蒸馏时要加入生石灰, 目的是__________________。 ③收集产品时,控制的温度应在_________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是( ) a.蒸馏时从70℃开始收集产品 b.环己醇实际用量多了 c.制备粗品时环己醇随产品一起蒸出 (3)以下区分环己烯精品和粗品的方法,合理的是_________。 a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点 27、蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成。由蛇纹石制取碱式碳酸镁的实验步骤如下 (4)物质循环使用,能节约资源。上述实验中,可以循环使用的物质是__________________ (填写物质化学式)。 (5)现设计一个实验,确定产品aMgCO3·bMg(OH)2·cH2O中a、b、c的值,请完善下列实验步骤(可用试剂:浓硫酸、碱石灰): ①样品称量 ②高温分解 ③____________________________________ ④____________________________________ ⑤MgO称量 (6)18.2g产品完全分解后,产生6.6gCO2和8.0g MgO,由此可知,产品的化学式中: a=_________ b =_________ C =_________ 六 (本题共20分) 28.已知 降冰片烯的分子结构可表示为: a.能溶于水 b.能发生氧化反应 c.能发生加成反应 d.常温常压下为气体 29.已知 A为有机合成中间体,在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其中的一种B可用于制取合成树脂、染料等多种化工产品。A能发生如下图所示的变化。 七、(本题共16分) 30.合成氨工业生产中所用的α—Fe催化剂的主要成分是FeO、Fe2O3 (1)某FeO、Fe2O3混合物中,铁、氧的物质的量之比为4:5,其中Fe2+与Fe3+物质的量之比为___________。 (2)当催化剂中Fe2+与Fe3+的物质的量之比为1:2时,其催化活性最高,此时铁的氧化物混合物中铁的质量分数为_____________(用小数表示,保留2位小数)。 高温 2 Fe2O3十C → 4FeO十CO2↑。为制得这种活性最高的催化剂,应向480g Fe2O3粉末中加入炭粉的质量为_________g。 一定条件下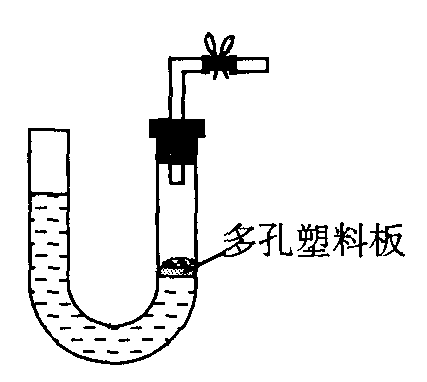 A.大理石和稀硫酸制取二氧化碳 B.锌粒和稀硫酸制氢气
A.大理石和稀硫酸制取二氧化碳 B.锌粒和稀硫酸制氢气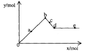 A.a—b时沉淀的物质的量:A1(OH)3比BaSO4多
A.a—b时沉淀的物质的量:A1(OH)3比BaSO4多
甲、乙的最高价氧化物水化物的酸性强弱为:________>________ (用化学式表示)。
元素③氢化物的电子式为_______。![]() CO2(g)十H2(g)十Q(Q>0)
CO2(g)十H2(g)十Q(Q>0)
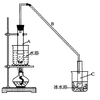
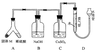 26(A)某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所
26(A)某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所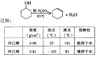
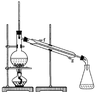 ①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_________层(填上或下),分液后用_________ (填入编号)洗涤。
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_________层(填上或下),分液后用_________ (填入编号)洗涤。
氢氧化物 Fe(OH)3 Al(OH)3 Mg(OH)2 开始沉淀pH 1.5 3.3 9.4
Ca(OH)2不能过量,若Ca(OH)2过量可能会导致_________溶解、_________沉淀。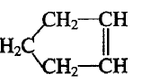 可简写为
可简写为
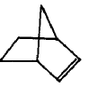
a.环烃 b.不饱和烃 c.烷烃 d.芳香烃![]() (注:R,R’为烃基)
(注:R,R’为烃基)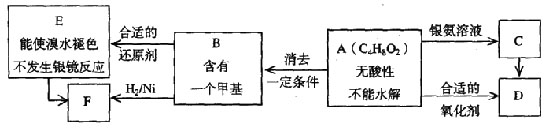 试回答
试回答
a.具有酸性______________________b.能发生水解反应______________________
a.氧化反应 b.还原反应 c.加成反应 d.取代反应
31.已知: 4NH3十5O2→ 4NO+6H2O
4NO十3O2十2H2O→4HNO3
设空气中氧气的体积分数为0.20,氮气体积分数为0.80,请完成下列填空及计算
①在下图中画出HNO3的物质的量n(A)和空气的物质的量n(B)关系的理论曲线。
②写出当125≤n(B) ≤ 200时,n(A)和n(B)的关系式_________________________________。
2006年全国普通高等学校招生统一考试参考答案
一、选择题(本题10分),每小题2分,只有一个正确选项
(1)A (2)B (3)C (4)D (5)B
二、选择题(本题36分),每小题3分,只有一个正确选项.
(6)C (7)A (8)A (9)B (10)B (11)A (12)C (13)C (14)D (15)D (16)B (17)D
三、选择题(本题共20分),每小题4分,每小题有一个或两个正确选项.只有一个正确选项的,多选不给分;有两个正确选项的,选对一个给2分,选错一个该小题不给分.
(18)B (19)AC (20)BD (21)BC (22)B
四、(本题共24分)
23(A).(本题共8分)
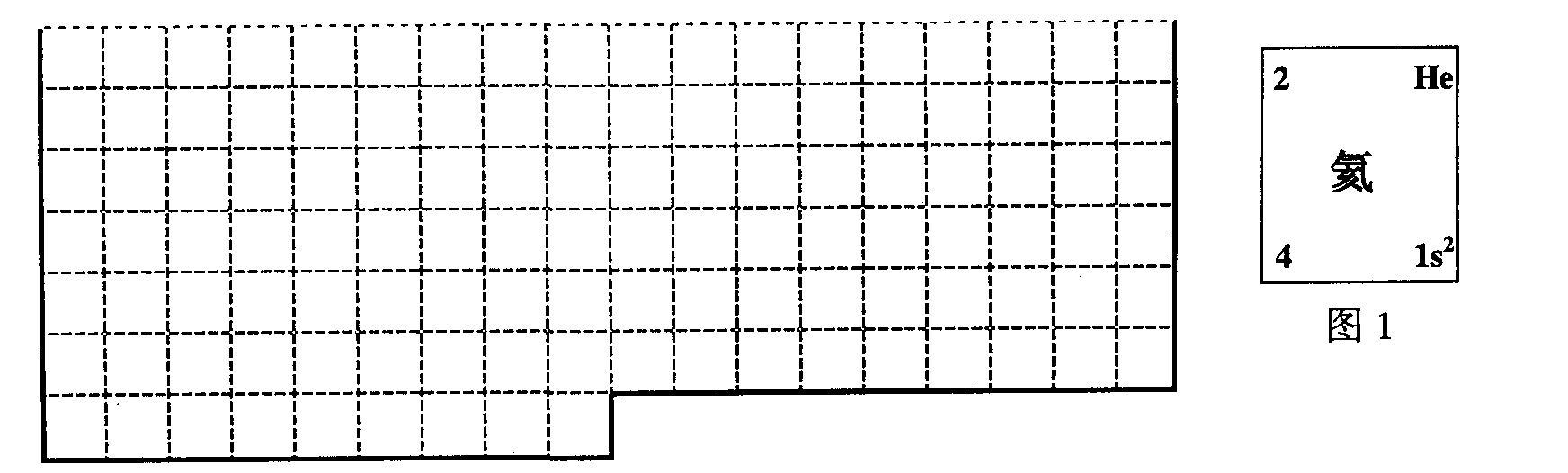
(1)
(2分)
S
硫
32 3S23P4
(2)
(3)3S23P1Al>S
(4)周期性变化 元素的周期数即为原子结构最外电子层数;元素的主族序数即为原子结构的最外层电子数。
23(B)
(2)1个 H:N:H (3)-2 氟 (4)C
24.(本题共8分)
26(B)(1)①防暴沸 冷凝 ②防止环己烯挥发
(2)①上层 C ②g 冷却水与气体形成逆流 ③83oC b (3)C
27.(本题共12分)
(5)③测出CO2的质量 ④测出水蒸汽的质量 (6)3、1、3
六、(本题共20分)
28.(本题共9分)
(1)b (2)C7H10 (3) -CH3(4)a、d
29.(本题共11分)
(1)a、CH3CH2CH2COOH b、CH3CH2COOCH3
(2)羟基、醛基 CH3COCH2COOH
(3)a; b、c (4)CH3CHOHCH2CHO → CH3CH=CHCHO+H2O
(5) nCH3CH=CHCH2OH → [-CH-CH]n
(6)CH3CH2CH
七、(本题共16分)
30.(本题共6分)
((1)2:1 (2)0.71 (3)3.6克
31.(本题共10分)
(4)①
②3n(A)=0.8{n(B)-125}