2006 年普通高等学校招生全国统一考试(江苏卷)
化学
可能用到的原子量:H 1 Li 7 C 12 N 14 O 16 Na 23 Al 27 S 32 Cl 35.5
Fe 56 Cu 64 Zn 65 Br 80 Ag 108 I 127 Ce 140 Pb 207
一、单项选择题(本题包括8小题,每小题4分,共32分。每小题只是一个选项符合题意)
- 空气是人类生存所必需的重要资源。为改善空气质量而启动的“蓝天工程”得到了全民的支持。下列措施不利于“蓝天工程”建设的是
A.推广使用燃煤脱硫技术,防治SO2污染
B.实施绿化工程,防治扬尘污染
C.研制开发燃料电池汽车,消除机动车尾气污染
D.加大石油、煤炭的开采速度,增加化石燃料的供应量 - 氢元素与其他元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是
A.一个D2O分子所含2的中子数为8 B.NH3的结构式为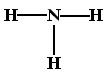
C.HCl的电子式为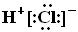 D.热稳定性:H2S>HF
D.热稳定性:H2S>HF - 物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度有关。
下列各组物质:
①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与HCl溶液
A.①③ B.③④ C.①② D.①③④ - 以下实验装置一般不用于分离物质的是
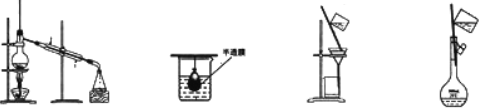
A B C D - 下列反应的离子方程式正确的是
A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2OFe(OH)3↓+3H+
B.用小苏打治疗胃酸过多:HCO3-+H+===CO2↑+H2O
C.实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl-Cl2↑+Mn2++H2O
D.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu===Fe2++Cu2+ - 阿伏加德罗常数约为6.02×1023mol-1,下列说法中正确的是
A.1.0L 1.0mol·L-1CH3COOH溶液中,CH3COOH分子数为6.02×1023
B.Na2O2与H2O反应生成1.12L O2(标准状况),反应中转移的电子数为2×6.02×1023
C.32 g S8单质中含有的S—S键个数为6.02×1023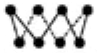
D.22.4 L N2中所含的分子数为6.02×1023 - 将5.4g Al 投入到200.0mL 2.0mol·L-1的某溶液中有氢气产生,充分反应后有金属剩余。该溶液可能为
A.HNO3溶液 B.Ba(OH)2溶液 C.H2SO4溶液 D.HCl溶液 - 下列各组热化学方程式中,化学反应的△H前者大于后者的是
①C(s)+O2(g)===CO2(g);△H1C(s)+O2(g)===CO(g);△H2
②S(s)+O2(g)===SO2(g);△H3S(g)+O2(g)===SO2(g);△H4
③H2(g)+O2(g)===H2O(l);△H52H2(g)+O2(g)===2H2O(l);△H6
④CaCO3(s)===CaO(s)+CO2(g);△H7CaO(s)+H2O(l)===Ca(OH)2(s);△H8
A.① B.④ C.②③④ D.①②③
二、不定项选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个该小题就为0分) - X、Y、Z是3种短周期元素,其中X、Y位于同一主族,Y、Z处于同一周期。X原子的最外层电子数是其电子层数的3倍。Z原子的核外电子数比Y原子少1。下列说法正确的是
A.元素非金属性由弱到强的顺序为Z<Y<X
B.Y元素最高价氧化物对应水化物的化学式可表示为H3YO4
C.3种元素的气态氢化物中,Z的气态氢化物最稳定
D.原子半径由大到小的顺序为Z>Y>X - 一定能在下列溶液中大量共存的离子组是
A.含有大量Al3+的溶液:Na+、NH4+、SO42-、Cl-
B.c(H+)=1×10-13mol·L-1的溶液:Na+、Ca2+、SO42-、CO32-
C.含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN-
D.含有大量NO3-的溶液:H+、Fe2+、SO42-、Cl- - 下列有关化学实验的叙述正确的是
 A.用待测液润洗滴定用的锥形瓶
A.用待测液润洗滴定用的锥形瓶
B.配制FeCl3溶液时,向溶液中加入少量Fe和稀盐酸
C.用稀盐酸洗涤盛放过石灰水的试剂瓶
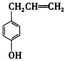
D.Na2CO3溶液保存在带玻璃塞的试剂瓶中 - 胡椒酚是植物挥发油中的一种成分。关于胡椒酚的下列说法:①该化合物属于芳香烃;②分子中至少有7个碳原子处于同一平面;③它的部分同分异构体能发生银镜反应;④1mol该化合物最多可与2molBr2发生反应。其中正确的是 胡椒酚
A.①③ B.①②④ C.②③ D.②③④ - 下列叙述正确的是
A.0.1mol·L-1氨水中,c(OH-)=c(NH4+)
B.10 mL 0.02mol·L-1HCl溶液与10 mL 0.02mol·L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12
C.在0.1mol·L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+)
D.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A) - 锂离子电池已经成为新一代实用化的蓄电池,该电池具有能量密度大、电压高的特性。锂离子电池放电时的电极反应式为
负极反应:C6Li-xe-===C6Li1-x+xLi+(C6Li表示锂原子嵌入石墨形成复合材料)
正极反应:Li1-xMO2+xLi++x e-===LiMO2(LiMO2表示含锂的过渡金属氧化物)
下列有关说法正确的是
A.锂离子电池充电时电池反应为C6Li+Li1-xMO2===LiMO2+C6Li1-x
B.电池反应中,锂、锌、银、铅各失去1mol电子,金属锂所消耗的质量最小
 C.锂离子电池放电时电池内部Li+向负极移动
C.锂离子电池放电时电池内部Li+向负极移动
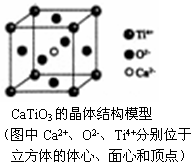
D.锂离子电池充电时阴极反应为C6Li1-x+xLi++x e-===C6Li - 下列关于晶体的说法一定正确的是
A.分子晶体中都存在共价键
B.CaTiO3晶体中每个Ti4+和12个O2-相紧邻
C.SiO2晶体中每个硅原子与两个氧原子以共价键相结合
D.金属晶体的熔点都比分子晶体的熔点高 - 某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量):
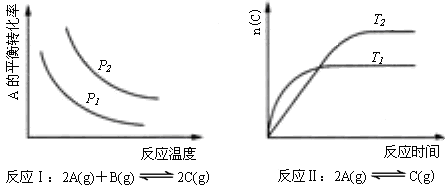
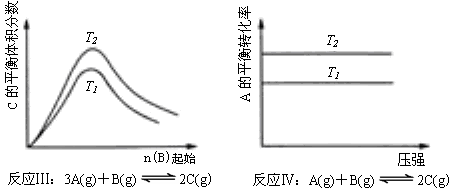
根据以上规律判断,下列结论正确的是
A.反应Ⅰ:△H>0,P2>P1
B.反应Ⅱ:△H<0,T1>T2
C.反应Ⅲ:△H>0,T2>T1;或△H<0,T2<T1
D.反应Ⅳ:△H<0,T2>T1
三、(本题包括2小题,共22分) - (10分)某化学兴趣小组按照下列方案进行“由含铁废铝制备硫酸铝晶体”的实验:
步骤1:取一定量含铁废铝,加足量的NaOH溶液,反应完全后过滤。
步骤2:边搅拌边向滤液中滴加稀硫酸至溶液的pH=8~9,静置、过滤、洗涤。
步骤3:将步骤2中得到的固体溶于足量的稀硫酸。
步骤4:将得到的溶液蒸发浓缩、冷却、结晶、过滤、干燥。
请回答以下问题:
⑴上述实验中的过滤操作需要玻璃棒、______________、______________等玻璃仪器。
⑵步骤1过滤的目的是__________________________________________。
⑶当步骤2中的溶液pH=8~9时,检验沉淀是否完全的方法是______________。
⑷步骤2中溶液的pH控制较难操作,可改用____________________。 - (10分)苯甲醛在医药、染料、香料等行业有着广泛的应用。实验室通过下图所示的流程由甲苯氧化制备苯甲醛。
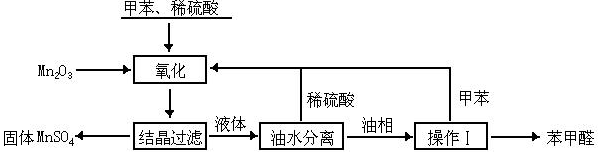
试回答下列问题:
⑴Mn2O3氧化甲苯的反应需要不断搅拌,搅拌的作用是______________。
⑵甲苯经氧化后得到的混合物通过结晶、过滤进行分离。该过程中需将混合物冷却,其目的是______________。
⑶实验过程中,可循环使用的物质分别为_______、_______。
⑷实验中分离甲苯和苯甲醛采用的操作Ⅰ是______________,其原理是______________。
⑸实验中发现,反应时间不同苯甲醛的产率也不同(数据见下表)。| 反应时间/h | 1 | 2 | 3 | 4 | 5 |
| 苯甲醛产率/% | 76.0 | 87.5 | 83.6 | 72.5 | 64.8 |
请结合苯甲醛的结构,分析当反应时间过长时,苯甲醛产率下降的原因______________。
四、(本题包括2小题,共18分) - (8分)卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,XX’型卤素互化物与卤素单质结构相似、性质相近。试回答下列问题:
⑴卤素互化物BrCl能发生下列反应
H2O+BrCl===HBrO+HCl
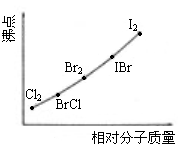 KBr+BrCl===KCl+Br2
KBr+BrCl===KCl+Br2
①写出KI与IBr反应的化学方程式______________。
②写出苯与(C6H6)与ICl发生取代反应生成一卤代物的化学方程式____________________________。⑵右图是部分卤素单质和XX’型卤素互化物的沸点与其相对分子质量的关系图。它们的沸点随着相对分子质量的增大而升高,其原因是______________。
⑶试推测ICl的沸点所处的最小范围______________。 - (10分)下图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去),已知:(a)A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体。(b)反应①②是化工生产中的重要反应。(c)化合物E是形成酸雨的污染物之一,化合物K是常用的氮肥。(d)化合物L具有漂白性,可由Cl2与NaOH溶液反应而制得。(e)化合物J由两种元素组成,其相对分子质量为32。
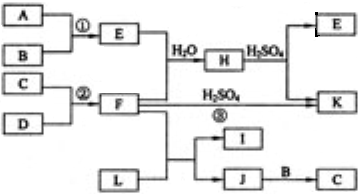
请按要求填空:
⑴反应③的化学方程式______________。
⑵C的结构式______________;H的化学式______________。
⑶L的溶液与化合物E反应的离子方程式______________。
⑷化合物J的化学式______________。
五、(本题包括1小题,共10分) 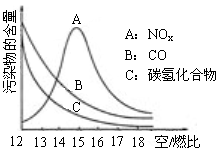 (10分)稀薄燃烧是指汽油在较大空/燃比(空气与燃油气的体积比)条件下的燃烧。随着全球能源危机的加剧,稀薄燃烧技术的研究受到了人们的重视,但稀薄燃烧时,常用的汽车尾气净化装置不能有效地将NOx转化为N2。不同空/燃比时汽车尾气中主要污染物的含量变化如右图所示。
(10分)稀薄燃烧是指汽油在较大空/燃比(空气与燃油气的体积比)条件下的燃烧。随着全球能源危机的加剧,稀薄燃烧技术的研究受到了人们的重视,但稀薄燃烧时,常用的汽车尾气净化装置不能有效地将NOx转化为N2。不同空/燃比时汽车尾气中主要污染物的含量变化如右图所示。
⑴稀薄燃烧技术除能节约能源外,还具有的优点是_______________(填一项)。排放到大气中的NOx会导致酸雨、_______________等环境问题(填一项)。
⑵某校化学研究性学习小组的同学在技术人员的指导下,按下列流程探究不同催化剂对NH3还原NO反应的催化性能。
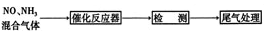
若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体通过滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同)。为比较不同催化剂的催化性能,需要测量并记录的数据是______________。
⑶若某一催化剂能同时催化NH3等还原性气体与的反应NOx的反应。将该催化剂分别用于催化还原含等物质的量NOx的两种气体:①纯NO气体,②汽车尾气。消耗的物质的量较多的可能是_______________(填字母),原因是______________________________。
A.① B.② C.都有可能
六、(本题包括2小题,共18分)- (8分)光刻胶是大规模集成电路、印刷电路板和激光制版技术中的关键材料。某一肉桂酸型光刻胶的主要成分A经光照固化转变为B。
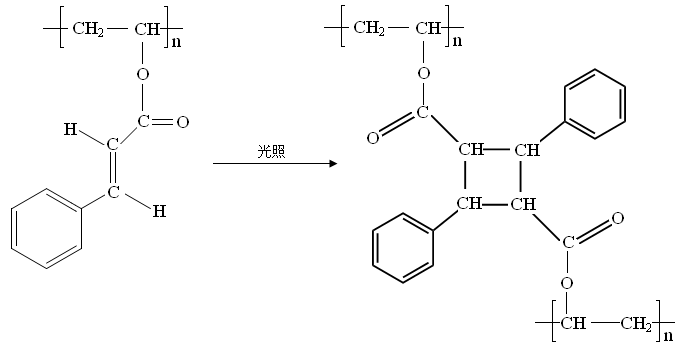
A B
⑴请写出A中含有的官能团_______________(填两种)。
⑵A经光照固化转变为B,发生了_______________反应(填反应类型)。
⑶写出A与NaOH溶液反应的化学方程式______________________________。
⑷写出B在酸性条件下水解得到的芳香族化合物的分子式_______________。 - (10分)香豆素是广泛存在于植物中的一类芳香族化合物,大多具有光敏性,有的还具有抗菌和消炎作用。它的核心结构是芳香内酯A,其分子式为C9H6O2。该芳香内酯A经下列步骤转变为水杨酸和乙二酸。
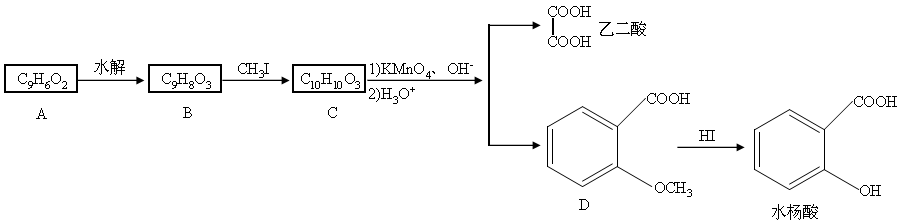
提示:
①CH3CH===CHCH2CH3 CH3COOH+CH3CH2COOH
CH3COOH+CH3CH2COOH
②R-CH=CH2 R-CH2-CH2-Br
R-CH2-CH2-Br
请回答下列问题:
⑴写出化合物C的结构简式_______________。
⑵化合物D有多种同分异构体,其中一类同分异构体是苯的二取代物,且水解后生成的产物之一能发生银镜反应。这类同分异构体共有_______________种。
⑶在上述转化过程中,反应步骤B→C的目的是_______________。
⑷请设计合理方案从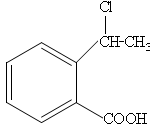 合成
合成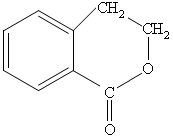 (用反应流程图表示,并注明反应条件)。
(用反应流程图表示,并注明反应条件)。
例:由乙醇合成聚乙烯的反应流程图可表示为
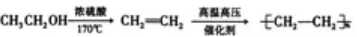
七、(本题包括2小题,共18分) - (8分)氯化亚铜(CuCl)是重要的化工原料。国家标准规定合格的CuCl产品的主要质量指标为CuCl的质量分数大于96.50%。工业上常通过下列反应制备CuCl
2CuSO4+Na2SO3+2NaCl+Na2CO3===2CuCl↓+3Na2SO4+CO2↑
⑴CuCl制备过程中需要配置质量分数为20.0%的CuSO4溶液,试计算配置该溶液所需的CuSO4·5H2O与H2O的质量之比。
⑵准确称取所配置的0.2500g CuCl样品置于一定量的0.5mol·L-1FeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000mol·L-1的Ce(SO4)2溶液滴定到终点,消耗24.60mLCe(SO4)2溶液。有关反化学反应为
Fe3++CuCl===Fe2++Cu2++Cl-
Ce4++Fe2+===Fe3++Ce3+
通过计算说明上述样品中CuCl的质量分数是否符合标准。 - (10分)利用太阳光分解水制氢是未来解决能源危机的理想方法之一。某研究小组设计了如右图所示
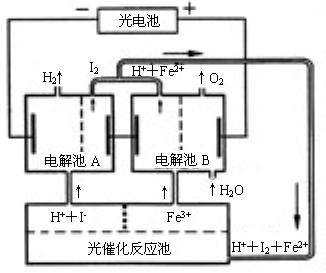 的循环系统实现光分解水制氢。反应过程中所需的电能由太阳能光电池提供,反应体系中I2和Fe3+等可循环使用。
的循环系统实现光分解水制氢。反应过程中所需的电能由太阳能光电池提供,反应体系中I2和Fe3+等可循环使用。
⑴写出电解池A、电解池B和光催化反应池中反应的离子方程式。
⑵若电解池A中生成3.36 L H2(标准状况),试计算电解池B中生成Fe2+的物质的量。
⑶若循环系统处于稳定工作状态时,电解池A中流入和流出的HI浓度分别为a mol·L-1和b mol·L-1,光催化反应生成Fe3+的速率为c mol·L-1,循环系统中溶液的流量为Q(流量为单位时间内流过的溶液体积)。试用含所给字母的代数式表示溶液的流量Q。
2006年高考化学试题参考答案(江苏卷)
一、单项选择题(本题包括8小题,每小题4分,共32分。)
1、D 2、B 3、A 4、D 5、B 6、C 7、D 8、C
二、不定项选择题(本题包括8小题,每小题4分,共32分。)
9、AD 10、A 11、C 12、C 13、BC 14、BD 15、B 16、BC
三、(本题包括2小题,共22分)

四、(本题包括2小题,共18分)
五、(本题包括1小题,共10分)

六、(本题包括2小题,共18分)

七、(本题包括2小题,共18分)




 A.用待测液润洗滴定用的锥形瓶
A.用待测液润洗滴定用的锥形瓶 C.锂离子电池放电时电池内部Li+向负极移动
C.锂离子电池放电时电池内部Li+向负极移动


 KBr+BrCl===KCl+Br2
KBr+BrCl===KCl+Br2
 (10分)稀薄燃烧是指汽油在较大空/燃比(空气与燃油气的体积比)条件下的燃烧。随着全球能源危机的加剧,稀薄燃烧技术的研究受到了人们的重视,但稀薄燃烧时,常用的汽车尾气净化装置不能有效地将NOx转化为N2。不同空/燃比时汽车尾气中主要污染物的含量变化如右图所示。
(10分)稀薄燃烧是指汽油在较大空/燃比(空气与燃油气的体积比)条件下的燃烧。随着全球能源危机的加剧,稀薄燃烧技术的研究受到了人们的重视,但稀薄燃烧时,常用的汽车尾气净化装置不能有效地将NOx转化为N2。不同空/燃比时汽车尾气中主要污染物的含量变化如右图所示。

 合成
合成 (用反应流程图表示,并注明反应条件)。
(用反应流程图表示,并注明反应条件)。 的循环系统实现光分解水制氢。反应过程中所需的电能由太阳能光电池提供,反应体系中I2和Fe3+等可循环使用。
的循环系统实现光分解水制氢。反应过程中所需的电能由太阳能光电池提供,反应体系中I2和Fe3+等可循环使用。



