
湖南省醴陵二中、醴陵四中2016-2017学年高二下学期期中联考化学试卷
03月05日
![]() 金山区2017学年第二学期质量监控
金山区2017学年第二学期质量监控
高三化学试卷 2018.04
相对原子质量:H-1 C-12 O-16 Na-23 Cl-35.5 Cu-64
| A | B | C | D | |
| 物质 | 煤油 | 丙醇 | 四氯化碳 | 乙醚 |
| 沸点℃ | 180-310 | 97.4 | 76.5 | 34.5 |
 19.下图是恒温下H2(g)+I2(g) 2HI(g)+Q(Q>0)的化学反应速率随反应时间变化的示意图,t1时刻改变的外界条件是
19.下图是恒温下H2(g)+I2(g) 2HI(g)+Q(Q>0)的化学反应速率随反应时间变化的示意图,t1时刻改变的外界条件是(一)(本题共15分)
NaNO2可将正常的血红蛋白中的二价铁变为高铁血红蛋白中的三价铁,失去携氧能力。
完成下列填空:
21.N元素在元素周期表中位于第____族,N原子最外层的电子排布式是______________。
22.Na、N、O三种元素形成的简单离子中,离子半径最小的是_______(用离子符号表示)。
23.某工厂的废液中含有2%~5%的NaNO2直接排放会造成污染。下列试剂中,能使NaNO2转化为N2的是______________(选填编号)。
a.NaClb.NH4Clc.HNO3d.H2SO4
24.已知NaNO2能发生如下反应:
NaNO2 + HI → NO↑+ I2 + NaI + H2O
(1)配平反应物的系数并标出电子转移的方向和数目
____NaNO2 +____ HI
(2)当有0.75mol HI被氧化时,在标准状况下产生气体的体积是_______L。
25.NaNO2外观与食盐相似,根据上述反应,可用于鉴别NaNO2和NaCl。现有 ①白酒、②碘化钾淀粉试纸、③淀粉、④白糖、⑤白醋,其中可选用的物质至少有______(选填编号)。
(二)(本题共15分)
以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
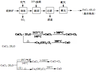
催化剂 高温
26.焙烧产生的SO2可以继续制备硫酸,其中的反应之一为:2SO2+O22SO3+Q(Q>0),该反应的平衡常数表达式为K=___________;欲使K值增大,可采取的措施是______________。若经一段时间后SO3的浓度增加了4mol/L,在这段时间内用O2表示的反应速率为0.4 mol/(L∙s),则这段时间为_______(选填编号)。
a.1sb.5sc.10sd.50s
27.硫铁矿焙烧后的烧渣中含有Fe2O3、Fe3O4等。酸溶后溶液中主要存在的阳离子有______________,不能用硫酸代替盐酸的原因是____________________________。
28.通入氯气时,主要反应的离子方程式为________________________。从氧化后的溶液中得到氯化铁晶体的实验步骤为_______________、_______________、过滤洗涤。
29.酸溶及后续过程中均需保持盐酸过量,请从水解平衡移动原理解释原因_________________________________________________________________________。
(三)(本题共15分)
CuCl广泛应用于化工和印染等行业。在实验室中模拟热分解CuCl2·xH2O制备CuCl的原理和实验装置如下:
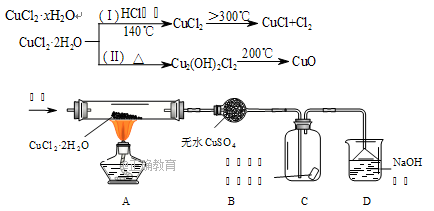
完成下列填空:
30.在实验(Ⅰ)过程中,观察到B中固体由白色变为蓝色,C中产生的现象是__________,导致该现象的物质是________________________。
CuCl2·xH2O
32.反应结束后,CuCl产品中可能存在少量的CuCl2或CuO杂质。
①若杂质是CuCl2,则原因是_________________________________________。
②若杂质是CuO,则原因是__________________________________________。
33.根据实验(Ⅱ),测定CuCl2·xH2O中结晶水的含量。取CuCl2·xH2O样品1.692g,经过3次灼烧、冷却、称量,得到黑色固体的质量数据如下:
| 称 量 | 第1次 | 第2次 | 第3次 |
| 质量(g) | 0.820g | 0.800g | 0.800g |
则x=_____________(保留2位小数)。
(四)(本题共15分)
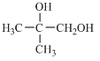
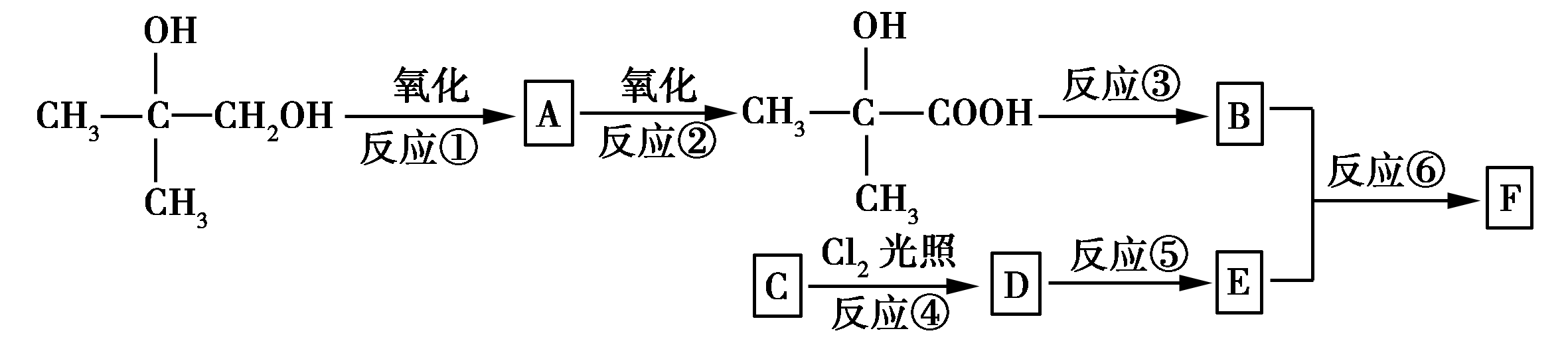
有机物E(C11H12O2) 属于芳香酯类物质,天然物存在于威士忌酒、苹果酒等中,呈水果及玫瑰香气,可由下列路线人工合成:
![]()
![]()
![]()
完成下列填空:
34.A中官能团的名称是________________;
C物质的结构简式是________________。
35.反应③的条件是_______________;反应④的类型是_____________________。
36.写出反应⑥的化学方程式:
__________________________________________________________________。
37.如何检验反应②中的A是否完全转化?
__________________________________________________________________。
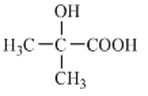
38.设计一条由![]() 出发,制备
出发,制备 的合成路线
的合成路线
(合成路线常用的表示方式为:)
__________________________________________________________________。
参考答案
一、选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| A | B | C | D | B | C | B | C | C | C |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| A | D | B | A | B | D | A | D | C | B |
二、综合分析题(共60分)
(一)(本题共15分)
21.VA(2分),2s22p3(2分)
22.Na+(2分)
23.b (2分);
24.2NaNO2+4HI (3分); 16.8 (2分);
25. ②⑤ (2分)
(二)(本题共15分)
26.K (1分) 降温 (2分) b (2分)
27.Fe2+、Fe3+、H+(H+不写不扣分) (2分),会引入SO42-离子,影响产品的纯度(2分)
28.2Fe2++Cl2→2Fe3++2Cl-。(2分) 蒸发浓缩、冷却结晶。(2分)
29.Fe3++3H2O⇌Fe(OH)3+3H+,盐酸过量,使[H+]增大,平衡朝逆向移动,抑制Fe3+的水解,增大了氯化铁晶体的产量(2分)
(三)(本题共15分)
30.先变红,后褪色(2分),盐酸和次氯酸(2分)
31.吸收尾气并防止倒吸(2分),Cl2+2NaOH→NaCl+NaClO+H2O(2分)
32.①加热时间不足或温度偏低(2分) ②通入HCl的量不足(2分)
33.1.90(3分)
(四)(本题共15分)
34.羟基、醛基(2分),![]() (1分)
(1分)
35.浓硫酸、加热(2分)取代反应(2分)
36.![]()
![]() (2分)
(2分)
37.取样,加入氢氧化钠溶液中和,再加入新制的氢氧化铜悬浊液,煮沸,若产生砖红色沉淀,则未完全转化。(2分)
38.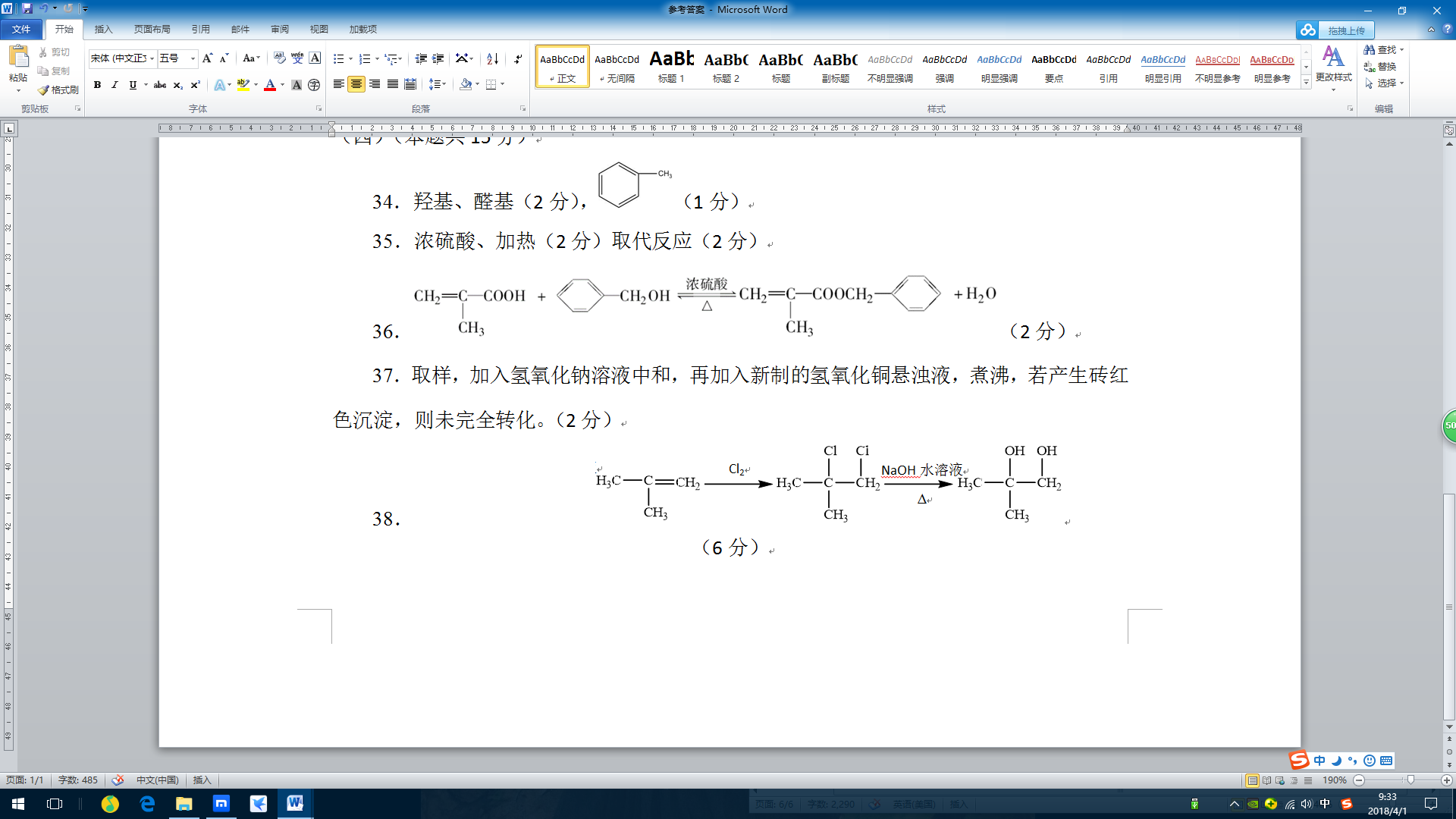 (4分)
(4分)