
湖南省醴陵二中、醴陵四中2016-2017学年高二下学期期中联考化学试卷
03月05日
虹口区 2016 学年度高三化学二模试卷
相对原子质量:H-1C-12N-14O-16Na-23S-32Fe-56Cu- 64
1.下列变化属于物理变化的是( )
A.煤的干馏B.钢铁生锈C.石油分馏D.粮食酿酒
2.下列有关化学用语表达正确的是( )
A.氟化氢的电子式:![]() B.氯原子的结构示意图:
B.氯原子的结构示意图:![]()
C.丙烯的结构简式:C3H6D.硫原子的最外层电子排布式:3s23p4
3.14C 常用于测定年代,关于其说法正确的是( )
A.比12C 多两个质子B.与12C 化学性质相似
C.与12C 互为同素异形体D.质子数与中子数相等
4.下列有关性质的比较,错误的是( )
A.酸性:H2SO4>H2CO3B.沸点:CBr4>CCl4
C.碱性:Al(OH)3>NaOHD.热稳定性:HF >HCl
5.下列有机物的系统命名正确的是( )$来&源:
A.2-乙基丁烷B.3,3-二甲基丁烷
C.2-甲基-1,3-丁二烯D.2,2-二甲基-3-戊炔
6.下列变化需要克服共价键的是( )
A.干冰的升华B.硅的熔化C.氯化钾的溶解 D.汞的气化
7.下列关于实验室制取乙酸丁酯的叙述,正确的是( )
A.使用过量的乙酸B.采用边反应边蒸馏的方法
C.反应采用水浴加热D.用氢氧化钠溶液提纯乙酸丁酯
8.下列生成 CO2的化学反应中,能用 2H++ CO32—→ H2O + CO2↑离子方程式表示的是( )
| A.稀盐酸与碳酸钙 | B.稀硫酸与碳酸氢钠 |
| C.稀醋酸与碳酸钠 | D.稀硝酸与碳酸钾 |
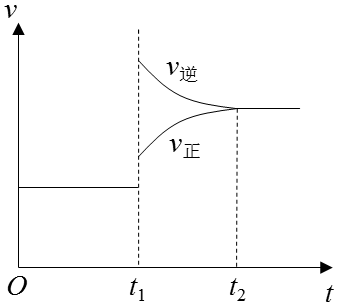 9.右图是工业合成氨反应的速率-时间图像,在t1时刻改变某一条件,到t2时重新达到平衡,判断t1时刻可能改变条件是( )
9.右图是工业合成氨反应的速率-时间图像,在t1时刻改变某一条件,到t2时重新达到平衡,判断t1时刻可能改变条件是( )
A.使用催化剂B.升高温度
C.增大压强D.提高 N2浓度
10.室温下,由水电离出的c(H+) = 10-11mol/L 溶液中,一定能大量存在的离子是( )
A.Fe3+B.CH3COO-C.HCO3-D.NO3-
11.已知:KClO3+ 6HCl(浓)→ KCl + 3Cl2+ 3H2O,氧化产物与还原产物物质的量之比为( )
 A.5 : 1B.1 : 5C.6 : 1D.1 : 6
A.5 : 1B.1 : 5C.6 : 1D.1 : 6
12.电解 CuCl2溶液的装置如右图所示,下列分析正确的是( )
A.b 电极的质量不变
B.b 电极是该装置的正极 C.a 电极上发生氧化反应
D.电子由 b 电极经溶液流向 a 电极
13.下列关于某无色溶液中离子检验的操作、现象与结论对应正确的是( )
| 检验操作 | 现象 | 结论 | |
| A | 加入盐酸酸化的氯化钡 | 产生白色沉淀 | 一定有 SO42- |
| B | 加入氯水与四氯化碳 | 有机层呈紫色 | 一定有 I- |
| C | 加入足量稀盐酸 | 产生无色气体 | 一定有 CO32- |
| D | 加入硝酸银 | 产生白色沉淀 | 一定有 Cl- |
14.海带提碘实验中,不会用到的装置是( )
A.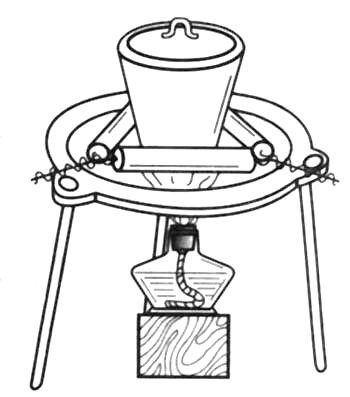 B.
B.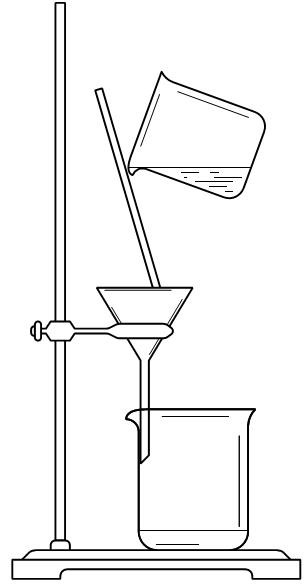 C.
C.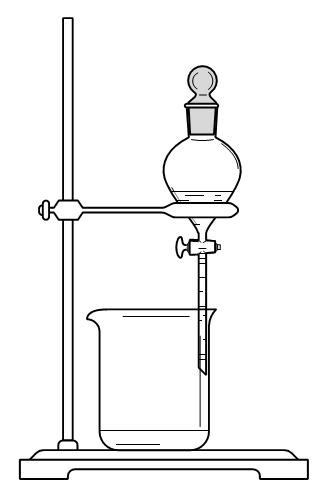 D.
D.![]()
15.向 0.1 mol/L 醋酸溶液中加水稀释,下列变化叙述错误的是( )
A.溶液的 pH 逐渐增大B.溶液中的c(OH-)逐渐减小
C.醋酸的电离程度逐渐增大D.溶液的导电能力逐渐减小
16.室温下,H2+ Cl2![]() 2HCl 生成 0.1 mol HCl,下列说法正确的是( )
2HCl 生成 0.1 mol HCl,下列说法正确的是( )
| A.生成 0.1 NA根共价键 | B.消耗反应物总体积 2.24L |
| C.转移了 2 NA个电子 | D.产物溶于水后,溶液 pH=1 |
17.已知25℃、101kPa 下,石墨、金刚石燃烧的热化学方程式如下:
C(石墨)+O2(g) → CO2(g)+393.51kJ; C(金刚石)+O2(g) → CO2(g)+395.41kJ,
下列说法正确的是( )
A.金刚石比石墨稳定B.石墨转化为金刚石需要吸热
C.金刚石燃烧产物更稳定D.等质量时,石墨所含能量高
18.下列关于有机化学实验的说法正确的是( )
A.除去苯中的甲苯,可使用酸性 KMnO4和 NaOH,然后分液
B.除去乙醇中混有的少量乙酸,加 NaOH 溶液,然后分液
C.检验溴乙烷中溴元素,直接加入硝酸银溶液生成浅黄色沉淀
D.实验室制备乙烯时,产生的气体直接通入溴水,溴水褪色,证明有乙烯生成
19.将等体积、等物质的量浓度的 NaClO 与 NaOH 溶液混合,下列离子浓度关系正确的是( )
A.c(ClO-) = c(OH-)B.c(ClO-) + c(OH—) = c(Na+)
C.c(OH-) = c(HClO) + c(H+)D.2c(ClO-) + 2c(HClO) = c(Na+)
20.将 6.4 g 铜与 140 mL 一定浓度的硝酸反应,铜完全溶解产生的 NO 和 NO2混合气体的体积为 3.36 L
(标准状况),其中 NO 的体积为(标准状况)
A.0.56 LB.1.344 LC.2.016 LD.2.8 L
Na2S常用作皮革脱毛剂,工业上用反应Na2SO4+2C8501000℃Na2S+2CO2↑进行制取。
完成下列填空:
21.硫元素在周期表中的位置为______________。上述反应中涉及的各元素中原子半径最小的是
__________(填元素符号)。写出硫化钠的电子式:___________。
22.用上述反应中涉及的元素,写出一个含有非极性键的化合物的化学式。 _____________
23.写出一个能比较 S 和 O 非金属性强弱的化学事实。________________________________
24.在 2L 的容器内发生上述反应,2 小时内共生成 78 g 硫化钠,则这段时间内用二氧化碳表示的平均反应速率为______________mol/(L·h) 。
25.将硫化钠溶液滴入氯化铝溶液中,产生白色沉淀,同时有臭鸡蛋气味的气体生成,用平衡移动原理解
释上述现象。
__________________________________________________________________
(二)本题共15分铁、铝是生活中常见的重要金属材料。
高温下炼铁的主要反应为:Fe2O3(s) + 3CO(g) 2Fe(s) + 3CO2(g) - Q
26.写出该反应的平衡常数的表达式_____________________。当混合气体的________________(填物理量名称)不变时,表明上述反应已达到平衡。
27.写出一种能提高上述反应中氧化铁转化率的措施__________________。取一定量铝热剂,在高温下进行铝热反应:2Al + Fe2O3高温2Fe + Al2O3。
28.请标出电子转移的方向和数目。若反应中有 1.5 mol 电子转移,可得到铁_______g。
29.将铝热剂直接加到足量氢氧化钠溶液中,有气体生成。请写出该现象对应的离子方程式。
_____________________________________________
30.若将铝热反应后所得固体用足量盐酸溶解,并加入硫氰化钾溶液,溶液不变血红色。据此能否确认固体中已不含氧化铁?说明理由。
______________________________________________________________________
______________________________________________________________________
(三)本题共15分氯酸钾是常见的氧化剂,用于制造火药、烟火,工业上用石灰乳氯化法制备氯酸钾的流程如下所示:
已知:氯化过程主要发生反应 6Ca(OH)2+ 6Cl2
完成下列填空:
31.工业生产氯气的方法是__________________。
32.氯化过程需要控制较高温度,其目的有:
1_____________________________; ②减少 Cl2与 Ca(OH)2之间的副反应。
33.向热的滤液中加入稍过量的氯化钾,待溶解完全后进行冷却,有大量氯酸钾晶体析出,写出相关反应
的化学方程式:__________________________________________________。
得到的氯酸钾晶体中可能会含有少量氯化钾,进一步提纯的方法是_________________。 34.为测定所得晶体中氯酸钾的纯度,将 ag 样品与 bg 二氧化锰混合,加热该混合物一段时间后(杂质
不参加反应)冷却,称量剩余固体质量,重复加热、冷却、称量操作,记录数据如下表:
| 加热次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 剩余固体质量(g) | c | d | e | e |
_______________________________________________________________
某功能高分子 P 的合成路线如下:
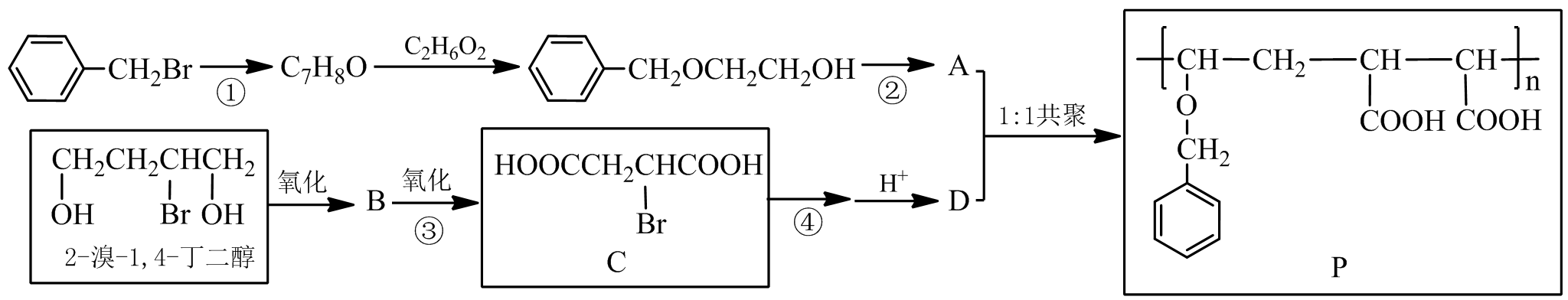
完成下列填空:
35.反应①所需试剂与条件是______________;反应②的反应类型是______________。
36.写出反应④的化学方程式。___________________________
37.设计实验方案证明反应③中 B 是否已完全转化为 C。___________________________
38.任写一种同时满足下列要求的 D 的同分异构体的结构简式。_____________________ i.属于酯类化合物 ii.分子中含有一个六元环
39.写出由 1,3-丁二烯为原料制备 2-溴-1,4-丁二醇合成路线。
反应试剂……反应试剂目标产物
(合成路线常用的表示方式为: A 反应条件 B反应条件)
___________________________________________________________________
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| C | D | B | C | C | B | A | D | B | D |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| A | C | B | D | B | A | B | A | D | A |
21.第三周期 VIA 族(2 分);O(2 分);![]() (2 分)
(2 分)
22.Na2O2(合理即可,2 分)
23.水的热稳定性比硫化氢强(合理即可,2 分)
24.0.5(2 分)
25.Na2S 溶液中 S2-水解显碱性:S2-+ H2O → HS-+ OH-,AlCl3溶液中 Al3+水解显酸性:Al3++ H2O → Al(OH)3
+ 3H+,两个水解反应相互促进,使水解进行到底,产生白色沉淀,同时有臭鸡蛋气味的气体产生。(3 分)
26.K=[c(CO2)]3/[c(CO)]3(2 分);质量、平均分子量、密度等(合理即给分)(2 分)。
27.升高温度、提高一氧化碳的浓度、及时移走二氧化碳等(合理即给分)(2 分)
28.![]() (2 分);28(2 分)
(2 分);28(2 分)
29.2Al + 2H2O + 2OH—→ 2AlO2—+ 3H2↑(2 分)
30.不能确认(1 分);因为所得固体中有铁,会将 Fe3+还原为 Fe2+(2 分)
31.电解饱和食盐水(2 分);
32.加快反应速率(2 分);
33.Ca(ClO3)2+ 2KCl → CaCl2+ 2KClO3↓(2 分);重结晶(2 分)
34.(1)坩埚(1 分);
②加热时间不足,氯酸钾未完全分解(任写一种,3 分)
35.NaOH 水溶液、加热(2 分);消去(2 分)
醇
| HOOCCH2CHCOOH+ 3NaOH 36.Br | NaOOC CCCOONa + NaBr + 3H2O HH (2 分) |
37.取样,加入足量 NaOH,再加入新制 Cu(OH)2(或银氨溶液),加热(或水浴加热),无砖红色沉淀生成(或无银镜生成),证明 B 已完全转化为 C。(3 分)
38.(任写一种,2 分)
39 . CH2=CH-CH=CH2Br2CH2BrCH=CHCH2Br NaOH/H2OHOCH2CH=CHCH2OH HBr
HOCH2CHBrCH2CH2OH(4 分)