成都石室中学高考模拟试题(二)
化学试题
化学试题分为第I(选择题)和第II卷(非选择题)。学生作答时,须将答案填写在答题卡上,在本试题卷、草稿纸上答题无效。
可能用到的相对原子质量:H-1 O-16 Na-23 P-31 S-32 Fe-56 Cu-64
第I卷(选择题共42分)
注意事项:
必须用2B铅笔在答题卡上将所选答案对应的标号涂黑。
第I卷共7小题,每小题6分。每题给出的四个选项中,只有一项是符合题目要求的。
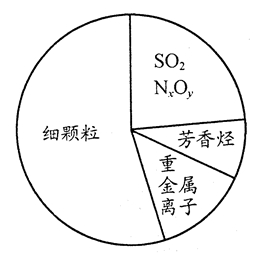 右图为雾霾的主要成分示意图。下列说法不正确的是( )
右图为雾霾的主要成分示意图。下列说法不正确的是( )
A.重金属离子可导致蛋白质变性
B.苯是最简单的芳香烃
C.向空气中大量排放SO2和NxOy都能引起酸雨和光化学烟雾
D.汽车尾气的大量排放是造成雾霾天气的人为因素之一- 分类是化学学习和研学的常用手段。下列分类依据和结论正确的是( )
A.纯碱、Na2O2、NH4NO3、Ca(OH)2均为离子化合物
B.HCl、H2SO4、HNO3均具有氧化性,都是氧化性酸
C.经分析某物质只含有一种元素,则该物质一定是纯净物
D.金属氧化物一定是碱性氧化物 - 设NA代表阿伏加德罗常数的数值,下列说法正确的是( )
A.已知白磷(P4)为正四面体形,12.4 g白磷中则含有共价键数为0.4 NA
B.3Fe+4H2O(g) Fe3O4+4H2反应中,当5.6 g Fe全部转化为Fe3O4时,则有0.3 NA电子发生转移
Fe3O4+4H2反应中,当5.6 g Fe全部转化为Fe3O4时,则有0.3 NA电子发生转移
C.在0.1 mol/L碳酸钠溶液中Na+总数等于0.2 NA
D.电解精炼铜时,当电路中转移NA个电子时,阴极增重32g - 下列离子方程式正确的是( )
- 草酸可使酸性高锰酸钾溶液褪色,其离子方程式为:
2MnO4-+ 5C2O42- + 16H+ = 2Mn2++ 10CO2↑+ 8H2O
B.向NH4Al(SO4)2溶液中加入过量的Ba(OH)2稀溶液:
NH4+ + Al3+ + 2SO42-+ 2Ba2+ + 5OH-=2BaSO4↓+ NH3·H2O + AlO2-+ 2H2O
C. NaHSO3溶液与FeCl3反应的离子方程式:SO32-+2 Fe3++H2O = SO42-+2 Fe2++ 2H+
D.NH4HCO3溶液中加入少量NaOH:NH4+ + OH-====NH3·H2O
5.仅用下表提供的仪器(夹持仪器和试剂任选)不能实现相应实验目的的是( )| 选项 | 实验目的 | 仪器 |
| A | 从食盐水中获得NaCl晶体 | 坩埚、玻璃棒、酒精灯、泥三角 |
| B | 除去氢氧化铝胶体中的泥沙 | 漏斗(带滤纸)、烧杯、玻璃棒 |
| C | 用0.1000mol/L盐酸测定未知浓度的NaOH溶液浓度 | 碱式滴定管、酸式滴定管、锥形瓶、胶头滴管、烧杯 |
| D | 用MnO2和浓盐酸反应制取干燥、纯净的Cl2 | 圆底烧瓶、分液漏斗、酒精灯、洗气瓶、集气瓶、导管、石棉网 |
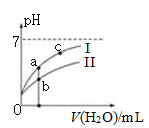 6. 已知:下表为25℃时某些弱酸的电离平衡常数。
6. 已知:下表为25℃时某些弱酸的电离平衡常数。| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7Ka2=4.7×10-11 |
右图表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH
随加水量的变化。下列说法正确的是( )
A.相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度
的大小关系是:c(Na+) >c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) - 向NaClO溶液中通入少量二氧化碳的离子方程式为: ClO-+CO2+ H2O =HClO+CO32-
- 图像中a、c两点处的溶液中
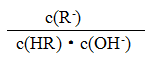 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
D.图像中a点酸的总浓度大于b点酸的总浓度
7.在一定温度下,将等量的气体分别通入起始体积相同的密闭容器Ⅰ和Ⅱ中,使其发生反应,t0时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量的变化如图所示。则下列有关推断正确的是( )
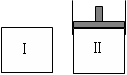
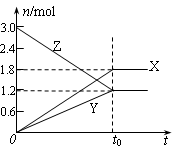
A.该反应的化学方程式为:3X+2Y 2Z
2Z
B.若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡所需时间小于t0
C.若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固态或液态
D.若达平衡后,对容器Ⅱ升高温度时,其体积增大,说明Z发生的反应为吸热反应
第II卷(非选择题共58分)
8.(12分)H、C、N、F、Al、Ca、Ni、Cu是中学阶段常见的元素,回答下面几个小题
(1)基态Ni的外围电子排布式为________________________
(2)比较C、N、Al的第一电离能____________________________(用元素符号表示)
(3)比较Cu、Al、C的最高价氧化物的沸点由高到低顺序为_____________________(用化学式表示)
 (4)常温下某气态有机物由C、O、H三种元素组成,写出其中C的杂化方式____________________
(4)常温下某气态有机物由C、O、H三种元素组成,写出其中C的杂化方式____________________
(5)Ni为电池中常见的材料,以Al和NiOOH为电极,NaOH为电解液组成电池,放电时NiOOH转化为Ni(OH)2写出电池的总反应_________________________
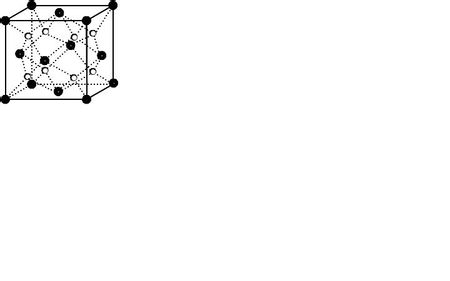
(6)Ca和F形成的某离子晶体结构如右图所示,Ca2+的配位数为______________。
9. (16分)绿矾(FeSO4•7H2O)是治疗缺铁性贫血的特效药。某化学兴趣小组对绿矾进行了如下的探究:
I .【制备产品】
该小组由废铁屑(含少量氧化铜、氧化铁等杂质),用上图所示装置制备FeSO4·7H2O晶体,步骤如下:
(1)预处理:先将废铁屑加入到饱和Na2CO3溶液中洗涤,目的是 ,然后将废铁屑用水洗涤2~3遍。
(2)将洗涤后的废铁屑加入到圆底烧瓶中,并持续通入N2,N2的作用是 。
(3)再加入足量稀硫酸,控制温度50℃~80℃之间,充分反应后,圆底烧瓶中剩余的固体为 。
(4)获取产品:先向步骤(3)中反应后的混合物中加入少许蒸馏水,趁热过滤, ______ _________。
滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干,密闭保存。
II.【测定FeSO4•7H2O含量】
(1)称取上述样品10.0g,溶于适量的稀硫酸中,配成100mL溶液,需要的仪器除天平、胶头滴管、烧杯、量筒外,还需要的仪器有(填仪器名称)____________________、_______________________。胶头滴管,250ml容量瓶
。。。
(2)准确量取25mL该液体于锥形瓶中,用0.1000mol/L KMnO4标准溶液滴定,则滴定终点的判断方法是______________________________________________。
(3)用同样的方法滴定3次,平均消耗10.00mL标准液,该样品中FeSO4·7H2O的质量分数为 。
(已知Mr(FeSO4·7H2O)=278)
(4)若测量结果偏小,则可能是在定容时_________________(填“俯视”或“仰视”)读数。
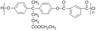
10.(14分)已知聚酯F是分子主链上带有苯环和酯基的特种工程塑料结构为
在航空航天等领域具有广泛应用。下图是利用乙酰丙酸CH3COCH2CH2COOH,合成聚酯F的路线如下:
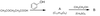
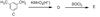
已知:①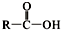 +SOCl2→
+SOCl2→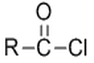 +SO2+HCl ②
+SO2+HCl ②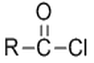 +R′OH→
+R′OH→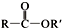 +HCl(R、R′表示烃基)
+HCl(R、R′表示烃基)
(1)乙酰丙酸中含有的官能团是羰基和_______________羧基
(填官能团名称)
(2)C的系统命名为____________________
(3)B、E合成聚酯F的反应类型为_______________________________
写出D生成E的化学反应方程式_________________________________________________
(4)乙酰丙酸生成A的化学反应方程式为___________________________________________
(5)下列关于有机物B的说法正确的是_______________abd
(填字母代号)。
a.1mol该物质最多能与2molNaOH反应b.1mol该物质最多能与2molBr2发生取代反应
c.不能发生消去反应 d.能与H2发生加成反应
(6)C8H6O4符合下列条件的D的同分异构体有_______________种。
①能发生银镜反应 ②能与NaHCO3溶液反应 ③分子中有苯环,分子中无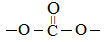 结构
结构
11.(16分) 亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O
②纯ClO2常温下为气体,易分解爆炸,一般用稀有气体或空气稀释到10%以下安全
(1)10%的 NaOH溶液的密度为1.2g/cm3其物质的量浓度为__________________________。
(2)在ClO2发生器中当1gSO2完全转化时,放出akJ热量,写出该热化学反应方程式___________________
鼓入Ar的作用是 。
(3)写出吸收塔内发生的化学反应方程式 _______________________________。吸收塔的温度不能超过40℃,其目的是________________________________。
(4)从滤液中得到的NaClO2•3H2O粗晶体中往往含有杂质,要得到更纯的NaClO2•3H2O晶体方法是_________________。
(5)工业处理含NaClO2废水时,先向废水中加入适量NaOH,用惰性电极电解该废水,同时制得NaClO3,
写出ClO2—在阳极放电时的电极反应方程式 。
(6)已知SO2和Ar的混合气体中,SO2的百分含量为5.6a%,当bL(标况下)该混合气体参加反应时,
理论上需要的17%的H2O2的质量为____________________ g(结果必须化简)。
成都石室中学高2015届模拟考试(二)
化学参考答案
1-7 CADBA CC
8、(12分)
(1)3d84s2 (2分) (2)N>C>Al (2分)
(3)Al2O3>CuO>CO2 (2分) (4)sp2杂化(2分)
- Al+3NiOOH+NaOH+H2O=3Ni(OH)2+NaAlO2(2分)
- 8 (2分)
9、(16分)
I.(1)洗去铁屑表面的油污(2分)
(2)排除装置中的空气或氧气 (2分)
(3)Cu(2分) (4)冷却结晶 (2分)
II.(1)100ml 容量瓶、玻璃棒 (每空1分)
(2)当最后一滴标准液滴入时,溶液变为红色,且30s保持不变 (2分)
(3)55.6% (2分) (4)仰视(2分)
10. (14分)
(1)羧基 (2分) (2) 1, 3-二甲苯 (2分)
(3)缩聚反应 (2分)
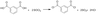 (2分)
(2分)
(4)
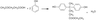 (2分)
(2分)
(5)cd (2分) (6)13 (2分)
11.(16分)
(1)3mol/L (2分)
(2)2NaClO3(aq)+SO2(g)=Na2SO4(aq)+2ClO2(g) ΔH= - 64akJ/mol (2分)
稀释ClO2防止分解爆炸(2分)
(3)H2O2+2ClO2+2NaOH=2NaClO2+O2↑+H2O (2分) 防止H2O2分解(2分)
(4)重结晶(2分)
(5)ClO2-- 2e-+2OH-=ClO3-+H2O (2分) (6)0.5ab(2分)

 右图为雾霾的主要成分示意图。下列说法不正确的是( )
右图为雾霾的主要成分示意图。下列说法不正确的是( ) 6. 已知:下表为25℃时某些弱酸的电离平衡常数。
6. 已知:下表为25℃时某些弱酸的电离平衡常数。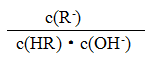 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)

 (4)常温下某气态有机物由C、O、H三种元素组成,写出其中C的杂化方式____________________
(4)常温下某气态有机物由C、O、H三种元素组成,写出其中C的杂化方式____________________
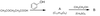
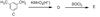
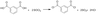 (2分)
(2分)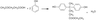 (2分)
(2分)